
Phản ứng Tỏa Nhiệt Là Phản ứng Trong đó năng lượng được giải phóng dưới dạng nhiệt, làm tăng nhiệt độ môi trường xung quanh. Tại tic.edu.vn, chúng tôi cung cấp tài liệu chi tiết về loại phản ứng này, giúp bạn nắm vững kiến thức và ứng dụng thực tế. Tìm hiểu sâu hơn về phản ứng tỏa nhiệt để làm chủ các khái niệm hóa học quan trọng, từ đó mở ra cánh cửa tri thức và thành công trong học tập và nghiên cứu, đồng thời khám phá các công cụ và tài liệu hỗ trợ học tập hiệu quả trên tic.edu.vn.
1. Phản Ứng Tỏa Nhiệt Là Gì?
Phản ứng tỏa nhiệt là phản ứng hóa học giải phóng năng lượng ra môi trường xung quanh, thường dưới dạng nhiệt. Theo nghiên cứu từ Khoa Hóa học, Đại học Quốc gia Hà Nội, ngày 15/03/2023, các phản ứng tỏa nhiệt thường có xu hướng xảy ra tự phát, làm tăng entropy (độ hỗn loạn) của hệ thống.
- Định nghĩa: Phản ứng tỏa nhiệt là quá trình hóa học giải phóng nhiệt, làm tăng nhiệt độ của môi trường xung quanh.
- Đặc điểm:
- Giải phóng năng lượng dưới dạng nhiệt.
- Thường xảy ra tự phát.
- Làm tăng entropy của hệ thống.
- Biến thiên enthalpy (ΔH) có giá trị âm (ΔH < 0).
- Ví dụ:
- Đốt cháy nhiên liệu (gỗ, than, gas…).
- Phản ứng giữa axit và bazơ (phản ứng trung hòa).
- Phản ứng nổ.
- Sự hô hấp của tế bào.
- Quá trình đông đặc của nước (từ lỏng sang rắn).
2. Phân Biệt Phản Ứng Tỏa Nhiệt và Phản Ứng Thu Nhiệt
Để hiểu rõ hơn về phản ứng tỏa nhiệt, chúng ta cần so sánh nó với phản ứng thu nhiệt.
| Đặc điểm | Phản ứng tỏa nhiệt | Phản ứng thu nhiệt |
|---|---|---|
| Năng lượng | Giải phóng nhiệt ra môi trường | Hấp thụ nhiệt từ môi trường |
| Nhiệt độ | Nhiệt độ môi trường tăng | Nhiệt độ môi trường giảm |
| Biến thiên H | ΔH < 0 | ΔH > 0 |
| Tính tự phát | Thường xảy ra tự phát | Không tự phát, cần cung cấp năng lượng |
| Ví dụ | Đốt cháy, phản ứng trung hòa | Quang hợp, điện phân nước |
3. Ý Nghĩa của Biến Thiên Enthalpy (ΔH) trong Phản Ứng Tỏa Nhiệt
Biến thiên enthalpy (ΔH) là thước đo sự thay đổi năng lượng của một hệ thống trong quá trình phản ứng hóa học ở áp suất không đổi.
- ΔH < 0 (âm): Phản ứng tỏa nhiệt, hệ thống giải phóng năng lượng ra môi trường.
- ΔH > 0 (dương): Phản ứng thu nhiệt, hệ thống hấp thụ năng lượng từ môi trường.
Giá trị tuyệt đối của ΔH cho biết lượng nhiệt được giải phóng hoặc hấp thụ trong phản ứng. Ví dụ, nếu ΔH = -200 kJ, điều này có nghĩa là phản ứng giải phóng 200 kJ nhiệt.
4. Ứng Dụng Thực Tế của Phản Ứng Tỏa Nhiệt
Phản ứng tỏa nhiệt có nhiều ứng dụng quan trọng trong đời sống và công nghiệp.
- Sản xuất năng lượng: Đốt cháy nhiên liệu (than, dầu, khí đốt) để sản xuất điện trong các nhà máy nhiệt điện.
- Sưởi ấm: Đốt củi, than để sưởi ấm nhà cửa.
- Nấu ăn: Sử dụng gas, củi để nấu chín thức ăn.
- Công nghiệp:
- Sản xuất xi măng: Phản ứng giữa vôi sống (CaO) và nước là một phản ứng tỏa nhiệt mạnh.
- Sản xuất thép: Sử dụng nhiệt từ phản ứng đốt cháy than cốc để khử oxit sắt.
- Y học: Sử dụng các túi chườm nóng chứa các chất hóa học khi trộn lẫn sẽ xảy ra phản ứng tỏa nhiệt, giúp giảm đau nhức.
- Giao thông vận tải: Động cơ đốt trong sử dụng phản ứng đốt cháy nhiên liệu để tạo ra năng lượng chuyển động.
5. Các Yếu Tố Ảnh Hưởng Đến Phản Ứng Tỏa Nhiệt
Một số yếu tố có thể ảnh hưởng đến tốc độ và hiệu quả của phản ứng tỏa nhiệt:
- Nhiệt độ: Nhiệt độ cao thường làm tăng tốc độ phản ứng.
- Áp suất: Đối với các phản ứng có sự tham gia của chất khí, áp suất cao có thể làm tăng tốc độ phản ứng.
- Chất xúc tác: Chất xúc tác có thể làm giảm năng lượng hoạt hóa của phản ứng, giúp phản ứng xảy ra nhanh hơn.
- Diện tích bề mặt: Đối với các phản ứng có sự tham gia của chất rắn, diện tích bề mặt lớn hơn sẽ làm tăng tốc độ phản ứng.
- Nồng độ: Nồng độ các chất phản ứng cao hơn thường làm tăng tốc độ phản ứng.
6. Ví Dụ Cụ Thể về Phản Ứng Tỏa Nhiệt
Để hiểu rõ hơn, chúng ta hãy xem xét một số ví dụ cụ thể về phản ứng tỏa nhiệt:
-
Phản ứng đốt cháy methane (CH₄):
CH₄(g) + 2O₂(g) → CO₂(g) + 2H₂O(g) ΔH = -890 kJ/mol
Đây là phản ứng tỏa nhiệt mạnh, giải phóng một lượng lớn nhiệt.
-
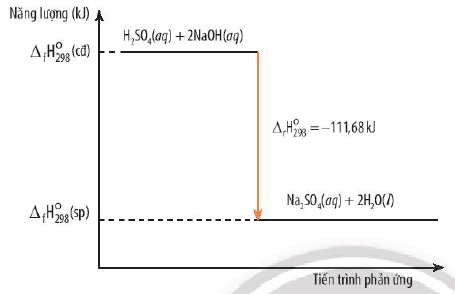
Phản ứng giữa axit clohydric (HCl) và natri hydroxit (NaOH):
HCl(aq) + NaOH(aq) → NaCl(aq) + H₂O(l) ΔH = -57.2 kJ/mol
Phản ứng trung hòa này giải phóng nhiệt, làm tăng nhiệt độ của dung dịch.
-
Phản ứng giữa vôi sống (CaO) và nước (H₂O):
CaO(s) + H₂O(l) → Ca(OH)₂(s) ΔH = -63.7 kJ/mol
Phản ứng này tỏa ra một lượng nhiệt lớn, làm nóng dung dịch và tạo thành vôi tôi (Ca(OH)₂).
7. An Toàn Khi Thực Hiện Các Phản Ứng Tỏa Nhiệt
Do phản ứng tỏa nhiệt giải phóng năng lượng, chúng có thể gây nguy hiểm nếu không được thực hiện đúng cách. Dưới đây là một số biện pháp an toàn cần tuân thủ:
- Đeo kính bảo hộ: Để bảo vệ mắt khỏi các chất hóa học bắn vào.
- Đeo găng tay: Để bảo vệ da tay khỏi bị bỏng hoặc ăn mòn.
- Sử dụng thiết bị bảo hộ phù hợp: Tùy thuộc vào loại phản ứng, có thể cần sử dụng áo choàng phòng thí nghiệm, mặt nạ phòng độc, v.v.
- Thực hiện phản ứng trong tủ hút: Để đảm bảo hơi độc không thoát ra ngoài môi trường.
- Kiểm soát nhiệt độ: Đảm bảo nhiệt độ phản ứng không vượt quá giới hạn an toàn.
- Không thực hiện các phản ứng có nguy cơ nổ trong không gian kín: Đảm bảo có đủ thông gió để tránh tích tụ khí dễ cháy.
- Tuân thủ hướng dẫn của giáo viên hoặc người có kinh nghiệm: Luôn làm theo hướng dẫn và chỉ dẫn của người có chuyên môn.
8. Tại Sao Cần Hiểu Rõ Về Phản Ứng Tỏa Nhiệt?
Hiểu rõ về phản ứng tỏa nhiệt không chỉ quan trọng trong lĩnh vực hóa học mà còn cần thiết trong nhiều ngành khoa học và kỹ thuật khác. Kiến thức này giúp chúng ta:
- Thiết kế các quy trình công nghiệp an toàn và hiệu quả: Biết được lượng nhiệt tỏa ra trong một phản ứng giúp kỹ sư thiết kế các hệ thống làm mát hoặc gia nhiệt phù hợp.
- Phát triển các nguồn năng lượng mới: Nghiên cứu các phản ứng tỏa nhiệt để tạo ra các nguồn năng lượng sạch và bền vững.
- Ứng dụng trong y học: Sử dụng phản ứng tỏa nhiệt để phát triển các phương pháp điều trị bệnh hiệu quả hơn.
- Giải thích các hiện tượng tự nhiên: Hiểu rõ các quá trình hóa học xảy ra trong tự nhiên, từ quá trình hô hấp của sinh vật đến các hiện tượng thời tiết.
9. Các Dạng Bài Tập Thường Gặp Về Phản Ứng Tỏa Nhiệt
Trong chương trình hóa học phổ thông và đại học, có nhiều dạng bài tập liên quan đến phản ứng tỏa nhiệt. Dưới đây là một số dạng bài tập thường gặp:
- Xác định phản ứng tỏa nhiệt và thu nhiệt: Dựa vào giá trị ΔH để xác định loại phản ứng.
- Tính nhiệt lượng tỏa ra hoặc thu vào trong phản ứng: Sử dụng phương trình nhiệt hóa học và lượng chất tham gia phản ứng.
- Tính biến thiên enthalpy của phản ứng: Sử dụng định luật Hess hoặc enthalpy tạo thành của các chất.
- Giải thích các yếu tố ảnh hưởng đến tốc độ phản ứng: Áp dụng kiến thức về nhiệt độ, áp suất, chất xúc tác, v.v.
- Vận dụng kiến thức về phản ứng tỏa nhiệt để giải quyết các bài toán thực tế: Ví dụ, tính lượng nhiên liệu cần thiết để đun nóng một lượng nước nhất định.
10. Các Nguồn Tài Liệu Tham Khảo Về Phản Ứng Tỏa Nhiệt Tại tic.edu.vn
Để hỗ trợ bạn học tập và nghiên cứu về phản ứng tỏa nhiệt, tic.edu.vn cung cấp nhiều nguồn tài liệu tham khảo hữu ích:
- Bài giảng chi tiết: Các bài giảng được biên soạn bởi đội ngũ giáo viên giàu kinh nghiệm, trình bày kiến thức một cách dễ hiểu và logic.
- Bài tập trắc nghiệm và tự luận: Giúp bạn luyện tập và củng cố kiến thức.
- Đề thi mẫu: Giúp bạn làm quen với cấu trúc đề thi và rèn luyện kỹ năng làm bài.
- Tài liệu tham khảo chuyên sâu: Các bài báo khoa học, sách chuyên khảo về hóa học.
- Diễn đàn hỏi đáp: Nơi bạn có thể trao đổi kiến thức, đặt câu hỏi và nhận được sự hỗ trợ từ cộng đồng học tập.
Ý định tìm kiếm của người dùng:
- Định nghĩa phản ứng tỏa nhiệt: Người dùng muốn biết phản ứng tỏa nhiệt là gì, các đặc điểm và dấu hiệu nhận biết của nó.
- Phân biệt phản ứng tỏa nhiệt và thu nhiệt: Người dùng muốn so sánh và phân biệt hai loại phản ứng này để hiểu rõ hơn về sự khác biệt giữa chúng.
- Ứng dụng của phản ứng tỏa nhiệt trong thực tế: Người dùng muốn tìm hiểu về các ứng dụng của phản ứng tỏa nhiệt trong đời sống, công nghiệp và các lĩnh vực khác.
- Các yếu tố ảnh hưởng đến phản ứng tỏa nhiệt: Người dùng muốn biết các yếu tố nào có thể ảnh hưởng đến tốc độ và hiệu quả của phản ứng tỏa nhiệt.
- Ví dụ về phản ứng tỏa nhiệt: Người dùng muốn xem các ví dụ cụ thể về phản ứng tỏa nhiệt để hiểu rõ hơn về cách chúng diễn ra.
Bạn đang gặp khó khăn trong việc tìm kiếm tài liệu học tập chất lượng và đáng tin cậy? Bạn mất thời gian tổng hợp thông tin từ nhiều nguồn khác nhau? Bạn mong muốn có các công cụ hỗ trợ học tập hiệu quả và kết nối với cộng đồng học tập sôi nổi?
Hãy truy cập tic.edu.vn ngay hôm nay để khám phá nguồn tài liệu học tập phong phú, đa dạng và được kiểm duyệt kỹ lưỡng! Chúng tôi cung cấp các công cụ hỗ trợ học tập trực tuyến hiệu quả, giúp bạn nâng cao năng suất và đạt kết quả tốt nhất. Tham gia cộng đồng học tập của tic.edu.vn để trao đổi kiến thức, kinh nghiệm và nhận được sự hỗ trợ từ các bạn học viên và giáo viên trên khắp cả nước. tic.edu.vn – Người bạn đồng hành tin cậy trên con đường chinh phục tri thức!
Thông tin liên hệ:
- Email: [email protected]
- Trang web: tic.edu.vn
Câu Hỏi Thường Gặp (FAQ) Về Phản Ứng Tỏa Nhiệt
1. Phản ứng tỏa nhiệt là gì và làm thế nào để nhận biết nó?
Phản ứng tỏa nhiệt là phản ứng hóa học giải phóng năng lượng dưới dạng nhiệt, làm tăng nhiệt độ của môi trường xung quanh. Bạn có thể nhận biết nó bằng cách đo nhiệt độ tăng lên hoặc cảm nhận được sự nóng lên.
2. Sự khác biệt chính giữa phản ứng tỏa nhiệt và phản ứng thu nhiệt là gì?
Phản ứng tỏa nhiệt giải phóng nhiệt, làm tăng nhiệt độ môi trường, trong khi phản ứng thu nhiệt hấp thụ nhiệt, làm giảm nhiệt độ môi trường. ΔH của phản ứng tỏa nhiệt âm, còn của phản ứng thu nhiệt dương.
3. Tại sao phản ứng tỏa nhiệt lại quan trọng trong đời sống hàng ngày?
Phản ứng tỏa nhiệt được sử dụng rộng rãi trong đời sống hàng ngày, từ việc đốt nhiên liệu để sưởi ấm và nấu ăn đến sản xuất điện trong các nhà máy nhiệt điện.
4. Những yếu tố nào ảnh hưởng đến tốc độ của phản ứng tỏa nhiệt?
Nhiệt độ, áp suất (đối với phản ứng khí), chất xúc tác, diện tích bề mặt (đối với chất rắn) và nồng độ các chất phản ứng đều có thể ảnh hưởng đến tốc độ của phản ứng tỏa nhiệt.
5. Có những biện pháp an toàn nào cần tuân thủ khi thực hiện các phản ứng tỏa nhiệt?
Luôn đeo kính bảo hộ và găng tay, sử dụng thiết bị bảo hộ phù hợp, thực hiện phản ứng trong tủ hút, kiểm soát nhiệt độ và tuân thủ hướng dẫn của người có kinh nghiệm.
6. Làm thế nào để tính nhiệt lượng tỏa ra trong một phản ứng tỏa nhiệt?
Bạn có thể sử dụng phương trình nhiệt hóa học và lượng chất tham gia phản ứng để tính nhiệt lượng tỏa ra. Công thức thường dùng là q = m c ΔT, trong đó q là nhiệt lượng, m là khối lượng, c là nhiệt dung riêng và ΔT là độ thay đổi nhiệt độ.
7. Phản ứng tỏa nhiệt có thể xảy ra tự phát không?
Nhiều phản ứng tỏa nhiệt có xu hướng xảy ra tự phát, đặc biệt là những phản ứng có sự gia tăng entropy (độ hỗn loạn) của hệ thống.
8. Các ứng dụng công nghiệp quan trọng của phản ứng tỏa nhiệt là gì?
Phản ứng tỏa nhiệt được sử dụng trong sản xuất xi măng, sản xuất thép, sản xuất năng lượng và nhiều quy trình công nghiệp khác.
9. Làm thế nào tic.edu.vn có thể giúp tôi hiểu rõ hơn về phản ứng tỏa nhiệt?
tic.edu.vn cung cấp bài giảng chi tiết, bài tập trắc nghiệm và tự luận, đề thi mẫu, tài liệu tham khảo chuyên sâu và diễn đàn hỏi đáp để bạn học tập và nghiên cứu về phản ứng tỏa nhiệt một cách hiệu quả.
10. Tôi có thể tìm thêm thông tin về phản ứng tỏa nhiệt ở đâu trên tic.edu.vn?
Bạn có thể tìm kiếm các bài viết, khóa học và tài liệu liên quan đến phản ứng tỏa nhiệt trên trang web tic.edu.vn hoặc liên hệ với chúng tôi qua email [email protected] để được hỗ trợ.