
Công Thức C Phần Trăm là một khái niệm quan trọng trong hóa học, giúp chúng ta tính toán và biểu thị nồng độ của một chất trong dung dịch. Bài viết này từ tic.edu.vn sẽ cung cấp cho bạn kiến thức đầy đủ, chi tiết về công thức này, từ định nghĩa, cách sử dụng đến các ví dụ minh họa và ứng dụng thực tế, giúp bạn nắm vững kiến thức và tự tin chinh phục mọi bài toán liên quan đến nồng độ phần trăm và áp dụng hiệu quả vào thực tiễn. Nắm vững công thức tính nồng độ, bài tập áp dụng và lưu ý quan trọng giúp bạn sử dụng công thức hiệu quả nhất.
Contents
- 1. Nồng Độ Phần Trăm Là Gì? Định Nghĩa Chi Tiết Nhất
- 1.1. Giải Thích Cặn Kẽ Về Nồng Độ Dung Dịch
- 1.2. Ưu Điểm Của Việc Sử Dụng Nồng Độ Phần Trăm
- 2. Công Thức C Phần Trăm: Công Thức Chuẩn Xác Và Giải Thích Chi Tiết
- 2.1. Phân Tích Chi Tiết Các Thành Phần Trong Công Thức
- 2.2. Ví Dụ Minh Họa Cách Áp Dụng Công Thức
- 3. Hướng Dẫn Từng Bước Sử Dụng Công Thức Tính Nồng Độ Phần Trăm Hiệu Quả
- 3.1. Bước 1: Xác Định Các Chất Trong Dung Dịch
- 3.2. Bước 2: Tính Khối Lượng Dung Dịch Sau Phản Ứng
- 3.3. Bước 3: Xác Định Khối Lượng Chất Tan Cần Tính
- 3.4. Bước 4: Áp Dụng Công Thức Tính Nồng Độ Phần Trăm
- 4. Những Lưu Ý Quan Trọng Để Tránh Sai Sót Khi Tính Nồng Độ Phần Trăm
- 4.1. Đọc Kỹ Đề Bài Và Xác Định Đúng Các Thành Phần
- 4.2. Nhớ Chính Xác Công Thức Và Áp Dụng Phù Hợp
- 4.3. Tính Toán Cẩn Thận Và Kiểm Tra Kỹ Kết Quả
- 5. Mối Liên Hệ Giữa Nồng Độ Phần Trăm Và Các Loại Nồng Độ Dung Dịch Khác
- 5.1. Mối Liên Hệ Giữa Nồng Độ Mol Và Nồng Độ Phần Trăm
- 5.2. Ứng Dụng Của Việc Chuyển Đổi Giữa Các Loại Nồng Độ
- 6. Nồng Độ Mol Là Gì? Công Thức Tính Nồng Độ Mol Chi Tiết Nhất
- 6.1. Định Nghĩa Nồng Độ Mol
- 6.2. Công Thức Tính Nồng Độ Mol
- 6.3. Các Dạng Bài Tập Về Nồng Độ Mol
- 7. Bài Tập Vận Dụng Công Thức C Phần Trăm Có Lời Giải Chi Tiết
- 7.1. Bài Tập 1: Tính Nồng Độ Phần Trăm Của Dung Dịch NaCl
- 7.2. Bài Tập 2: Tính Nồng Độ Phần Trăm Của Dung Dịch Đường
- 7.3. Bài Tập 3: Tính Nồng Độ Phần Trăm Của Dung Dịch CaCl2
- 7.4. Bài Tập 4: Tính Nồng Độ Phần Trăm Của Dung Dịch NaCl Sau Phản Ứng
- 7.5. Bài Tập 5: Tính Nồng Độ Phần Trăm Của Dung Dịch KOH
- 8. Ứng Dụng Thực Tế Của Công Thức C Phần Trăm Trong Đời Sống Và Sản Xuất
- 8.1. Trong Y Tế
- 8.2. Trong Công Nghiệp Thực Phẩm
- 8.3. Trong Nông Nghiệp
- 8.4. Trong Hóa Học Và Nghiên Cứu
- 9. Lời Khuyên Để Học Tốt Môn Hóa Học
- 10. Câu Hỏi Thường Gặp Về Công Thức C Phần Trăm (FAQ)
- 10.1. Nồng độ phần trăm là gì và nó khác gì so với nồng độ mol?
- 10.2. Làm thế nào để tính khối lượng dung dịch khi chỉ biết khối lượng chất tan và khối lượng dung môi?
- 10.3. Tại sao cần phải đọc kỹ đề bài trước khi giải bài tập về nồng độ phần trăm?
- 10.4. Làm thế nào để chuyển đổi giữa nồng độ phần trăm và nồng độ mol?
- 10.5. Những lỗi nào thường gặp khi tính nồng độ phần trăm?
- 10.6. Công thức tính nồng độ phần trăm có ứng dụng gì trong thực tế?
- 10.7. Làm thế nào để học tốt các bài tập về nồng độ phần trăm?
- 10.8. Trang web tic.edu.vn có thể giúp tôi học tốt môn Hóa học như thế nào?
- 10.9. Tôi có thể tìm thêm bài tập về nồng độ phần trăm ở đâu?
- 10.10. Liên hệ với tic.edu.vn như thế nào nếu tôi có thắc mắc về công thức tính nồng độ phần trăm?
1. Nồng Độ Phần Trăm Là Gì? Định Nghĩa Chi Tiết Nhất
Nồng độ phần trăm (ký hiệu: C%) của một dung dịch cho biết số gam chất tan có trong 100 gam dung dịch. Hiểu một cách đơn giản, nồng độ phần trăm cho biết tỷ lệ phần trăm của chất tan trong toàn bộ dung dịch.
1.1. Giải Thích Cặn Kẽ Về Nồng Độ Dung Dịch
Nồng độ dung dịch là đại lượng biểu thị lượng chất tan có mặt trong một lượng dung dịch xác định. Theo nghiên cứu của Đại học Khoa học Tự nhiên TP.HCM năm 2020, nồng độ dung dịch có thể được điều chỉnh bằng cách thay đổi lượng dung môi hoặc chất tan. Một dung dịch được coi là bão hòa khi không thể hòa tan thêm chất tan, đạt đến nồng độ cao nhất có thể.
1.2. Ưu Điểm Của Việc Sử Dụng Nồng Độ Phần Trăm
Nồng độ phần trăm là một cách biểu diễn nồng độ dung dịch đơn giản, dễ hiểu và trực quan. Nó cho phép chúng ta dễ dàng so sánh nồng độ của các dung dịch khác nhau hoặc tính toán lượng chất tan cần thiết để pha chế một dung dịch có nồng độ mong muốn.
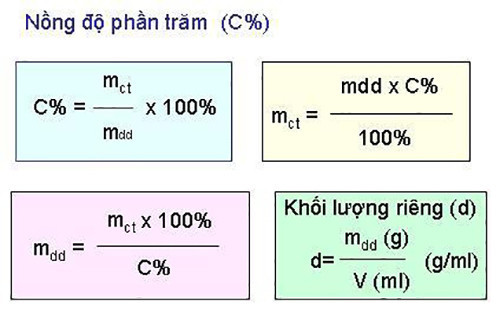
2. Công Thức C Phần Trăm: Công Thức Chuẩn Xác Và Giải Thích Chi Tiết
Công thức tính nồng độ phần trăm (C%) được biểu diễn như sau:
C% = (mct / mdd) x 100%
Trong đó:
- C%: Nồng độ phần trăm của dung dịch.
- mct: Khối lượng chất tan (gam).
- mdd: Khối lượng dung dịch (gam).
2.1. Phân Tích Chi Tiết Các Thành Phần Trong Công Thức
- mct (Khối lượng chất tan): Là khối lượng của chất được hòa tan trong dung môi để tạo thành dung dịch.
- mdd (Khối lượng dung dịch): Là tổng khối lượng của chất tan và dung môi. Công thức tính: mdd = mct + mdm (trong đó mdm là khối lượng dung môi).
Công thức tính nồng độ phần trăm, chìa khóa giúp bạn chinh phục các bài toán hóa học một cách dễ dàng
2.2. Ví Dụ Minh Họa Cách Áp Dụng Công Thức
Ví dụ: Hòa tan 20 gam đường vào 80 gam nước. Tính nồng độ phần trăm của dung dịch đường.
- mct (đường) = 20 gam
- mdm (nước) = 80 gam
- mdd = mct + mdm = 20 + 80 = 100 gam
Áp dụng công thức: C% = (mct / mdd) x 100% = (20 / 100) x 100% = 20%
Vậy nồng độ phần trăm của dung dịch đường là 20%.
3. Hướng Dẫn Từng Bước Sử Dụng Công Thức Tính Nồng Độ Phần Trăm Hiệu Quả
Để tính nồng độ phần trăm của một chất trong dung dịch một cách chính xác, hãy thực hiện theo các bước sau:
3.1. Bước 1: Xác Định Các Chất Trong Dung Dịch
Xác định rõ các chất có trong dung dịch, đặc biệt chú ý đến lượng chất dư sau phản ứng (nếu có).
3.2. Bước 2: Tính Khối Lượng Dung Dịch Sau Phản Ứng
Sử dụng công thức sau để tính khối lượng dung dịch sau phản ứng:
mdd = mcác chất tan + mdung môi – mkết tủa – mkhí
Trong đó:
- mcác chất tan: Tổng khối lượng các chất tan cho vào dung dịch.
- mdung môi: Khối lượng dung môi sử dụng.
- mkết tủa: Khối lượng chất kết tủa tạo thành (nếu có).
- mkhí: Khối lượng chất khí thoát ra (nếu có).
3.3. Bước 3: Xác Định Khối Lượng Chất Tan Cần Tính
Xác định khối lượng của chất tan mà bạn muốn tính nồng độ phần trăm.
3.4. Bước 4: Áp Dụng Công Thức Tính Nồng Độ Phần Trăm
Sử dụng công thức C% = (mct / mdd) x 100% để tính nồng độ phần trăm của chất tan.
4. Những Lưu Ý Quan Trọng Để Tránh Sai Sót Khi Tính Nồng Độ Phần Trăm
Để đảm bảo tính chính xác khi tính toán nồng độ phần trăm, hãy lưu ý những điều sau:
4.1. Đọc Kỹ Đề Bài Và Xác Định Đúng Các Thành Phần
Đọc kỹ thông tin đề bài cung cấp để xác định chính xác các thành phần đã cho và thành phần cần tính toán.
4.2. Nhớ Chính Xác Công Thức Và Áp Dụng Phù Hợp
Ghi nhớ chính xác công thức tính nồng độ phần trăm và áp dụng phù hợp với từng bài toán cụ thể. Tránh nhầm lẫn với các công thức tính nồng độ khác.
4.3. Tính Toán Cẩn Thận Và Kiểm Tra Kỹ Kết Quả
Thực hiện các phép tính cẩn thận, tỉ mỉ và kiểm tra kỹ kết quả để đảm bảo không có sai sót.
Những lưu ý quan trọng giúp bạn tính toán nồng độ phần trăm một cách chính xác và hiệu quả.
5. Mối Liên Hệ Giữa Nồng Độ Phần Trăm Và Các Loại Nồng Độ Dung Dịch Khác
Nồng độ phần trăm có mối liên hệ mật thiết với các loại nồng độ dung dịch khác như nồng độ mol (CM), nồng độ molan (Cm),… Hiểu rõ mối liên hệ này sẽ giúp bạn giải quyết các bài toán hóa học một cách linh hoạt và hiệu quả hơn.
5.1. Mối Liên Hệ Giữa Nồng Độ Mol Và Nồng Độ Phần Trăm
Công thức liên hệ giữa nồng độ mol (CM) và nồng độ phần trăm (C%) của chất tan có phân tử khối M là:
CM = (10 x D x C%) / M
Trong đó:
- CM: Nồng độ mol (mol/l).
- D: Khối lượng riêng của dung dịch (g/ml).
- C%: Nồng độ phần trăm.
- M: Phân tử khối của chất tan.
5.2. Ứng Dụng Của Việc Chuyển Đổi Giữa Các Loại Nồng Độ
Việc chuyển đổi giữa các loại nồng độ cho phép chúng ta dễ dàng tính toán và so sánh nồng độ của các dung dịch khác nhau, đặc biệt khi đề bài cho dữ kiện ở các dạng khác nhau.
6. Nồng Độ Mol Là Gì? Công Thức Tính Nồng Độ Mol Chi Tiết Nhất
Nồng độ mol (CM) là số mol chất tan có trong 1 lít dung dịch. Đây là một khái niệm quan trọng trong hóa học, đặc biệt trong các phản ứng hóa học xảy ra trong dung dịch.
6.1. Định Nghĩa Nồng Độ Mol
Nồng độ mol (CM) của một dung dịch là số mol chất tan có trong 1 lít dung dịch. Nồng độ mol cho biết lượng chất tan có trong một thể tích dung dịch xác định.
6.2. Công Thức Tính Nồng Độ Mol
Công thức tính nồng độ mol được biểu diễn như sau:
CM = n / V
Trong đó:
- CM: Nồng độ mol (mol/l).
- n: Số mol chất tan (mol).
- V: Thể tích dung dịch (lít).
6.3. Các Dạng Bài Tập Về Nồng Độ Mol
Có nhiều dạng bài tập khác nhau liên quan đến nồng độ mol, bao gồm:
- Tính nồng độ mol khi biết số mol và thể tích dung dịch.
- Tính số mol chất tan khi biết nồng độ mol và thể tích dung dịch.
- Tính thể tích dung dịch khi biết số mol và nồng độ mol.
- Tính nồng độ mol của dung dịch sau khi pha loãng hoặc trộn lẫn.
7. Bài Tập Vận Dụng Công Thức C Phần Trăm Có Lời Giải Chi Tiết
Để nắm vững kiến thức và kỹ năng giải bài tập liên quan đến nồng độ phần trăm, hãy cùng tic.edu.vn luyện tập với các ví dụ sau:
7.1. Bài Tập 1: Tính Nồng Độ Phần Trăm Của Dung Dịch NaCl
Hòa tan hết 20 gam NaCl vào 40 gam nước. Tính nồng độ phần trăm của dung dịch này.
Lời giải:
- mct (NaCl) = 20 gam
- mdm (nước) = 40 gam
- mdd = mct + mdm = 20 + 40 = 60 gam
Áp dụng công thức: C% = (mct / mdd) x 100% = (20 / 60) x 100% = 33,33%
Vậy nồng độ phần trăm của dung dịch NaCl là 33,33%.
7.2. Bài Tập 2: Tính Nồng Độ Phần Trăm Của Dung Dịch Đường
Hòa tan 10 gam đường vào 40 gam nước. Tính nồng độ phần trăm của dung dịch thu được.
Lời giải:
- mct (đường) = 10 gam
- mdm (nước) = 40 gam
- mdd = mct + mdm = 10 + 40 = 50 gam
Áp dụng công thức: C% = (mct / mdd) x 100% = (10 / 50) x 100% = 20%
Vậy nồng độ phần trăm của dung dịch đường là 20%.
7.3. Bài Tập 3: Tính Nồng Độ Phần Trăm Của Dung Dịch CaCl2
Hòa tan CaCO3 vào 200g dung dịch HCl 7,3% (vừa đủ). Tính nồng độ phần trăm của các chất có trong dung dịch sau phản ứng.
Lời giải:
- Tính khối lượng HCl trong dung dịch: mHCl = (C% x mdd) / 100% = (7,3 x 200) / 100 = 14,6 gam
- Tính số mol HCl: nHCl = mHCl / MHCl = 14,6 / 36,5 = 0,4 mol
- Phương trình phản ứng: CaCO3 + 2HCl → CaCl2 + H2O + CO2
- Theo phương trình, nCaCO3 = nCaCl2 = nCO2 = 1/2 nHCl = 0,2 mol
- Tính khối lượng CaCO3: mCaCO3 = nCaCO3 x MCaCO3 = 0,2 x 100 = 20 gam
- Tính khối lượng CaCl2: mCaCl2 = nCaCl2 x MCaCl2 = 0,2 x 111 = 22,2 gam
- Tính khối lượng CO2: mCO2 = nCO2 x MCO2 = 0,2 x 44 = 8,8 gam
- Tính khối lượng dung dịch sau phản ứng: mdd = mCaCO3 + mdd HCl – mCO2 = 20 + 200 – 8,8 = 211,2 gam
- Tính nồng độ phần trăm của CaCl2: C%CaCl2 = (mCaCl2 / mdd) x 100% = (22,2 / 211,2) x 100% = 10,51%
Vậy nồng độ phần trăm của dung dịch CaCl2 là 10,51%.
7.4. Bài Tập 4: Tính Nồng Độ Phần Trăm Của Dung Dịch NaCl Sau Phản Ứng
Cho 400g dung dịch NaOH 20% tác dụng vừa đủ với 200 gam dung dịch HCl, sinh ra NaCl và H2O. Tính nồng độ phần trăm của muối sinh ra sau phản ứng.
Lời giải:
- Tính khối lượng NaOH: mNaOH = (mdd x C%) / 100 = (400 x 20) / 100 = 80 gam
- Tính số mol NaOH: nNaOH = mNaOH / MNaOH = 80 / 40 = 2 mol
- Phương trình phản ứng: NaOH + HCl → NaCl + H2O
- Theo phương trình, nNaCl = nNaOH = 2 mol
- Tính khối lượng NaCl: mNaCl = nNaCl x MNaCl = 2 x 58,5 = 117 gam
- Khối lượng dung dịch sau phản ứng: mdd = mdd NaOH + mdd HCl = 400 + 200 = 600 gam
- Tính nồng độ phần trăm của NaCl: C%NaCl = (mNaCl / mdd) x 100% = (117 / 600) x 100% = 19,5%
Vậy nồng độ phần trăm của dung dịch NaCl là 19,5%.
7.5. Bài Tập 5: Tính Nồng Độ Phần Trăm Của Dung Dịch KOH
Tiến hành hòa tan 3,9 gam Kali vào 36,2 gam nước, thu được dung dịch B. Tính nồng độ phần trăm của dung dịch B.
Lời giải:
- Phương trình phản ứng: 2K + 2H2O → 2KOH + H2
- Tính số mol K: nK = mK / MK = 3,9 / 39 = 0,1 mol
- Theo phương trình, nKOH = nK = 0,1 mol
- Tính số mol H2: nH2 = 1/2 nK = 0,05 mol
- Tính khối lượng dung dịch sau phản ứng: mdd = mK + mH2O – mH2 = 3,9 + 36,2 – (0,05 x 2) = 40 gam
- Tính khối lượng KOH: mKOH = nKOH x MKOH = 0,1 x 56 = 5,6 gam
- Tính nồng độ phần trăm của KOH: C%KOH = (mKOH / mdd) x 100% = (5,6 / 40) x 100% = 14%
Vậy nồng độ phần trăm của dung dịch B là 14%.
8. Ứng Dụng Thực Tế Của Công Thức C Phần Trăm Trong Đời Sống Và Sản Xuất
Công thức tính nồng độ phần trăm không chỉ là kiến thức lý thuyết suông mà còn có rất nhiều ứng dụng thực tế trong đời sống và sản xuất:
8.1. Trong Y Tế
- Pha chế thuốc: Tính toán lượng hoạt chất cần thiết để pha chế các loại thuốc với nồng độ chính xác.
- Sản xuất dung dịch sát khuẩn: Xác định nồng độ cồn hoặc các chất khử trùng khác trong dung dịch sát khuẩn.
- Truyền dịch: Tính toán lượng muối hoặc đường cần thiết để pha chế dung dịch truyền cho bệnh nhân.
8.2. Trong Công Nghiệp Thực Phẩm
- Sản xuất đồ uống: Tính toán lượng đường, muối hoặc các chất phụ gia khác để tạo ra đồ uống có hương vị và chất lượng ổn định.
- Chế biến thực phẩm: Xác định nồng độ muối trong quá trình muối dưa, cà hoặc nồng độ đường trong sản xuất mứt, kẹo.
- Kiểm tra chất lượng: Đảm bảo nồng độ các chất trong thực phẩm đạt tiêu chuẩn quy định.
8.3. Trong Nông Nghiệp
- Pha chế phân bón: Tính toán lượng phân bón cần thiết để pha loãng thành dung dịch tưới cho cây trồng.
- Sản xuất thuốc trừ sâu: Xác định nồng độ hoạt chất trong thuốc trừ sâu để đảm bảo hiệu quả và an toàn khi sử dụng.
- Kiểm tra độ pH của đất: Xác định nồng độ axit hoặc bazơ trong đất để điều chỉnh độ pH phù hợp cho cây trồng phát triển.
8.4. Trong Hóa Học Và Nghiên Cứu
- Pha chế dung dịch chuẩn: Chuẩn bị các dung dịch có nồng độ chính xác để sử dụng trong các thí nghiệm và phân tích hóa học.
- Định lượng chất: Xác định nồng độ của một chất trong mẫu bằng phương pháp chuẩn độ.
- Nghiên cứu khoa học: Sử dụng công thức tính nồng độ phần trăm để theo dõi và kiểm soát các quá trình hóa học.
9. Lời Khuyên Để Học Tốt Môn Hóa Học
Để học tốt môn Hóa học nói chung và nắm vững công thức tính nồng độ phần trăm nói riêng, bạn cần:
- Nắm vững lý thuyết: Hiểu rõ các khái niệm cơ bản, định nghĩa, công thức và quy luật.
- Luyện tập thường xuyên: Giải nhiều bài tập khác nhau để rèn luyện kỹ năng và làm quen với các dạng toán.
- Học hỏi kinh nghiệm: Tham khảo ý kiến của thầy cô, bạn bè hoặc các nguồn tài liệu uy tín.
- Kết hợp học tập và thực hành: Tìm hiểu các ứng dụng thực tế của kiến thức hóa học trong đời sống và sản xuất.
- Sử dụng tài liệu tham khảo chất lượng: tic.edu.vn cung cấp nguồn tài liệu phong phú, đa dạng và được kiểm duyệt kỹ càng, giúp bạn học tập hiệu quả hơn.
10. Câu Hỏi Thường Gặp Về Công Thức C Phần Trăm (FAQ)
10.1. Nồng độ phần trăm là gì và nó khác gì so với nồng độ mol?
Nồng độ phần trăm (C%) cho biết số gam chất tan trong 100 gam dung dịch, trong khi nồng độ mol (CM) cho biết số mol chất tan trong 1 lít dung dịch.
10.2. Làm thế nào để tính khối lượng dung dịch khi chỉ biết khối lượng chất tan và khối lượng dung môi?
Khối lượng dung dịch bằng tổng khối lượng chất tan và khối lượng dung môi: mdd = mct + mdm.
10.3. Tại sao cần phải đọc kỹ đề bài trước khi giải bài tập về nồng độ phần trăm?
Đọc kỹ đề bài giúp bạn xác định chính xác các thông tin đã cho và yêu cầu của bài toán, từ đó lựa chọn công thức và phương pháp giải phù hợp.
10.4. Làm thế nào để chuyển đổi giữa nồng độ phần trăm và nồng độ mol?
Sử dụng công thức: CM = (10 x D x C%) / M, trong đó D là khối lượng riêng của dung dịch và M là phân tử khối của chất tan.
10.5. Những lỗi nào thường gặp khi tính nồng độ phần trăm?
Các lỗi thường gặp bao gồm: nhầm lẫn giữa khối lượng chất tan và khối lượng dung dịch, sai sót trong tính toán, áp dụng sai công thức.
10.6. Công thức tính nồng độ phần trăm có ứng dụng gì trong thực tế?
Công thức này được ứng dụng rộng rãi trong y tế, công nghiệp thực phẩm, nông nghiệp, hóa học và nghiên cứu.
10.7. Làm thế nào để học tốt các bài tập về nồng độ phần trăm?
Nắm vững lý thuyết, luyện tập thường xuyên, tham khảo ý kiến của thầy cô và sử dụng tài liệu tham khảo chất lượng.
10.8. Trang web tic.edu.vn có thể giúp tôi học tốt môn Hóa học như thế nào?
tic.edu.vn cung cấp nguồn tài liệu phong phú, đa dạng và được kiểm duyệt kỹ càng, giúp bạn học tập hiệu quả hơn.
10.9. Tôi có thể tìm thêm bài tập về nồng độ phần trăm ở đâu?
Bạn có thể tìm thêm bài tập trong sách giáo khoa, sách bài tập, trên internet hoặc tham khảo ý kiến của thầy cô.
10.10. Liên hệ với tic.edu.vn như thế nào nếu tôi có thắc mắc về công thức tính nồng độ phần trăm?
Bạn có thể liên hệ với tic.edu.vn qua email: [email protected] hoặc truy cập trang web: tic.edu.vn để được hỗ trợ.
Hy vọng với những kiến thức và bài tập được chia sẻ trong bài viết này, bạn đã nắm vững công thức C phần trăm và tự tin chinh phục mọi bài toán liên quan. Hãy truy cập tic.edu.vn ngay hôm nay để khám phá thêm nhiều tài liệu học tập hữu ích và các công cụ hỗ trợ hiệu quả, giúp bạn học tập tốt hơn và đạt được thành công trong học tập. Đừng quên chia sẻ bài viết này với bạn bè và những người quan tâm để cùng nhau học tập và phát triển.