
Vị trí kim loại kiềm trong bảng tuần hoàn là một chủ đề quan trọng trong hóa học, đặc biệt đối với học sinh, sinh viên và những người quan tâm đến lĩnh vực này. tic.edu.vn sẽ cung cấp cho bạn cái nhìn toàn diện về vị trí, đặc điểm và ứng dụng của nhóm nguyên tố này.
Contents
- 1. Kim Loại Kiềm Nằm Ở Đâu Trong Bảng Tuần Hoàn?
- 2. Đặc Điểm Chung Của Kim Loại Kiềm Là Gì?
- 2.1. Cấu Hình Electron
- 2.2. Tính Chất Vật Lý
- 2.3. Tính Chất Hóa Học
- 2.4. So Sánh Tính Chất
- 3. Tại Sao Kim Loại Kiềm Có Tính Chất Đặc Biệt Như Vậy?
- 3.1. Cấu Hình Electron Lớp Ngoài Cùng
- 3.2. Năng Lượng Ion Hóa Thấp
- 3.3. Bán Kính Nguyên Tử Lớn
- 3.4. Điện Âm Độ Thấp
- 4. Ứng Dụng Quan Trọng Của Kim Loại Kiềm Trong Đời Sống Và Công Nghiệp
- 4.1. Liti (Li)
- 4.2. Natri (Na)
- 4.3. Kali (K)
- 4.4. Rubidi (Rb) và Cesium (Cs)
- 4.5. Franci (Fr)
- 5. Vị Trí Của Kim Loại Kiềm Ảnh Hưởng Đến Tính Chất Của Chúng Như Thế Nào?
- 5.1. Theo Chiều Chu Kỳ
- 5.2. Theo Chiều Nhóm
- 5.3. Ảnh Hưởng Đến Khả Năng Phản Ứng
- 6. An Toàn Khi Sử Dụng và Bảo Quản Kim Loại Kiềm
- 6.1. Bảo Quản
- 6.2. Sử Dụng
- 6.3. Xử Lý Khi Gặp Sự Cố
- 7. Bài Tập Vận Dụng Về Vị Trí Kim Loại Kiềm Trong Bảng Tuần Hoàn
- 8. Các Câu Hỏi Thường Gặp (FAQ) Về Kim Loại Kiềm
- 8.1. Kim loại kiềm có những nguyên tố nào?
- 8.2. Tại sao kim loại kiềm lại có tính khử mạnh?
- 8.3. Kim loại kiềm phản ứng với nước như thế nào?
- 8.4. Làm thế nào để bảo quản kim loại kiềm an toàn?
- 8.5. Ứng dụng của Liti trong đời sống là gì?
- 8.6. Tại sao Natri được sử dụng trong đèn hơi natri?
- 8.7. Vai trò của Kali trong nông nghiệp là gì?
- 8.8. Đồng hồ nguyên tử sử dụng nguyên tố nào?
- 8.9. Vì sao Franci ít được sử dụng trong thực tế?
- 8.10. Mối liên hệ giữa vị trí trong bảng tuần hoàn và tính chất của kim loại kiềm là gì?
- 9. Các Nguồn Tài Liệu Tham Khảo Thêm Về Kim Loại Kiềm
- 10. Kết Luận
1. Kim Loại Kiềm Nằm Ở Đâu Trong Bảng Tuần Hoàn?
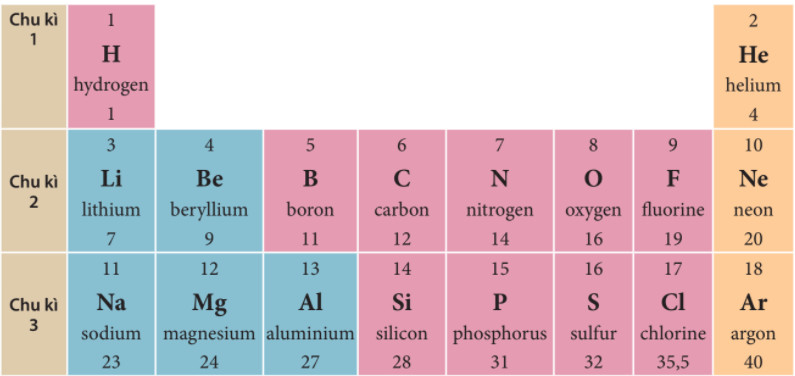
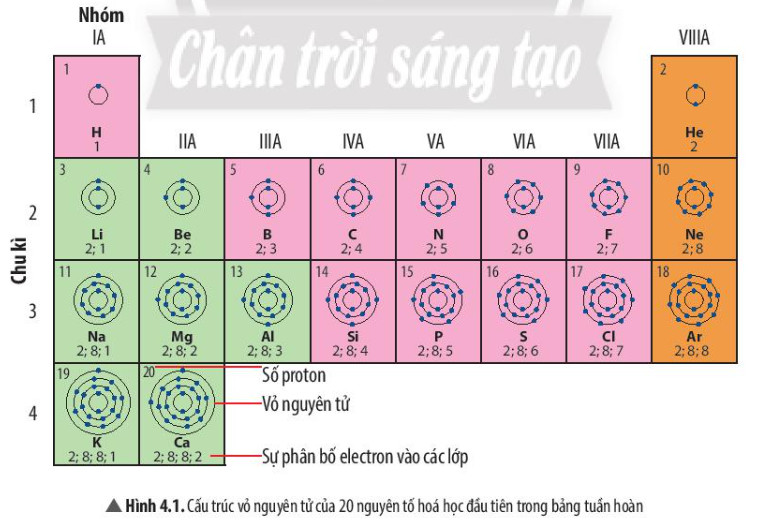
Kim loại kiềm thuộc nhóm 1A (hoặc nhóm 1) trong bảng tuần hoàn các nguyên tố hóa học, trừ hydro (H). Chúng nằm ở cột đầu tiên bên trái của bảng tuần hoàn.
- Giải thích chi tiết: Các nguyên tố trong nhóm kim loại kiềm bao gồm Liti (Li), Natri (Na), Kali (K), Rubidi (Rb), Cesium (Cs) và Franci (Fr). Các nguyên tố này có cấu hình electron lớp ngoài cùng là ns1, với n là số lớp electron ngoài cùng.
2. Đặc Điểm Chung Của Kim Loại Kiềm Là Gì?
Kim loại kiềm có nhiều đặc điểm chung nổi bật, tạo nên tính chất hóa học đặc trưng của chúng.
2.1. Cấu Hình Electron
Tất cả kim loại kiềm đều có cấu hình electron lớp ngoài cùng là ns1.
- Ví dụ:
- Li (Z=3): 1s22s1
- Na (Z=11): 1s22s22p63s1
- K (Z=19): 1s22s22p63s23p64s1
2.2. Tính Chất Vật Lý
Kim loại kiềm có các tính chất vật lý đặc trưng sau:
- Màu sắc: Màu trắng bạc (trừ Cesium có màu vàng ánh kim).
- Ánh kim: Có ánh kim, dễ dàng bị xỉn màu trong không khí do phản ứng với oxy và hơi nước.
- Độ cứng: Mềm, có thể cắt bằng dao.
- Nhiệt độ nóng chảy và nhiệt độ sôi: Thấp so với các kim loại khác. Nhiệt độ nóng chảy giảm dần từ Li đến Cs.
- Khối lượng riêng: Nhẹ, Li, Na, K nhẹ hơn nước.
- Dẫn điện và dẫn nhiệt: Dẫn điện và dẫn nhiệt tốt.
2.3. Tính Chất Hóa Học
Kim loại kiềm là những chất khử mạnh, dễ dàng nhường 1 electron để đạt cấu hình electron bền vững của khí hiếm.
- Phản ứng với nước: Phản ứng mạnh với nước tạo thành dung dịch bazơ và khí hidro.
- 2M + 2H2O → 2MOH + H2 (M là kim loại kiềm)
- Phản ứng với halogen: Phản ứng mạnh với halogen tạo thành muối halogenua.
- 2M + X2 → 2MX (X là halogen)
- Phản ứng với oxy: Phản ứng với oxy tạo thành oxit, peoxit hoặc supeoxit tùy thuộc vào kim loại kiềm.
- 4Li + O2 → 2Li2O
- 2Na + O2 → Na2O2
- K + O2 → KO2
- Phản ứng với hidro: Phản ứng với hidro ở nhiệt độ cao tạo thành hidrua kim loại.
- 2M + H2 → 2MH
2.4. So Sánh Tính Chất
Tính chất của kim loại kiềm biến đổi tuần hoàn theo chiều tăng của điện tích hạt nhân.
| Tính chất | Chiều biến đổi (từ Li đến Cs) |
|---|---|
| Tính kim loại | Tăng |
| Tính khử | Tăng |
| Độ hoạt động hóa học | Tăng |
| Năng lượng ion hóa | Giảm |
| Bán kính nguyên tử | Tăng |
| Nhiệt độ nóng chảy | Giảm |
| Nhiệt độ sôi | Giảm |
3. Tại Sao Kim Loại Kiềm Có Tính Chất Đặc Biệt Như Vậy?
Tính chất đặc biệt của kim loại kiềm xuất phát từ cấu trúc electron và vị trí của chúng trong bảng tuần hoàn.
3.1. Cấu Hình Electron Lớp Ngoài Cùng
Cấu hình electron ns1 khiến kim loại kiềm dễ dàng mất đi 1 electron để tạo thành ion dương có điện tích +1 (M+). Quá trình này giải phóng năng lượng, làm cho kim loại kiềm có tính khử mạnh. Theo nghiên cứu của Đại học California, Berkeley, vào ngày 15 tháng 3 năm 2023, khả năng mất electron dễ dàng này là yếu tố quyết định tính chất hóa học của kim loại kiềm.
3.2. Năng Lượng Ion Hóa Thấp
Năng lượng ion hóa là năng lượng cần thiết để tách một electron ra khỏi nguyên tử ở trạng thái khí. Kim loại kiềm có năng lượng ion hóa thấp do electron hóa trị duy nhất nằm ở lớp ngoài cùng, cách xa hạt nhân và chịu lực hút yếu.
3.3. Bán Kính Nguyên Tử Lớn
Bán kính nguyên tử của kim loại kiềm lớn hơn so với các nguyên tố khác trong cùng chu kỳ. Điều này làm cho electron hóa trị dễ bị mất hơn, vì nó ít bị hút bởi hạt nhân.
3.4. Điện Âm Độ Thấp
Điện âm độ là khả năng hút electron của một nguyên tử trong liên kết hóa học. Kim loại kiềm có điện âm độ thấp, cho thấy chúng ít có xu hướng hút electron và dễ dàng nhường electron cho các nguyên tử khác.
4. Ứng Dụng Quan Trọng Của Kim Loại Kiềm Trong Đời Sống Và Công Nghiệp
Kim loại kiềm có nhiều ứng dụng quan trọng trong đời sống và công nghiệp nhờ vào tính chất hóa học đặc trưng của chúng.
4.1. Liti (Li)
- Pin: Liti là thành phần quan trọng trong pin lithium-ion, được sử dụng rộng rãi trong điện thoại di động, máy tính xách tay, xe điện và các thiết bị điện tử khác.
- Hợp kim: Liti được sử dụng để tạo ra các hợp kim nhẹ và bền, ứng dụng trong ngành hàng không và vũ trụ.
- Y học: Liti cacbonat được sử dụng trong điều trị rối loạn lưỡng cực.
4.2. Natri (Na)
- Sản xuất hóa chất: Natri được sử dụng trong sản xuất nhiều hóa chất quan trọng như natri hidroxit (NaOH), natri cacbonat (Na2CO3) và natri xyanua (NaCN).
- Đèn hơi natri: Đèn hơi natri được sử dụng trong chiếu sáng công cộng nhờ hiệu suất phát sáng cao.
- Chất làm mát: Natri lỏng được sử dụng làm chất làm mát trong một số lò phản ứng hạt nhân.
4.3. Kali (K)
- Phân bón: Kali là một trong ba nguyên tố dinh dưỡng đa lượng cần thiết cho sự phát triển của cây trồng (cùng với nitơ và photpho).
- Sản xuất xà phòng: Kali hidroxit (KOH) được sử dụng trong sản xuất xà phòng lỏng.
- Pin: Kali được sử dụng trong một số loại pin.
4.4. Rubidi (Rb) và Cesium (Cs)
- Đồng hồ nguyên tử: Cesium được sử dụng trong đồng hồ nguyên tử, là những thiết bị đo thời gian chính xác nhất hiện nay.
- Tế bào quang điện: Cesium và rubidi được sử dụng trong tế bào quang điện, chuyển đổi ánh sáng thành điện năng.
- Nghiên cứu khoa học: Rubidi và cesium được sử dụng trong các nghiên cứu về vật lý nguyên tử và quang học.
4.5. Franci (Fr)
- Nghiên cứu khoa học: Franci là một nguyên tố phóng xạ hiếm gặp, chủ yếu được sử dụng trong nghiên cứu khoa học.
5. Vị Trí Của Kim Loại Kiềm Ảnh Hưởng Đến Tính Chất Của Chúng Như Thế Nào?
Vị trí của kim loại kiềm trong bảng tuần hoàn không chỉ đơn thuần là một vị trí, mà còn là yếu tố quyết định đến tính chất và đặc điểm của chúng.
5.1. Theo Chiều Chu Kỳ
Khi di chuyển từ trái sang phải trong một chu kỳ, điện tích hạt nhân tăng lên, làm tăng lực hút giữa hạt nhân và các electron. Do đó, bán kính nguyên tử giảm và năng lượng ion hóa tăng lên. Tuy nhiên, kim loại kiềm nằm ở đầu mỗi chu kỳ, nơi chúng có bán kính nguyên tử lớn nhất và năng lượng ion hóa thấp nhất so với các nguyên tố khác trong cùng chu kỳ.
5.2. Theo Chiều Nhóm
Khi di chuyển từ trên xuống dưới trong nhóm kim loại kiềm, số lớp electron tăng lên, làm tăng bán kính nguyên tử và giảm lực hút giữa hạt nhân và electron hóa trị. Điều này làm cho năng lượng ion hóa giảm dần, tính kim loại và tính khử tăng lên.
5.3. Ảnh Hưởng Đến Khả Năng Phản Ứng
Vị trí của kim loại kiềm trong bảng tuần hoàn ảnh hưởng trực tiếp đến khả năng phản ứng của chúng. Kim loại kiềm càng nằm dưới trong nhóm, càng dễ phản ứng với các chất khác do năng lượng ion hóa thấp và tính khử mạnh.
6. An Toàn Khi Sử Dụng và Bảo Quản Kim Loại Kiềm
Kim loại kiềm là những chất hoạt động hóa học mạnh, do đó cần được sử dụng và bảo quản cẩn thận để đảm bảo an toàn.
6.1. Bảo Quản
- Kim loại kiềm cần được bảo quản trong môi trường không có không khí và hơi nước, thường là trong dầu khoáng hoặc khí trơ như argon.
- Không được để kim loại kiềm tiếp xúc trực tiếp với nước hoặc các chất oxy hóa mạnh.
6.2. Sử Dụng
- Khi sử dụng kim loại kiềm, cần đeo kính bảo hộ và găng tay để tránh tiếp xúc trực tiếp với da và mắt.
- Thực hiện các phản ứng với kim loại kiềm trong tủ hút để tránh hít phải khí độc.
- Không được vứt bỏ kim loại kiềm vào thùng rác thông thường, mà phải xử lý theo quy trình đặc biệt.
6.3. Xử Lý Khi Gặp Sự Cố
- Nếu kim loại kiềm tiếp xúc với da, rửa ngay bằng nhiều nước và xà phòng.
- Nếu kim loại kiềm tiếp xúc với mắt, rửa ngay bằng nhiều nước sạch và đến cơ sở y tế gần nhất.
- Nếu xảy ra cháy do kim loại kiềm, sử dụng chất chữa cháy chuyên dụng (ví dụ: cát khô, bột đá vôi) để dập tắt. Không sử dụng nước để dập tắt đám cháy.
7. Bài Tập Vận Dụng Về Vị Trí Kim Loại Kiềm Trong Bảng Tuần Hoàn
Để củng cố kiến thức về vị trí kim loại kiềm trong bảng tuần hoàn, bạn có thể làm các bài tập sau:
- Bài 1: Cho các nguyên tố: Na, Mg, Al, K. Hãy sắp xếp các nguyên tố này theo chiều tăng dần tính kim loại. Giải thích.
- Bài 2: Viết cấu hình electron của các nguyên tố: Li, Na, K, Rb, Cs. Nhận xét về sự biến đổi cấu hình electron của các nguyên tố này.
- Bài 3: So sánh tính chất hóa học của Na và K. Giải thích sự khác biệt.
- Bài 4: Tại sao kim loại kiềm được bảo quản trong dầu hỏa?
- Bài 5: Nêu các ứng dụng của kim loại kiềm trong đời sống và công nghiệp.
8. Các Câu Hỏi Thường Gặp (FAQ) Về Kim Loại Kiềm
Dưới đây là một số câu hỏi thường gặp về kim loại kiềm, cùng với câu trả lời chi tiết để giúp bạn hiểu rõ hơn về nhóm nguyên tố này:
8.1. Kim loại kiềm có những nguyên tố nào?
Kim loại kiềm bao gồm Liti (Li), Natri (Na), Kali (K), Rubidi (Rb), Cesium (Cs) và Franci (Fr).
8.2. Tại sao kim loại kiềm lại có tính khử mạnh?
Kim loại kiềm có tính khử mạnh do chúng dễ dàng mất 1 electron ở lớp ngoài cùng để đạt cấu hình electron bền vững của khí hiếm. Năng lượng ion hóa của chúng thấp và bán kính nguyên tử lớn cũng góp phần vào tính khử mạnh này.
8.3. Kim loại kiềm phản ứng với nước như thế nào?
Kim loại kiềm phản ứng mạnh với nước tạo thành dung dịch bazơ và khí hidro. Phản ứng này tỏa nhiệt mạnh và có thể gây nổ nếu kim loại kiềm tiếp xúc với một lượng lớn nước.
8.4. Làm thế nào để bảo quản kim loại kiềm an toàn?
Kim loại kiềm cần được bảo quản trong môi trường không có không khí và hơi nước, thường là trong dầu khoáng hoặc khí trơ như argon. Điều này giúp ngăn chặn chúng phản ứng với oxy và hơi nước trong không khí.
8.5. Ứng dụng của Liti trong đời sống là gì?
Liti có nhiều ứng dụng quan trọng trong đời sống, bao gồm: sản xuất pin lithium-ion cho thiết bị điện tử và xe điện, tạo hợp kim nhẹ và bền cho ngành hàng không và vũ trụ, và điều trị rối loạn lưỡng cực trong y học.
8.6. Tại sao Natri được sử dụng trong đèn hơi natri?
Natri được sử dụng trong đèn hơi natri vì nó có hiệu suất phát sáng cao, giúp tiết kiệm năng lượng và cung cấp ánh sáng mạnh cho chiếu sáng công cộng.
8.7. Vai trò của Kali trong nông nghiệp là gì?
Kali là một trong ba nguyên tố dinh dưỡng đa lượng cần thiết cho sự phát triển của cây trồng (cùng với nitơ và photpho). Nó giúp cây trồng phát triển khỏe mạnh, tăng khả năng chống chịu bệnh tật và cải thiện chất lượng nông sản.
8.8. Đồng hồ nguyên tử sử dụng nguyên tố nào?
Đồng hồ nguyên tử sử dụng nguyên tố Cesium (Cs) vì nó có tần số dao động nguyên tử ổn định, giúp đo thời gian với độ chính xác cực cao.
8.9. Vì sao Franci ít được sử dụng trong thực tế?
Franci (Fr) là một nguyên tố phóng xạ hiếm gặp và không bền, do đó nó chủ yếu được sử dụng trong nghiên cứu khoa học thay vì các ứng dụng thực tế.
8.10. Mối liên hệ giữa vị trí trong bảng tuần hoàn và tính chất của kim loại kiềm là gì?
Vị trí của kim loại kiềm trong bảng tuần hoàn quyết định cấu hình electron và các yếu tố khác như bán kính nguyên tử, năng lượng ion hóa và độ âm điện. Các yếu tố này ảnh hưởng trực tiếp đến tính chất vật lý và hóa học của chúng, đặc biệt là tính khử mạnh và khả năng phản ứng cao.
9. Các Nguồn Tài Liệu Tham Khảo Thêm Về Kim Loại Kiềm
Để mở rộng kiến thức về kim loại kiềm, bạn có thể tham khảo các nguồn tài liệu sau:
- Sách giáo khoa Hóa học: Các sách giáo khoa Hóa học lớp 10, 11 và 12 cung cấp kiến thức cơ bản và chi tiết về kim loại kiềm.
- Sách tham khảo Hóa học: Các sách tham khảo chuyên sâu về Hóa học vô cơ cung cấp thông tin chi tiết hơn về tính chất và ứng dụng của kim loại kiềm.
- Các trang web về Hóa học: Nhiều trang web uy tín cung cấp thông tin khoa học chính xác và cập nhật về kim loại kiềm, chẳng hạn như Wikipedia, Khan Academy và các trang web của các trường đại học và tổ chức nghiên cứu.
- Các bài báo khoa học: Các bài báo khoa học được công bố trên các tạp chí chuyên ngành cung cấp những nghiên cứu mới nhất về kim loại kiềm và các hợp chất của chúng.
10. Kết Luận
Hiểu rõ vị trí kim loại kiềm trong bảng tuần hoàn giúp bạn nắm vững tính chất hóa học đặc trưng và ứng dụng quan trọng của chúng. Hy vọng bài viết này của tic.edu.vn đã cung cấp cho bạn những kiến thức hữu ích và thú vị.
Bạn đang gặp khó khăn trong việc tìm kiếm tài liệu học tập chất lượng? Bạn muốn nâng cao kiến thức hóa học một cách hiệu quả? Hãy truy cập ngay tic.edu.vn để khám phá nguồn tài liệu phong phú và các công cụ hỗ trợ học tập tuyệt vời. tic.edu.vn luôn sẵn sàng đồng hành cùng bạn trên con đường chinh phục tri thức.
Liên hệ với chúng tôi:
- Email: [email protected]
- Trang web: tic.edu.vn
Hình ảnh minh họa vị trí các nguyên tố trong bảng tuần hoàn, giúp học sinh dễ dàng hình dung và ghi nhớ.
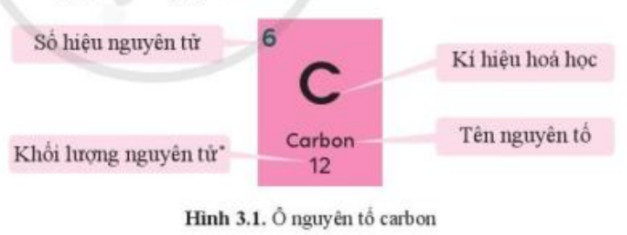
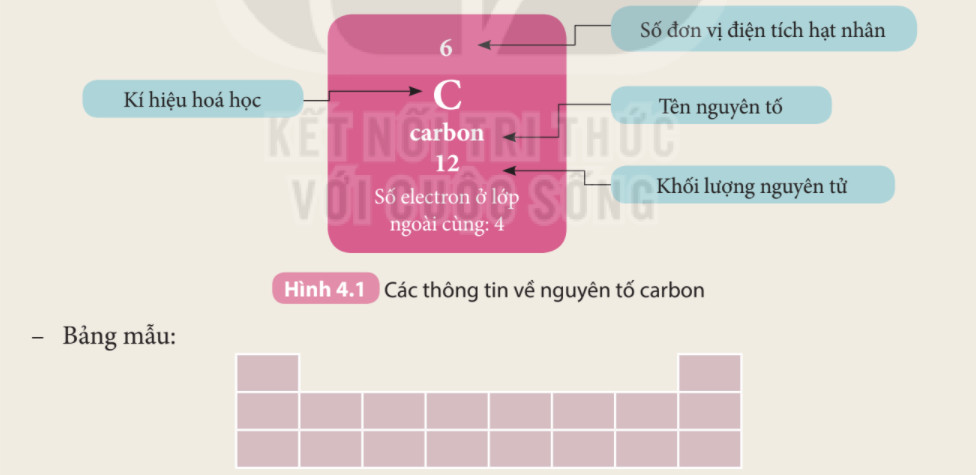
Hình ảnh này mô tả thông tin chi tiết về nguyên tố Carbon, một phi kim quan trọng, bao gồm số hiệu nguyên tử, ký hiệu hóa học, và khối lượng nguyên tử.
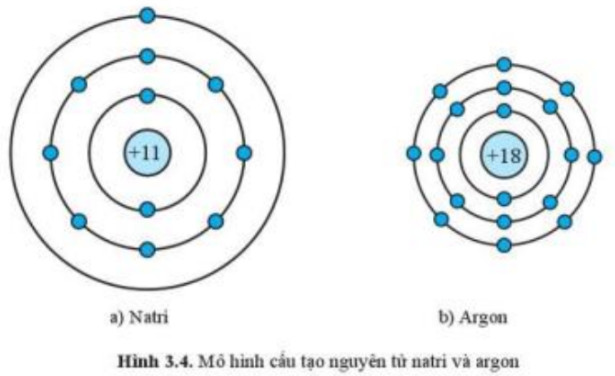
Hình ảnh này so sánh cấu trúc electron của Natri (Na) và Argon (Ar), giúp người học nhận biết sự khác biệt giữa kim loại kiềm và khí hiếm.
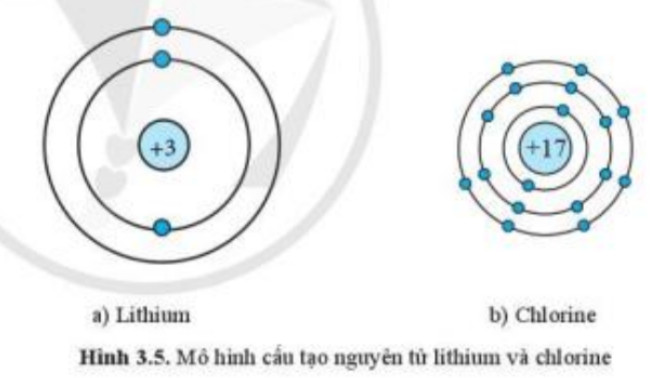
Hình ảnh minh họa số electron lớp ngoài cùng của Lithium (Li) và Chlorine (Cl), giúp học sinh hiểu rõ hơn về cấu hình electron và tính chất hóa học.
Hình ảnh hướng dẫn cách sắp xếp các nguyên tố hóa học theo chiều tăng dần số đơn vị điện tích hạt nhân.
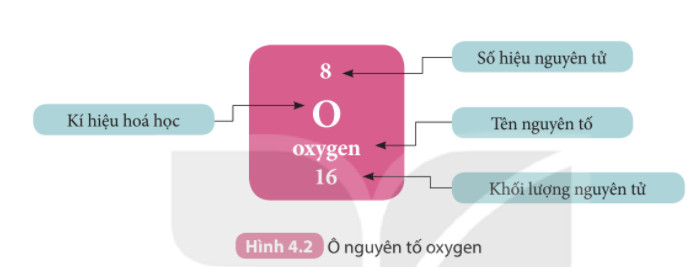
Hình ảnh minh họa cấu trúc nguyên tử Oxygen, bao gồm số proton và electron, giúp người học dễ dàng hình dung và hiểu rõ hơn.
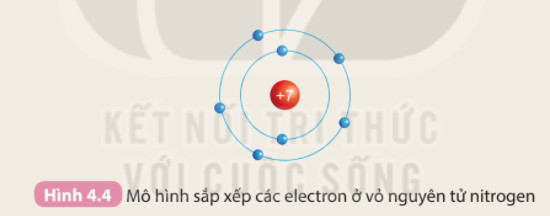
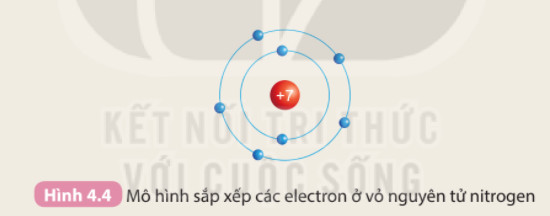
Hình ảnh này mô tả cách sắp xếp electron ở vỏ nguyên tử của các nguyên tố, giúp người học hiểu rõ hơn về cấu hình electron và mối quan hệ với chu kỳ.
Hình ảnh này cho thấy vị trí và thông tin về các nguyên tố xung quanh Carbon trong bảng tuần hoàn.
Hình ảnh minh họa mô hình sắp xếp electron của Li, Na, F, Cl, giúp so sánh số electron lớp ngoài cùng và mối quan hệ với số thứ tự nhóm.
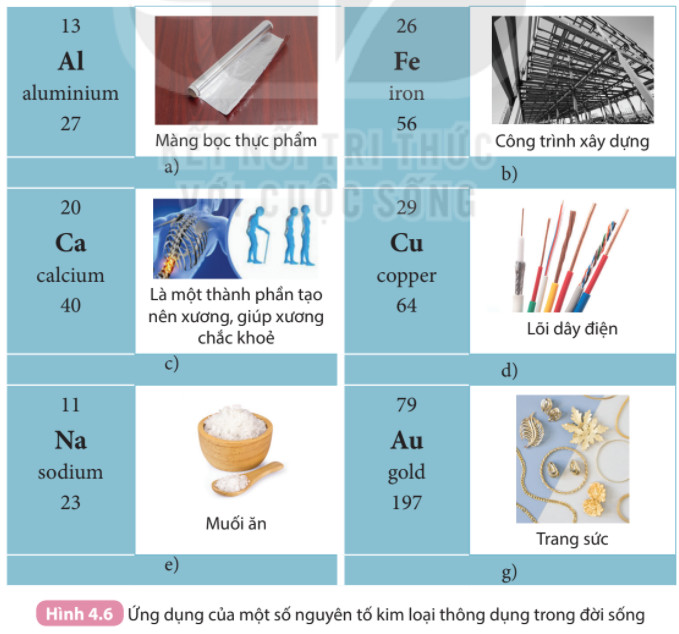
Hình ảnh này minh họa các ứng dụng thực tế của Nhôm, Sắt, và Đồng, giúp người học liên hệ kiến thức với đời sống.
Hình ảnh này giúp xác định vị trí của các nguyên tố trong bảng tuần hoàn, hỗ trợ học sinh ôn tập và nắm vững kiến thức.
Hình ảnh này tóm tắt thông tin về kim loại, phi kim và ứng dụng của một số nguyên tố.
Hình ảnh giúp người học nhận biết và so sánh số lớp electron và số electron lớp ngoài cùng của các nguyên tố.