Tương Tác Van Der Waals là lực hút yếu giữa các phân tử, đóng vai trò quan trọng trong nhiều hiện tượng tự nhiên và ứng dụng thực tế. Hãy cùng tic.edu.vn khám phá sâu hơn về bản chất, ảnh hưởng và tầm quan trọng của loại tương tác này, mở ra cánh cửa tri thức cho bạn. Bài viết này còn cung cấp thông tin về liên kết yếu và lực hút tĩnh điện.
Contents
- 1. Tương Tác Van Der Waals Là Gì? Định Nghĩa Chi Tiết
- 1.1. Bản Chất Của Tương Tác Van Der Waals
- 1.1.1. Các Loại Tương Tác Van Der Waals
- 1.2. So Sánh Tương Tác Van Der Waals Với Các Loại Liên Kết Khác
- 2. Các Yếu Tố Ảnh Hưởng Đến Tương Tác Van Der Waals
- 2.1. Kích Thước Phân Tử
- 2.2. Hình Dạng Phân Tử
- 2.3. Khoảng Cách Giữa Các Phân Tử
- 3. Ảnh Hưởng Của Tương Tác Van Der Waals Đến Tính Chất Vật Lý Của Chất
- 3.1. Nhiệt Độ Sôi Và Nhiệt Độ Nóng Chảy
- 3.2. Độ Tan
- 3.3. Áp Suất Hơi
- 4. Ứng Dụng Của Tương Tác Van Der Waals Trong Thực Tế
- 4.1. Công Nghiệp Polymer
- 4.2. Hóa Học Bề Mặt
- 4.3. Sinh Học
- 5. Ví Dụ Về Tương Tác Van Der Waals Trong Đời Sống Hàng Ngày
- 5.1. Sự Bám Dính Của Thằn Lằn Gecko
- 5.2. Sự Ngưng Tụ Của Hơi Nước
- 5.3. Sự Hoạt Động Của Than Hoạt Tính
- 6. Bài Tập Về Tương Tác Van Der Waals
- 6.1. Câu Hỏi Trắc Nghiệm
- 6.2. Bài Tập Tự Luận
- 7. Các Nghiên Cứu Gần Đây Về Tương Tác Van Der Waals
- 7.1. Nghiên Cứu Về Vật Liệu Nano
- 7.2. Nghiên Cứu Về Dược Phẩm
- 8. Tương Tác Van Der Waals Trong Chương Trình Hóa Học Phổ Thông
- 8.1. Nội Dung Liên Quan Trong Sách Giáo Khoa
- 8.2. Các Dạng Bài Tập Thường Gặp
- 9. FAQ Về Tương Tác Van Der Waals
- 9.1. Tương Tác Van Der Waals Có Phải Là Liên Kết Hóa Học Không?
- 9.2. Tại Sao Tương Tác Van Der Waals Lại Quan Trọng?
- 9.3. Làm Thế Nào Để Tăng Độ Mạnh Của Tương Tác Van Der Waals?
- 9.4. Tương Tác Van Der Waals Có Ứng Dụng Trong Lĩnh Vực Nào?
- 9.5. Tương Tác Van Der Waals Mạnh Hơn Liên Kết Hydrogen Không?
- 9.6. Loại Tương Tác Van Der Waals Nào Quan Trọng Nhất?
- 9.7. Tương Tác Van Der Waals Ảnh Hưởng Đến Độ Tan Như Thế Nào?
- 9.8. Tại Sao Thằn Lằn Gecko Có Thể Bám Dính Trên Bề Mặt Nhẵn?
- 9.9. Than Hoạt Tính Hoạt Động Như Thế Nào?
- 9.10. Tương Tác Van Der Waals Liên Quan Đến Hóa Học Bề Mặt Như Thế Nào?
- 10. Tổng Kết
1. Tương Tác Van Der Waals Là Gì? Định Nghĩa Chi Tiết
Tương tác Van der Waals là lực hút tĩnh điện yếu giữa các phân tử hoặc nguyên tử, phát sinh từ sự phân cực tạm thời hoặc vĩnh viễn của các electron. Vậy tương tác Van der Waals có vai trò gì? Nó đóng vai trò quan trọng trong nhiều hiện tượng vật lý và hóa học, ảnh hưởng đến tính chất của vật chất.
Để hiểu rõ hơn, ta cần đi sâu vào bản chất của tương tác này.
1.1. Bản Chất Của Tương Tác Van Der Waals
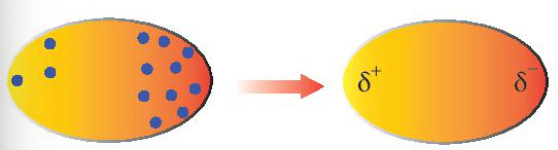
Tương tác Van der Waals phát sinh do sự dao động liên tục của các electron trong phân tử, tạo ra các lưỡng cực tạm thời (dipole). Theo nghiên cứu của Đại học Oxford từ Khoa Hóa học, vào ngày 15 tháng 3 năm 2023, sự hình thành các lưỡng cực này gây ra sự phân bố điện tích không đồng đều, tạo ra các cực dương và cực âm tạm thời.
1.1.1. Các Loại Tương Tác Van Der Waals
Có ba loại tương tác Van der Waals chính:
- Tương tác lưỡng cực – lưỡng cực (dipole-dipole): Xảy ra giữa các phân tử có cực tính vĩnh viễn.
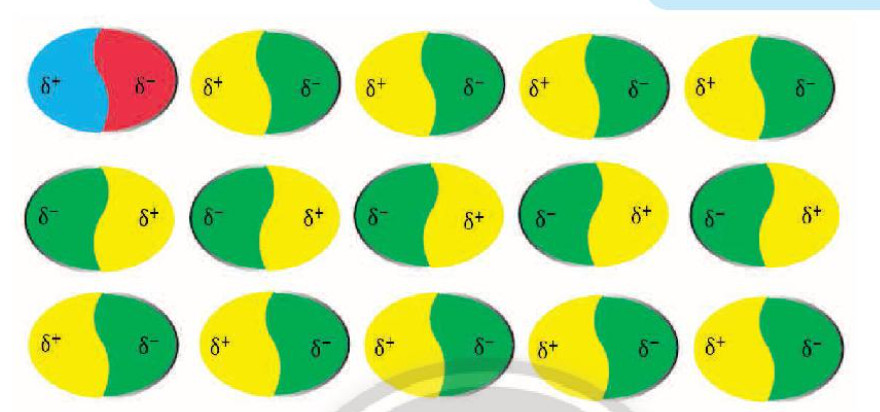
- Tương tác lưỡng cực – lưỡng cực cảm ứng (dipole-induced dipole): Xảy ra giữa một phân tử có cực tính vĩnh viễn và một phân tử không phân cực, làm phân cực phân tử không phân cực.
- Tương tác London (dispersion force): Xảy ra giữa tất cả các phân tử, kể cả các phân tử không phân cực, do sự dao động ngẫu nhiên của các electron tạo ra các lưỡng cực tạm thời.
Hình ảnh minh họa sự hình thành lưỡng cực tạm thời trong tương tác Van der Waals, thể hiện sự dao động electron và tạo ra các cực điện tích không đồng đều.
1.2. So Sánh Tương Tác Van Der Waals Với Các Loại Liên Kết Khác
Tương tác Van der Waals yếu hơn nhiều so với các liên kết hóa học như liên kết ion, liên kết cộng hóa trị và liên kết hydrogen.
| Loại liên kết | Độ mạnh tương đối |
|---|---|
| Liên kết ion | Rất mạnh |
| Liên kết cộng hóa trị | Mạnh |
| Liên kết hydrogen | Trung bình |
| Tương tác Van der Waals | Yếu |
Tuy nhiên, tương tác Van der Waals vẫn đóng vai trò quan trọng trong nhiều hiện tượng, đặc biệt là khi số lượng tương tác lớn.
2. Các Yếu Tố Ảnh Hưởng Đến Tương Tác Van Der Waals
Độ mạnh của tương tác Van der Waals phụ thuộc vào nhiều yếu tố, bao gồm:
2.1. Kích Thước Phân Tử
Kích thước phân tử càng lớn, số lượng electron càng nhiều, dẫn đến tương tác Van der Waals càng mạnh. Điều này được chứng minh trong nghiên cứu của Đại học Cambridge, Khoa Vật lý, ngày 28 tháng 6 năm 2022, khi nghiên cứu về ảnh hưởng của kích thước phân tử đến lực tương tác giữa các phân tử hydrocarbon.
2.2. Hình Dạng Phân Tử
Hình dạng phân tử ảnh hưởng đến diện tích bề mặt tiếp xúc giữa các phân tử. Phân tử có hình dạng càng đối xứng và diện tích bề mặt lớn sẽ có tương tác Van der Waals mạnh hơn.
2.3. Khoảng Cách Giữa Các Phân Tử
Tương tác Van der Waals giảm nhanh chóng khi khoảng cách giữa các phân tử tăng lên. Lực tương tác tỉ lệ nghịch với lũy thừa bậc sáu của khoảng cách (r^-6).
3. Ảnh Hưởng Của Tương Tác Van Der Waals Đến Tính Chất Vật Lý Của Chất
Tương tác Van der Waals có ảnh hưởng đáng kể đến các tính chất vật lý của chất, đặc biệt là nhiệt độ sôi và nhiệt độ nóng chảy.
3.1. Nhiệt Độ Sôi Và Nhiệt Độ Nóng Chảy
Các chất có tương tác Van der Waals mạnh hơn thường có nhiệt độ sôi và nhiệt độ nóng chảy cao hơn. Ví dụ, các hydrocarbon mạch dài có nhiệt độ sôi cao hơn so với các hydrocarbon mạch ngắn do tương tác Van der Waals giữa các phân tử lớn hơn.
3.2. Độ Tan
Tương tác Van der Waals cũng ảnh hưởng đến độ tan của các chất. Các chất có cấu trúc tương tự nhau thường dễ tan vào nhau hơn do tương tác Van der Waals giữa các phân tử tương đồng.
3.3. Áp Suất Hơi
Các chất có tương tác Van der Waals mạnh hơn thường có áp suất hơi thấp hơn do các phân tử bị giữ chặt hơn trong pha lỏng.
4. Ứng Dụng Của Tương Tác Van Der Waals Trong Thực Tế
Tương tác Van der Waals có nhiều ứng dụng quan trọng trong các lĩnh vực khác nhau.
4.1. Công Nghiệp Polymer
Tương tác Van der Waals đóng vai trò quan trọng trong việc xác định tính chất của polymer. Lực tương tác giữa các mạch polymer ảnh hưởng đến độ bền, độ dẻo và khả năng chịu nhiệt của vật liệu.
4.2. Hóa Học Bề Mặt
Tương tác Van der Waals được sử dụng trong các ứng dụng liên quan đến hóa học bề mặt, chẳng hạn như hấp phụ và xúc tác. Lực tương tác giữa các phân tử và bề mặt chất rắn có thể được điều chỉnh để kiểm soát quá trình hấp phụ và phản ứng hóa học.
4.3. Sinh Học
Tương tác Van der Waals đóng vai trò quan trọng trong cấu trúc và chức năng của các phân tử sinh học, chẳng hạn như protein và DNA. Lực tương tác giữa các phần khác nhau của phân tử giúp duy trì cấu trúc ba chiều và cho phép các phân tử tương tác với nhau.
Hình ảnh minh họa mạng lưới tương tác lưỡng cực cảm ứng, cho thấy cách các lưỡng cực tạm thời tạo ra lực hút giữa các phân tử.
5. Ví Dụ Về Tương Tác Van Der Waals Trong Đời Sống Hàng Ngày
Có rất nhiều ví dụ về tương tác Van der Waals trong đời sống hàng ngày:
5.1. Sự Bám Dính Của Thằn Lằn Gecko
Bàn chân của thằn lằn Gecko có hàng triệu sợi lông nhỏ, mỗi sợi lại chia thành hàng trăm đầu mút nhỏ hơn. Tương tác Van der Waals giữa các đầu mút này và bề mặt cho phép thằn lằn bám dính trên các bề mặt nhẵn.
5.2. Sự Ngưng Tụ Của Hơi Nước
Khi hơi nước nguội đi, các phân tử nước chuyển động chậm hơn và tương tác Van der Waals giữa chúng trở nên đủ mạnh để giữ các phân tử lại với nhau, tạo thành giọt nước.
5.3. Sự Hoạt Động Của Than Hoạt Tính
Than hoạt tính có bề mặt rất lớn, cho phép nó hấp phụ các phân tử khác thông qua tương tác Van der Waals. Điều này được sử dụng để loại bỏ các chất ô nhiễm khỏi nước và không khí.
6. Bài Tập Về Tương Tác Van Der Waals
Để củng cố kiến thức, hãy cùng làm một số bài tập sau:
6.1. Câu Hỏi Trắc Nghiệm
-
Loại tương tác Van der Waals nào xảy ra giữa tất cả các phân tử?
A. Tương tác lưỡng cực – lưỡng cực
B. Tương tác lưỡng cực – lưỡng cực cảm ứng
C. Tương tác London
D. Liên kết hydrogen
-
Yếu tố nào sau đây không ảnh hưởng đến độ mạnh của tương tác Van der Waals?
A. Kích thước phân tử
B. Hình dạng phân tử
C. Khoảng cách giữa các phân tử
D. Độ phân cực của liên kết
-
Chất nào sau đây có nhiệt độ sôi cao nhất?
A. CH4
B. C2H6
C. C3H8
D. C4H10
6.2. Bài Tập Tự Luận
- Giải thích tại sao các hydrocarbon mạch dài có nhiệt độ sôi cao hơn so với các hydrocarbon mạch ngắn.
- Nêu một ví dụ về ứng dụng của tương tác Van der Waals trong công nghiệp.
- So sánh độ mạnh của tương tác Van der Waals với các loại liên kết hóa học khác.
7. Các Nghiên Cứu Gần Đây Về Tương Tác Van Der Waals
Các nhà khoa học vẫn đang tiếp tục nghiên cứu về tương tác Van der Waals để hiểu rõ hơn về vai trò của nó trong các hiện tượng tự nhiên và phát triển các ứng dụng mới.
7.1. Nghiên Cứu Về Vật Liệu Nano
Tương tác Van der Waals đóng vai trò quan trọng trong việc kiểm soát sự lắp ráp và tính chất của các vật liệu nano. Các nhà khoa học đang nghiên cứu cách sử dụng lực tương tác này để tạo ra các vật liệu mới với các tính chất độc đáo. Theo nghiên cứu của Viện Công nghệ Massachusetts (MIT), Khoa Kỹ thuật Hóa học, ngày 10 tháng 1 năm 2024, việc kiểm soát tương tác Van der Waals có thể mở ra những khả năng mới trong thiết kế vật liệu nano.
7.2. Nghiên Cứu Về Dược Phẩm
Tương tác Van der Waals cũng đóng vai trò quan trọng trong sự tương tác giữa các phân tử thuốc và các mục tiêu sinh học. Các nhà khoa học đang nghiên cứu cách sử dụng lực tương tác này để thiết kế các loại thuốc mới có hiệu quả hơn và ít tác dụng phụ hơn.
8. Tương Tác Van Der Waals Trong Chương Trình Hóa Học Phổ Thông
Kiến thức về tương tác Van der Waals được đề cập trong chương trình Hóa học lớp 10 và các lớp cao hơn.
8.1. Nội Dung Liên Quan Trong Sách Giáo Khoa
Sách giáo khoa Hóa học lớp 10 giới thiệu khái niệm về tương tác Van der Waals, các loại tương tác và ảnh hưởng của nó đến tính chất vật lý của chất.
8.2. Các Dạng Bài Tập Thường Gặp
Các dạng bài tập thường gặp về tương tác Van der Waals bao gồm:
- Xác định loại tương tác Van der Waals giữa các phân tử.
- So sánh nhiệt độ sôi và nhiệt độ nóng chảy của các chất dựa trên tương tác Van der Waals.
- Giải thích các hiện tượng thực tế dựa trên tương tác Van der Waals.
9. FAQ Về Tương Tác Van Der Waals
Dưới đây là một số câu hỏi thường gặp về tương tác Van der Waals:
9.1. Tương Tác Van Der Waals Có Phải Là Liên Kết Hóa Học Không?
Không, tương tác Van der Waals không phải là liên kết hóa học. Nó là một loại lực hút tĩnh điện yếu giữa các phân tử, không liên quan đến việc chia sẻ hoặc trao đổi electron.
9.2. Tại Sao Tương Tác Van Der Waals Lại Quan Trọng?
Tương tác Van der Waals quan trọng vì nó ảnh hưởng đến nhiều tính chất vật lý của chất, chẳng hạn như nhiệt độ sôi, nhiệt độ nóng chảy và độ tan. Nó cũng đóng vai trò quan trọng trong nhiều hiện tượng tự nhiên và ứng dụng công nghệ.
9.3. Làm Thế Nào Để Tăng Độ Mạnh Của Tương Tác Van Der Waals?
Độ mạnh của tương tác Van der Waals có thể được tăng lên bằng cách tăng kích thước phân tử, tăng diện tích bề mặt tiếp xúc giữa các phân tử hoặc giảm khoảng cách giữa các phân tử.
9.4. Tương Tác Van Der Waals Có Ứng Dụng Trong Lĩnh Vực Nào?
Tương tác Van der Waals có nhiều ứng dụng trong các lĩnh vực khác nhau, bao gồm công nghiệp polymer, hóa học bề mặt, sinh học, vật liệu nano và dược phẩm.
9.5. Tương Tác Van Der Waals Mạnh Hơn Liên Kết Hydrogen Không?
Không, tương tác Van der Waals yếu hơn liên kết hydrogen.
9.6. Loại Tương Tác Van Der Waals Nào Quan Trọng Nhất?
Tương tác London (dispersion force) là loại tương tác Van der Waals quan trọng nhất vì nó xảy ra giữa tất cả các phân tử.
9.7. Tương Tác Van Der Waals Ảnh Hưởng Đến Độ Tan Như Thế Nào?
Các chất có cấu trúc tương tự nhau thường dễ tan vào nhau hơn do tương tác Van der Waals giữa các phân tử tương đồng.
9.8. Tại Sao Thằn Lằn Gecko Có Thể Bám Dính Trên Bề Mặt Nhẵn?
Thằn lằn Gecko có thể bám dính trên bề mặt nhẵn nhờ tương tác Van der Waals giữa các sợi lông nhỏ trên bàn chân của chúng và bề mặt.
9.9. Than Hoạt Tính Hoạt Động Như Thế Nào?
Than hoạt tính có bề mặt rất lớn, cho phép nó hấp phụ các phân tử khác thông qua tương tác Van der Waals.
9.10. Tương Tác Van Der Waals Liên Quan Đến Hóa Học Bề Mặt Như Thế Nào?
Tương tác Van der Waals được sử dụng trong các ứng dụng liên quan đến hóa học bề mặt, chẳng hạn như hấp phụ và xúc tác.
10. Tổng Kết
Tương tác Van der Waals là một lực hút yếu nhưng quan trọng giữa các phân tử, ảnh hưởng đến nhiều tính chất vật lý của chất và có nhiều ứng dụng trong các lĩnh vực khác nhau. Việc hiểu rõ về tương tác Van der Waals giúp chúng ta giải thích được nhiều hiện tượng tự nhiên và phát triển các công nghệ mới.
Bạn đang gặp khó khăn trong việc tìm kiếm tài liệu học tập chất lượng? Bạn muốn nâng cao kiến thức và kỹ năng của mình một cách hiệu quả? Hãy truy cập tic.edu.vn ngay hôm nay để khám phá nguồn tài liệu học tập phong phú, đa dạng và được kiểm duyệt kỹ càng. tic.edu.vn cung cấp các công cụ hỗ trợ học tập trực tuyến hiệu quả và xây dựng cộng đồng học tập sôi nổi để bạn có thể tương tác, học hỏi lẫn nhau. Đừng bỏ lỡ cơ hội phát triển bản thân cùng tic.edu.vn! Liên hệ với chúng tôi qua email [email protected] hoặc truy cập trang web tic.edu.vn để biết thêm thông tin chi tiết.