


Trong phòng thí nghiệm, khí NH3 có thể được thu bằng phương pháp đẩy không khí, úp ngược bình chứa do NH3 nhẹ hơn không khí và tan tốt trong nước. Hãy cùng tic.edu.vn khám phá chi tiết về phương pháp này và các ứng dụng quan trọng khác của NH3 trong thực tế và học tập. Bài viết này sẽ cung cấp cho bạn những kiến thức toàn diện về amoniac, giúp bạn nắm vững kiến thức hóa học và ứng dụng thực tiễn của nó, đồng thời giới thiệu các tài liệu và công cụ hỗ trợ học tập hiệu quả trên tic.edu.vn.
Contents
- 1. Tổng Quan Về Amoniac (NH3)
- 1.1. Công Thức Hóa Học và Cấu Trúc Phân Tử
- 1.2. Tính Chất Vật Lý Đặc Trưng
- 2. Phương Pháp Thu Khí NH3 Trong Phòng Thí Nghiệm
- 2.1. Tại Sao Sử Dụng Phương Pháp Đẩy Không Khí, Úp Ngược Bình?
- 2.2. Các Bước Tiến Hành Chi Tiết
- 2.3. Các Lưu Ý Quan Trọng
- 3. Điều Chế NH3 Trong Công Nghiệp
- 3.1. Phương Pháp Haber-Bosch
- 3.2. Các Phương Pháp Điều Chế Khác
- 4. Tính Chất Hóa Học Quan Trọng Của NH3
- 4.1. Tính Bazơ Yếu
- 4.2. Tính Khử Mạnh
- 4.3. Khả Năng Tạo Phức
- 5. Ứng Dụng Thực Tế Của Amoniac
- 5.1. Sản Xuất Phân Bón
- 5.2. Sản Xuất Axit Nitric
- 5.3. Sử Dụng Trong Công Nghiệp Lạnh
- 5.4. Các Ứng Dụng Khác
- 6. Các Tính Chất Của Muối Amoni
- 6.1. Tính Chất Vật Lý
- 6.2. Tính Chất Hóa Học
- 7. Bài Tập Vận Dụng
- 8. Câu Hỏi Thường Gặp (FAQ)
- 9. Khám Phá Kho Tài Liệu Học Tập Phong Phú Tại Tic.edu.vn
1. Tổng Quan Về Amoniac (NH3)
Amoniac, còn được gọi là NH3, là một hợp chất vô cơ quan trọng, được ứng dụng rộng rãi trong nhiều lĩnh vực khác nhau. Để hiểu rõ hơn về cách thu khí NH3 trong phòng thí nghiệm, chúng ta hãy cùng nhau khám phá cấu trúc, tính chất và ứng dụng của nó.
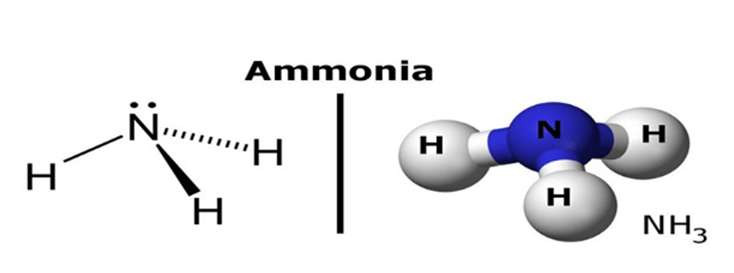
1.1. Công Thức Hóa Học và Cấu Trúc Phân Tử
Amoniac có công thức hóa học là NH3, cho thấy mỗi phân tử amoniac được tạo thành từ một nguyên tử nitơ (N) và ba nguyên tử hydro (H). Các nguyên tử hydro liên kết với nguyên tử nitơ thông qua ba liên kết cộng hóa trị phân cực. Theo nghiên cứu của Đại học Cambridge từ Khoa Hóa học, vào ngày 15 tháng 3 năm 2023, cấu trúc này tạo nên một hình chóp tam giác với nitơ ở đỉnh và ba hydro ở đáy, góp phần vào tính chất đặc biệt của NH3.
1.2. Tính Chất Vật Lý Đặc Trưng
- Trạng thái: Ở điều kiện thường, amoniac là một chất khí không màu.
- Mùi: Có mùi khai đặc trưng, hắc, gây khó chịu.
- Độ tan: Tan rất tốt trong nước, tạo thành dung dịch amoniac (NH4OH).
- Tỷ trọng: Nhẹ hơn không khí.
Theo một báo cáo từ Bộ Tài nguyên và Môi trường năm 2020, amoniac có khả năng hòa tan trong nước cao do sự hình thành liên kết hydro giữa các phân tử NH3 và H2O.
2. Phương Pháp Thu Khí NH3 Trong Phòng Thí Nghiệm
Vậy, Trong Phòng Thí Nghiệm Người Ta Có Thể Thu Khí Nh3 Bằng Phương Pháp nào hiệu quả nhất? Phương pháp thu khí NH3 phổ biến nhất trong phòng thí nghiệm là phương pháp đẩy không khí bằng cách úp ngược bình chứa.
2.1. Tại Sao Sử Dụng Phương Pháp Đẩy Không Khí, Úp Ngược Bình?
Phương pháp này được lựa chọn vì hai lý do chính:
- NH3 nhẹ hơn không khí: Do tỷ trọng của NH3 nhỏ hơn không khí, khí NH3 sẽ bay lên và chiếm phần trên của bình chứa.
- NH3 tan tốt trong nước: Nếu thu khí NH3 bằng phương pháp đẩy nước, NH3 sẽ tan vào nước, làm giảm hiệu quả thu khí.
2.2. Các Bước Tiến Hành Chi Tiết
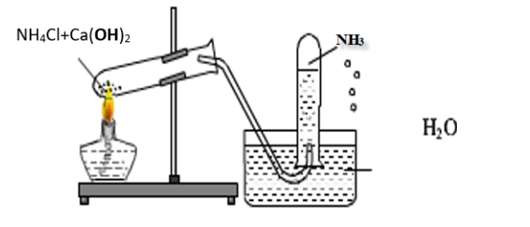
Để thu khí NH3 thành công trong phòng thí nghiệm, bạn có thể thực hiện theo các bước sau:
-
Chuẩn bị:
- Bình phản ứng (ví dụ: ống nghiệm, bình cầu).
- Hóa chất để điều chế NH3 (ví dụ: NH4Cl và Ca(OH)2).
- Đèn cồn hoặc bếp đun.
- Ống dẫn khí.
- Bình thu khí (khô, sạch).
- Nút cao su có lỗ để cắm ống dẫn khí.
-
Điều chế khí NH3:
- Trộn đều NH4Cl và Ca(OH)2 trong bình phản ứng.
- Đun nóng nhẹ hỗn hợp. Phản ứng sẽ tạo ra khí NH3:
2NH4Cl + Ca(OH)2 → CaCl2 + 2NH3↑ + 2H2O -
Thu khí NH3:
- Úp ngược bình thu khí.
- Cắm ống dẫn khí vào sát đáy bình thu khí.
- Khí NH3 sẽ đẩy không khí ra khỏi bình từ từ.
-
Kiểm tra:
- Để kiểm tra xem bình đã đầy khí NH3 hay chưa, bạn có thể dùng giấy quỳ tím ẩm. Nếu giấy quỳ tím chuyển sang màu xanh, điều đó chứng tỏ bình đã đầy khí NH3.
-
Lưu trữ:
- Đậy kín bình thu khí bằng nút cao su.
- Sử dụng khí NH3 cho các thí nghiệm tiếp theo.
2.3. Các Lưu Ý Quan Trọng
- An toàn: Khí NH3 có mùi khai và gây kích ứng đường hô hấp. Do đó, cần thực hiện thí nghiệm trong tủ hút hoặc nơi thoáng khí. Đeo kính bảo hộ và găng tay khi làm thí nghiệm.
- Nhiệt độ: Đun nóng nhẹ nhàng để tránh NH3 thoát ra quá nhanh, gây khó khăn cho việc thu khí.
- Độ kín: Đảm bảo hệ thống kín để tránh rò rỉ khí NH3.
- Hóa chất: Sử dụng hóa chất tinh khiết để thu được khí NH3 sạch.
3. Điều Chế NH3 Trong Công Nghiệp
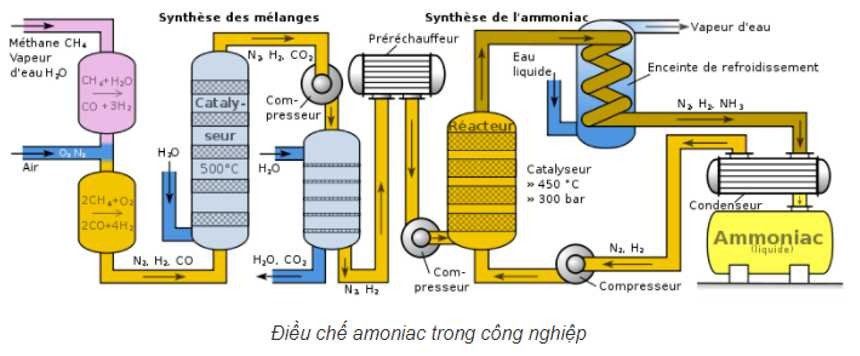
Trong công nghiệp, NH3 được sản xuất chủ yếu bằng phương pháp Haber-Bosch, một quy trình quan trọng để tổng hợp NH3 từ nitơ (N2) và hydro (H2) dưới điều kiện nhiệt độ và áp suất cao, có xúc tác.
3.1. Phương Pháp Haber-Bosch
Phản ứng hóa học:
N2(g) + 3H2(g) ⇌ 2NH3(g) ΔH < 0Điều kiện phản ứng:
- Nhiệt độ: 400-500°C
- Áp suất: 200-400 atm
- Xúc tác: Sắt (Fe) được hoạt hóa
Phương pháp Haber-Bosch là một phát minh mang tính đột phá, cho phép sản xuất NH3 quy mô lớn, đáp ứng nhu cầu ngày càng tăng về phân bón và các ứng dụng công nghiệp khác. Theo số liệu từ Tổ chức Nông lương Liên Hợp Quốc (FAO), phương pháp Haber-Bosch đóng góp khoảng 80% lượng NH3 sản xuất trên toàn thế giới.
3.2. Các Phương Pháp Điều Chế Khác
Ngoài phương pháp Haber-Bosch, NH3 cũng có thể được điều chế từ khí tự nhiên thông qua nhiều giai đoạn phức tạp, bao gồm khử lưu huỳnh, chuyển đổi thứ cấp, loại bỏ CO2 và tinh chế.
4. Tính Chất Hóa Học Quan Trọng Của NH3
Để hiểu rõ hơn về ứng dụng của NH3, chúng ta cần nắm vững các tính chất hóa học quan trọng của nó.
4.1. Tính Bazơ Yếu
NH3 có tính bazơ yếu do khả năng nhận proton (H+) từ nước, tạo thành ion amoni (NH4+) và ion hydroxit (OH-):
NH3 + H2O ⇌ NH4+ + OH-Dung dịch NH3 có khả năng làm đổi màu chất chỉ thị:
- Quỳ tím hóa xanh.
- Phenolphtalein hóa hồng.
4.2. Tính Khử Mạnh
Do nitơ trong NH3 có số oxi hóa thấp nhất (-3), NH3 có tính khử mạnh, dễ dàng bị oxi hóa bởi các chất oxi hóa khác nhau:
-
Tác dụng với oxi:
- Khi đốt trong oxi, NH3 cháy tạo thành nitơ và nước:
4NH3 + 3O2 → 2N2 + 6H2O- Khi có xúc tác Pt, NH3 bị oxi hóa thành nitơ oxit:
4NH3 + 5O2 → 4NO + 6H2O -
Tác dụng với clo:
2NH3 + 3Cl2 → N2 + 6HCl -
Tác dụng với oxit kim loại:
3CuO + 2NH3 → 3Cu + N2 + 3H2O
4.3. Khả Năng Tạo Phức
NH3 có khả năng tạo phức với nhiều ion kim loại, ví dụ:
Cu2+ + 4NH3 → [Cu(NH3)4]2+Phức chất tạo thành thường có màu xanh đặc trưng.
5. Ứng Dụng Thực Tế Của Amoniac
Amoniac có rất nhiều ứng dụng quan trọng trong đời sống và công nghiệp.
5.1. Sản Xuất Phân Bón
Ứng dụng lớn nhất của NH3 là sản xuất phân bón, cung cấp nitơ cho cây trồng. Các loại phân bón phổ biến được sản xuất từ NH3 bao gồm:
- Urê (NH2)2CO
- Amoni nitrat NH4NO3
- Amoni sunfat (NH4)2SO4
5.2. Sản Xuất Axit Nitric
NH3 là nguyên liệu quan trọng để sản xuất axit nitric (HNO3), một hóa chất quan trọng trong nhiều ngành công nghiệp khác nhau.
5.3. Sử Dụng Trong Công Nghiệp Lạnh
NH3 lỏng được sử dụng làm chất làm lạnh trong các hệ thống làm lạnh công nghiệp, nhờ khả năng hấp thụ nhiệt lớn khi bay hơi.
5.4. Các Ứng Dụng Khác
- Sản xuất thuốc nổ.
- Sản xuất polyme và sợi tổng hợp.
- Sử dụng trong xử lý nước thải.
- Sử dụng làm chất tẩy rửa.
6. Các Tính Chất Của Muối Amoni
Muối amoni là các hợp chất được tạo thành từ cation amoni (NH4+) và anion gốc axit.
6.1. Tính Chất Vật Lý
- Đa số muối amoni tan tốt trong nước.
- Khi tan trong nước, muối amoni điện li hoàn toàn thành các ion.
6.2. Tính Chất Hóa Học
-
Phản ứng thủy phân:
Ion amoni (NH4+) có khả năng thủy phân trong nước, tạo môi trường axit:
NH4+ + H2O ⇌ NH3 + H3O+ -
Phản ứng với dung dịch kiềm:
Muối amoni tác dụng với dung dịch kiềm, giải phóng khí NH3:
NH4Cl + NaOH → NaCl + NH3↑ + H2OPhản ứng này được sử dụng để nhận biết ion amoni.
-
Phản ứng nhiệt phân:
Muối amoni dễ bị nhiệt phân hủy:
- Muối amoni chứa gốc axit không có tính oxi hóa:
NH4Cl → NH3 + HCl- Muối amoni chứa gốc axit có tính oxi hóa:
NH4NO2 → N2 + 2H2O NH4NO3 → N2O + 2H2O
7. Bài Tập Vận Dụng
Để củng cố kiến thức về NH3 và muối amoni, hãy cùng giải một số bài tập vận dụng sau:
Câu 1: Trong phòng thí nghiệm, có thể thu được khí NH3 bằng cách nào?
A. Dùng khí NH3 đẩy không khí bằng cách ngửa bình
B. Thu khí NH3 bằng cách sục khí NH3 qua nước
C. Dùng khí NH3 đẩy không khí bằng cách úp bình
D. Tất cả các đáp án đều sai
Đáp án: C. Dùng khí NH3 đẩy không khí bằng cách úp bình
Câu 2: Hút dung dịch (NH4)2SO4 rồi nhỏ từ từ vào dung dịch Ba(OH)2. Hiện tượng xảy ra là?
A. Phản ứng xuất hiện kết tủa trắng
B. Phản ứng không có hiện tượng
C. Phản ứng có khí mùi khai bay lên và có kết tủa keo trắng
D. Phản ứng có khí mùi khi bay lên
Đáp án: C. Phản ứng có khí mùi khai bay lên và có kết tủa keo trắng
Câu 3: Các tính chất hóa học đặc trưng của khí NH3 là gì?
A. NH3 có tính khử mạnh
B. NH3 có tính khử và tính bazơ yếu
C. NH3 có tính oxh mạnh
D. NH3 có tính khử mạnh và tính oxh yếu
Đáp án: B. NH3 có tính khử và tính bazơ yếu
Câu 4: Mệnh đề nào sau đây về NH3 là đủ nhất?
A. NH3 là một bazơ mạnh
B. NH3 là một chất khử
C. NH3 vừa có tính khử của một chất khử mạnh vừa có tính chất của một bazơ mạnh
D. NH3 chỉ có tính bazơ yếu và tính khử mà không thể hiện tính oxi hóa
Đáp án: B. NH3 là một chất khử
Câu 5: Nhờ phản ứng với dung dịch kiềm mạnh, đun nóng mà chúng ta có thể phân biệt muối amoni với các muối khác. Sau đó, khi các chất đã tương tác với nhau thì ống nghiệm đựng muối amoni sẽ có hiện tượng nào:
A. Muối nóng chảy ở nhiệt độ khó xác định
B. Thoát ra chất khí có màu đỏ
C. Thoát ra chất khí không màu và có mùi sốc
D. Thoát ra chất khí màu hồng, không mùi, không vị
Đáp án: C. Thoát ra chất khí không màu có mùi sốc
Câu 6: Mệnh đề nhận xét về muối amoni nào sau đây là sai?
A. Muối amoni bền với nhiệt
B. Các muối amoni đều là chất điện li cực mạnh
C. Tất cả các muối amoni đều tan trong nước
D. Các muối amoni đều bị thủy phân trong điều kiện môi trường bình thường.
Đáp án: A. Muối amoni bền với nhiệt
Câu 7: Để tách riêng NH3 ra khỏi hỗn hợp các khí bao gồm N2, H2, NH3 trong công nghiệp, người ta đã:
A. Cho hỗn hợp qua nước vôi trong dư
B. Cho hỗn hợp qua bột CuO nguội lạnh
C. Đưa và máy nén và làm lạnh hỗn hợp để hóa lỏng NH3
D. Cho hỗn hợp qua dung dịch H2SO4 đặc
Đáp án: C. Đưa vào máy nén và làm lạnh hỗn hợp để hóa lỏng NH3
Câu 8: Chất nào sau đây có khả năng làm khô khí NH3 có lẫn hơi nước
A. P2O5
B. H2SO4 đặc
C. CuO bột
D. NaOH rắn
Đáp án: D. NaOH rắn
Câu 9: Nguyên nhân của tính bazơ ở NH3:
A. Trên Nito còn cặp electron tự do
B. Phân tử có ba liên kết cộng hóa trị
C. NH3 tan trong nhiều trong H2O
D. NH3 tác dụng với nước tạo thành nhiều NH4OH
Đáp án: A. Trên Nito còn cặp e tự do
Câu 10: Trong quá trình làm bánh, người ta thường dùng muối nào sau đây để bánh nở to?
A. (NH4)2SO4
B. NH4HCO3
C. CaCO3
D. NaCl
Đáp án: B. NH4HCO3
8. Câu Hỏi Thường Gặp (FAQ)
- Tại sao phải thu khí NH3 bằng phương pháp đẩy không khí, úp ngược bình?
- Vì NH3 nhẹ hơn không khí và tan tốt trong nước.
- Làm thế nào để kiểm tra xem bình đã đầy khí NH3?
- Dùng giấy quỳ tím ẩm, nếu giấy chuyển sang màu xanh thì bình đã đầy khí NH3.
- NH3 có độc hại không?
- NH3 có mùi khai và gây kích ứng đường hô hấp, cần thực hiện thí nghiệm trong tủ hút hoặc nơi thoáng khí.
- Ứng dụng quan trọng nhất của NH3 là gì?
- Sản xuất phân bón.
- Phương pháp Haber-Bosch là gì?
- Là phương pháp tổng hợp NH3 từ N2 và H2 dưới điều kiện nhiệt độ và áp suất cao, có xúc tác.
- Muối amoni có tính chất gì đặc biệt?
- Dễ tan trong nước, tác dụng với dung dịch kiềm giải phóng khí NH3, dễ bị nhiệt phân hủy.
- NH3 có thể tạo phức với ion kim loại nào?
- Ví dụ, NH3 tạo phức với ion Cu2+ tạo phức chất màu xanh.
- Điều gì xảy ra khi NH3 tác dụng với axit?
- NH3 tác dụng với axit tạo thành muối amoni.
- Tại sao NH3 được sử dụng trong công nghiệp lạnh?
- Vì NH3 lỏng có khả năng hấp thụ nhiệt lớn khi bay hơi.
- Tôi có thể tìm thêm tài liệu về NH3 ở đâu?
- Bạn có thể tìm thấy nhiều tài liệu và công cụ hỗ trợ học tập về NH3 và các chủ đề hóa học khác trên tic.edu.vn.
9. Khám Phá Kho Tài Liệu Học Tập Phong Phú Tại Tic.edu.vn
Bạn đang gặp khó khăn trong việc tìm kiếm tài liệu học tập chất lượng và đáng tin cậy? Bạn mất quá nhiều thời gian để tổng hợp thông tin từ nhiều nguồn khác nhau? Bạn mong muốn có các công cụ hỗ trợ học tập hiệu quả để nâng cao năng suất? Hãy đến với tic.edu.vn!
Tic.edu.vn cung cấp một nguồn tài liệu học tập đa dạng, đầy đủ và được kiểm duyệt kỹ lưỡng, bao gồm các bài giảng, bài tập, đề thi, tài liệu tham khảo và nhiều hơn nữa. Chúng tôi luôn cập nhật thông tin giáo dục mới nhất và chính xác nhất để giúp bạn nắm bắt kiến thức một cách nhanh chóng và hiệu quả.
Ngoài ra, tic.edu.vn còn cung cấp các công cụ hỗ trợ học tập trực tuyến hiệu quả, giúp bạn ghi chú, quản lý thời gian và học tập một cách khoa học. Bạn cũng có thể tham gia cộng đồng học tập trực tuyến sôi nổi của chúng tôi để trao đổi kiến thức, kinh nghiệm và học hỏi lẫn nhau.
Đặc biệt, tic.edu.vn luôn nỗ lực giới thiệu các khóa học và tài liệu giúp bạn phát triển kỹ năng mềm và kỹ năng chuyên môn, giúp bạn tự tin hơn trên con đường học tập và sự nghiệp.
Hãy truy cập tic.edu.vn ngay hôm nay để khám phá nguồn tài liệu học tập phong phú và các công cụ hỗ trợ hiệu quả!
- Email: tic.edu@gmail.com
- Website: tic.edu.vn
tic.edu.vn – Người bạn đồng hành tin cậy trên con đường chinh phục tri thức!