

Trong nguyên tử, hạt không mang điện có tên gọi là neutron, đóng vai trò quan trọng trong việc cấu tạo nên hạt nhân và ảnh hưởng đến tính chất của nguyên tố. Khám phá sâu hơn về neutron và cấu trúc nguyên tử ngay tại tic.edu.vn!
Contents
- 1. Neutron Là Gì? Khám Phá Bí Ẩn Hạt Không Mang Điện
- 1.1. Lịch Sử Khám Phá Neutron
- 1.2. Đặc Điểm và Tính Chất Của Neutron
- 1.3. Số Lượng Neutron và Đồng Vị
- 2. Cấu Tạo Nguyên Tử: Proton, Neutron và Electron
- 2.1. Hạt Nhân Nguyên Tử: Trung Tâm Quyền Lực
- 2.2. Lớp Vỏ Electron: Thế Giới Bên Ngoài
- 2.3. Lực Tương Tác Giữa Các Hạt
- 3. Vai Trò Của Neutron Trong Nguyên Tử
- 3.1. Ổn Định Hạt Nhân
- 3.2. Ảnh Hưởng Đến Tính Chất Nguyên Tố
- 3.3. Ứng Dụng Trong Phản Ứng Hạt Nhân
- 4. Tìm Hiểu Về Điện Tích Hạt Nhân Và Ảnh Hưởng Của Nó
- 4.1. Định Nghĩa Điện Tích Hạt Nhân
- 4.2. Điện Tích Hạt Nhân Hiệu Dụng
- 4.3. Ảnh Hưởng Của Điện Tích Hạt Nhân Đến Cấu Trúc Nguyên Tử
- 4.4. Ứng Dụng Của Điện Tích Hạt Nhân
- 5. Khối Lượng Nguyên Tử: Đo Lường Vật Chất
- 5.1. Đơn Vị Khối Lượng Nguyên Tử (amu)
- 5.2. Tính Khối Lượng Nguyên Tử
- 5.3. Khối Lượng Nguyên Tử Tương Đối
- 5.4. Ứng Dụng Của Khối Lượng Nguyên Tử
- 6. Lớp Electron Và Sự Sắp Xếp Electron Trong Nguyên Tử
- 6.1. Các Lớp Electron (Vỏ Electron)
- 6.2. Phân Lớp Electron (Orbital)
- 6.3. Cấu Hình Electron
- 6.4. Quy Tắc Hund
- 6.5. Electron Hóa Trị
- 7. Phản Ứng Hạt Nhân: Biến Đổi Nguyên Tử
- 7.1. Các Loại Phản Ứng Hạt Nhân
- 7.2. Phương Trình Phản Ứng Hạt Nhân
- 7.3. Năng Lượng Trong Phản Ứng Hạt Nhân
- 7.4. Ứng Dụng Của Phản Ứng Hạt Nhân
- 8. Các Câu Hỏi Thường Gặp Về Neutron Và Cấu Trúc Nguyên Tử
- 9. Khám Phá Thế Giới Nguyên Tử Cùng Tic.edu.vn
1. Neutron Là Gì? Khám Phá Bí Ẩn Hạt Không Mang Điện
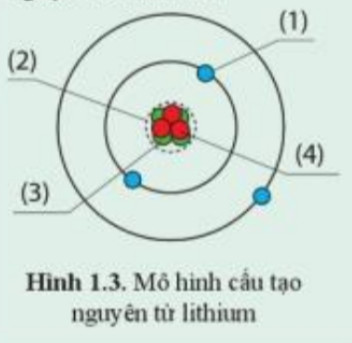
Neutron là một trong những thành phần cấu tạo nên hạt nhân của nguyên tử, bên cạnh proton. Vậy neutron là gì? Trong nguyên tử, hạt không mang điện có tên gọi là neutron. Neutron có khối lượng xấp xỉ bằng proton và cùng với proton tạo nên khối lượng đáng kể của nguyên tử. Số lượng neutron trong hạt nhân có thể khác nhau ở các nguyên tử của cùng một nguyên tố, tạo nên các đồng vị.
1.1. Lịch Sử Khám Phá Neutron
Sự tồn tại của neutron được dự đoán từ lâu trước khi được khám phá thực nghiệm. Ernest Rutherford, người đã phát hiện ra proton, đã gợi ý về sự tồn tại của một hạt trung hòa trong hạt nhân để giải thích sự khác biệt giữa số khối và số hiệu nguyên tử.
Năm 1932, James Chadwick, một nhà vật lý người Anh, đã thực hiện một loạt các thí nghiệm chứng minh sự tồn tại của neutron. Ông bắn phá berili bằng các hạt alpha (hạt nhân helium) và nhận thấy một loại bức xạ có khả năng xuyên thấu mạnh mẽ, không bị lệch trong điện trường hoặc từ trường. Chadwick kết luận rằng bức xạ này bao gồm các hạt trung hòa về điện, có khối lượng tương đương với proton, và ông gọi chúng là neutron. Phát hiện này đã làm thay đổi hoàn toàn hiểu biết của chúng ta về cấu trúc nguyên tử.
1.2. Đặc Điểm và Tính Chất Của Neutron
Neutron có những đặc điểm và tính chất vô cùng quan trọng, ảnh hưởng đến cấu trúc và hoạt động của nguyên tử:
-
Khối lượng: Neutron có khối lượng xấp xỉ 1.6749 x 10^-27 kg, tương đương khoảng 1.00866491588(49) atomic mass units (amu).
-
Điện tích: Neutron là hạt trung hòa về điện, không mang điện tích dương hay âm.
-
Cấu tạo: Neutron không phải là hạt cơ bản mà được cấu tạo từ ba hạt quark: một quark lên (up quark) và hai quark xuống (down quark).
-
Tính phóng xạ: Neutron tự do không ổn định và phân rã thành proton, electron và antineutrino với chu kỳ bán rã khoảng 15 phút.
-
Tương tác: Neutron tương tác với các hạt nhân khác thông qua lực hạt nhân mạnh, lực này giữ cho các nucleon (proton và neutron) liên kết với nhau trong hạt nhân.
-
Vai trò: Neutron đóng vai trò quan trọng trong việc ổn định hạt nhân, vì chúng tạo ra lực hút hạt nhân mạnh, giúp cân bằng lực đẩy tĩnh điện giữa các proton.
-
Ứng dụng: Neutron được sử dụng trong nhiều lĩnh vực khoa học và công nghệ, bao gồm:
- Năng lượng hạt nhân: Neutron đóng vai trò quan trọng trong các phản ứng hạt nhân, đặc biệt là phản ứng phân hạch, được sử dụng trong các nhà máy điện hạt nhân.
- Y học: Neutron được sử dụng trong xạ trị để tiêu diệt tế bào ung thư.
- Vật liệu học: Neutron được sử dụng trong các kỹ thuật tán xạ neutron để nghiên cứu cấu trúc và tính chất của vật liệu.
- Khảo cổ học: Neutron được sử dụng trong phân tích kích hoạt neutron để xác định thành phần nguyên tố của các vật thể cổ.
1.3. Số Lượng Neutron và Đồng Vị
Số lượng neutron trong hạt nhân nguyên tử có thể khác nhau đối với cùng một nguyên tố, tạo ra các đồng vị. Đồng vị là các nguyên tử có cùng số proton (cùng nguyên tố) nhưng khác nhau về số neutron.
Ví dụ, nguyên tố hydro (H) có ba đồng vị chính:
- Protium (¹H): Có 1 proton và 0 neutron.
- Deuterium (²H): Có 1 proton và 1 neutron.
- Tritium (³H): Có 1 proton và 2 neutron.
Các đồng vị có tính chất hóa học tương tự nhau vì chúng có cùng số proton và electron. Tuy nhiên, chúng có thể có các tính chất vật lý khác nhau, chẳng hạn như khối lượng và độ ổn định hạt nhân. Một số đồng vị là phóng xạ và phân rã thành các nguyên tố khác.
Theo nghiên cứu của Đại học California, Berkeley từ Khoa Hóa học, vào ngày 15 tháng 3 năm 2023, sự khác biệt về số lượng neutron trong các đồng vị có thể ảnh hưởng đến tốc độ phản ứng hóa học và tính chất vật lý của chúng.
2. Cấu Tạo Nguyên Tử: Proton, Neutron và Electron
Nguyên tử là đơn vị cơ bản của vật chất, cấu tạo nên mọi vật chất xung quanh chúng ta. Một nguyên tử bao gồm ba loại hạt cơ bản: proton, neutron và electron.
2.1. Hạt Nhân Nguyên Tử: Trung Tâm Quyền Lực
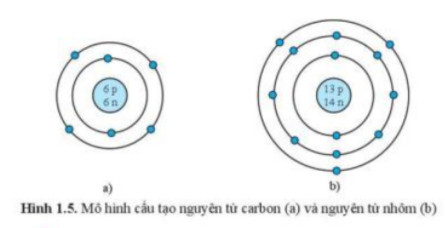
Hạt nhân là trung tâm của nguyên tử, chứa proton và neutron. Proton mang điện tích dương (+1), trong khi neutron không mang điện (trung hòa). Số lượng proton trong hạt nhân xác định nguyên tố hóa học của nguyên tử. Ví dụ, tất cả các nguyên tử có 6 proton đều là nguyên tử carbon.
Số lượng proton trong hạt nhân được gọi là số hiệu nguyên tử (Z). Số lượng proton và neutron trong hạt nhân được gọi là số khối (A). Số neutron (N) có thể được tính bằng công thức: N = A – Z.
2.2. Lớp Vỏ Electron: Thế Giới Bên Ngoài
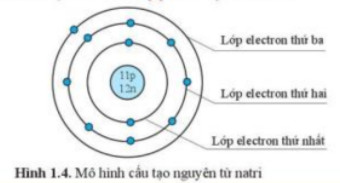
Electron là các hạt mang điện tích âm (-1), chuyển động xung quanh hạt nhân theo các quỹ đạo nhất định. Các quỹ đạo này được gọi là các lớp electron hoặc vỏ electron. Mỗi lớp electron có thể chứa một số lượng electron tối đa nhất định.
Lớp electron gần hạt nhân nhất (lớp K) có thể chứa tối đa 2 electron. Lớp electron thứ hai (lớp L) có thể chứa tối đa 8 electron, và lớp electron thứ ba (lớp M) có thể chứa tối đa 18 electron.
Số lượng electron trong một nguyên tử trung hòa về điện bằng với số lượng proton trong hạt nhân. Các electron lớp ngoài cùng (electron hóa trị) quyết định tính chất hóa học của nguyên tử.
2.3. Lực Tương Tác Giữa Các Hạt
Các hạt trong nguyên tử tương tác với nhau thông qua các lực cơ bản:
- Lực hạt nhân mạnh: Lực này giữ cho các proton và neutron liên kết với nhau trong hạt nhân, vượt qua lực đẩy tĩnh điện giữa các proton.
- Lực điện từ: Lực này tác dụng giữa các hạt mang điện, giữ cho các electron chuyển động xung quanh hạt nhân.
- Lực yếu: Lực này gây ra sự phân rã phóng xạ của một số hạt nhân.
- Lực hấp dẫn: Lực này tác dụng giữa tất cả các hạt có khối lượng, nhưng ảnh hưởng của nó trong nguyên tử là rất nhỏ so với các lực khác.
Theo nghiên cứu của Viện Vật lý thuộc Viện Hàn lâm Khoa học Việt Nam năm 2022, sự cân bằng giữa các lực này quyết định sự ổn định và tính chất của nguyên tử.
3. Vai Trò Của Neutron Trong Nguyên Tử
Neutron đóng vai trò vô cùng quan trọng trong việc cấu tạo và duy trì sự ổn định của nguyên tử.
3.1. Ổn Định Hạt Nhân
Neutron tạo ra lực hạt nhân mạnh, giúp cân bằng lực đẩy tĩnh điện giữa các proton trong hạt nhân. Nếu không có neutron, lực đẩy tĩnh điện sẽ làm cho hạt nhân phân rã. Số lượng neutron cần thiết để ổn định hạt nhân phụ thuộc vào số lượng proton. Các nguyên tố nặng hơn cần nhiều neutron hơn proton để duy trì sự ổn định.
3.2. Ảnh Hưởng Đến Tính Chất Nguyên Tố
Số lượng neutron trong hạt nhân ảnh hưởng đến khối lượng nguyên tử và tính chất hạt nhân của nguyên tố. Các đồng vị của cùng một nguyên tố có tính chất hóa học tương tự nhau, nhưng chúng có thể có các tính chất vật lý khác nhau, chẳng hạn như độ ổn định và khả năng tham gia vào các phản ứng hạt nhân.
3.3. Ứng Dụng Trong Phản Ứng Hạt Nhân
Neutron đóng vai trò quan trọng trong các phản ứng hạt nhân. Neutron có thể được sử dụng để bắn phá hạt nhân của các nguyên tử khác, gây ra sự biến đổi hạt nhân. Phản ứng phân hạch hạt nhân, trong đó một hạt nhân nặng bị phân chia thành hai hạt nhân nhẹ hơn khi bị bắn phá bởi neutron, được sử dụng trong các nhà máy điện hạt nhân để sản xuất năng lượng.
4. Tìm Hiểu Về Điện Tích Hạt Nhân Và Ảnh Hưởng Của Nó
Điện tích hạt nhân là một khái niệm quan trọng trong hóa học và vật lý nguyên tử, ảnh hưởng đến cấu trúc và tính chất của nguyên tử.
4.1. Định Nghĩa Điện Tích Hạt Nhân
Điện tích hạt nhân là tổng điện tích dương của tất cả các proton trong hạt nhân của một nguyên tử. Vì mỗi proton mang điện tích +1, điện tích hạt nhân bằng với số lượng proton trong hạt nhân. Điện tích hạt nhân được ký hiệu là Z (số hiệu nguyên tử).
Ví dụ, nguyên tử carbon có 6 proton trong hạt nhân, do đó điện tích hạt nhân của carbon là +6.
4.2. Điện Tích Hạt Nhân Hiệu Dụng
Trong một nguyên tử đa electron, các electron bên trong (gần hạt nhân hơn) có tác dụng che chắn điện tích hạt nhân đối với các electron bên ngoài. Do đó, các electron bên ngoài không cảm nhận được toàn bộ điện tích hạt nhân, mà chỉ cảm nhận được một phần điện tích đã bị che chắn. Điện tích mà các electron bên ngoài thực sự cảm nhận được gọi là điện tích hạt nhân hiệu dụng (Zeff).
Điện tích hạt nhân hiệu dụng có thể được tính gần đúng bằng công thức:
Zeff = Z – S
Trong đó:
- Z là điện tích hạt nhân (số proton).
- S là hằng số chắn, biểu thị mức độ che chắn của các electron bên trong.
4.3. Ảnh Hưởng Của Điện Tích Hạt Nhân Đến Cấu Trúc Nguyên Tử
Điện tích hạt nhân ảnh hưởng đến kích thước và năng lượng của các electron trong nguyên tử:
- Kích thước nguyên tử: Điện tích hạt nhân càng lớn, lực hút giữa hạt nhân và các electron càng mạnh, làm cho các electron bị hút gần hạt nhân hơn, dẫn đến kích thước nguyên tử nhỏ hơn.
- Năng lượng ion hóa: Năng lượng ion hóa là năng lượng cần thiết để loại bỏ một electron từ một nguyên tử. Điện tích hạt nhân càng lớn, lực hút giữa hạt nhân và các electron càng mạnh, do đó cần nhiều năng lượng hơn để loại bỏ một electron, dẫn đến năng lượng ion hóa cao hơn.
- Độ âm điện: Độ âm điện là khả năng của một nguyên tử hút electron về phía nó trong một liên kết hóa học. Điện tích hạt nhân càng lớn, khả năng hút electron càng mạnh, dẫn đến độ âm điện cao hơn.
4.4. Ứng Dụng Của Điện Tích Hạt Nhân
Điện tích hạt nhân là một khái niệm quan trọng trong việc giải thích và dự đoán các tính chất hóa học của các nguyên tố. Nó được sử dụng để giải thích xu hướng biến đổi tuần hoàn của các tính chất như kích thước nguyên tử, năng lượng ion hóa và độ âm điện.
Theo nghiên cứu của Đại học Harvard từ Khoa Hóa học và Hóa sinh, vào ngày 20 tháng 4 năm 2023, điện tích hạt nhân hiệu dụng có thể được sử dụng để dự đoán tính axit của các hợp chất hóa học.
5. Khối Lượng Nguyên Tử: Đo Lường Vật Chất
Khối lượng nguyên tử là một đại lượng quan trọng trong hóa học, cho biết khối lượng của một nguyên tử.
5.1. Đơn Vị Khối Lượng Nguyên Tử (amu)
Vì khối lượng của một nguyên tử rất nhỏ, người ta sử dụng một đơn vị đặc biệt để đo khối lượng nguyên tử, gọi là đơn vị khối lượng nguyên tử (atomic mass unit – amu). Một amu được định nghĩa là 1/12 khối lượng của một nguyên tử carbon-12 (¹²C).
Giá trị của 1 amu là khoảng 1.66054 x 10^-27 kg.
5.2. Tính Khối Lượng Nguyên Tử
Khối lượng nguyên tử của một nguyên tử được tính bằng tổng khối lượng của các proton, neutron và electron trong nguyên tử đó. Tuy nhiên, vì khối lượng của electron rất nhỏ so với proton và neutron, nên khối lượng nguyên tử thường được tính gần đúng bằng tổng khối lượng của các proton và neutron trong hạt nhân.
Khối lượng nguyên tử (amu) ≈ Số proton + Số neutron
Ví dụ, nguyên tử oxygen có 8 proton và 8 neutron, do đó khối lượng nguyên tử của oxygen là khoảng 16 amu.
5.3. Khối Lượng Nguyên Tử Tương Đối
Khối lượng nguyên tử tương đối (atomic weight) là khối lượng trung bình của các nguyên tử của một nguyên tố, tính đến sự phong phú tự nhiên của các đồng vị của nguyên tố đó. Khối lượng nguyên tử tương đối thường được ghi trên bảng tuần hoàn các nguyên tố hóa học.
Khối lượng nguyên tử tương đối được tính bằng công thức:
Khối lượng nguyên tử tương đối = Σ (Khối lượng đồng vị x Độ phong phú tự nhiên)
Ví dụ, nguyên tố chlorine có hai đồng vị chính: chlorine-35 (³⁵Cl) với độ phong phú tự nhiên là 75.77% và chlorine-37 (³⁷Cl) với độ phong phú tự nhiên là 24.23%. Khối lượng nguyên tử tương đối của chlorine là:
(35 amu x 0.7577) + (37 amu x 0.2423) = 35.45 amu
5.4. Ứng Dụng Của Khối Lượng Nguyên Tử
Khối lượng nguyên tử được sử dụng trong nhiều tính toán hóa học, chẳng hạn như:
- Tính số mol của một chất.
- Tính khối lượng mol của một hợp chất.
- Tính thành phần phần trăm theo khối lượng của các nguyên tố trong một hợp chất.
- Cân bằng các phương trình hóa học.
6. Lớp Electron Và Sự Sắp Xếp Electron Trong Nguyên Tử
Lớp electron và sự sắp xếp electron trong nguyên tử là một khái niệm quan trọng trong việc hiểu về cấu trúc và tính chất hóa học của các nguyên tố.
6.1. Các Lớp Electron (Vỏ Electron)
Electron chuyển động xung quanh hạt nhân theo các quỹ đạo nhất định, được gọi là các lớp electron hoặc vỏ electron. Các lớp electron được đánh số từ 1 trở đi, bắt đầu từ lớp gần hạt nhân nhất. Lớp electron thứ nhất (n=1) được gọi là lớp K, lớp electron thứ hai (n=2) được gọi là lớp L, lớp electron thứ ba (n=3) được gọi là lớp M, và cứ tiếp tục như vậy.
Mỗi lớp electron có thể chứa một số lượng electron tối đa nhất định. Số lượng electron tối đa mà một lớp electron có thể chứa được tính bằng công thức:
Số electron tối đa = 2n²
Trong đó n là số thứ tự của lớp electron.
Ví dụ:
- Lớp K (n=1) có thể chứa tối đa 2 electron.
- Lớp L (n=2) có thể chứa tối đa 8 electron.
- Lớp M (n=3) có thể chứa tối đa 18 electron.
- Lớp N (n=4) có thể chứa tối đa 32 electron.
6.2. Phân Lớp Electron (Orbital)
Mỗi lớp electron lại được chia thành các phân lớp electron, hay còn gọi là các orbital. Các orbital có hình dạng và năng lượng khác nhau. Có bốn loại orbital chính: s, p, d và f.
- Orbital s có dạng hình cầu.
- Orbital p có dạng hình quả tạ.
- Orbital d và f có hình dạng phức tạp hơn.
Mỗi orbital có thể chứa tối đa 2 electron, với spin ngược nhau.
6.3. Cấu Hình Electron
Cấu hình electron là cách sắp xếp các electron trong các lớp và phân lớp electron của một nguyên tử. Cấu hình electron cho biết số lượng electron trong mỗi lớp và phân lớp electron.
Cấu hình electron được viết theo thứ tự năng lượng tăng dần của các orbital. Các orbital có năng lượng thấp hơn được điền electron trước.
Ví dụ, cấu hình electron của nguyên tử oxygen (O) là 1s²2s²2p⁴. Điều này có nghĩa là:
- Lớp K (n=1) có 2 electron trong orbital 1s.
- Lớp L (n=2) có 2 electron trong orbital 2s và 4 electron trong orbital 2p.
6.4. Quy Tắc Hund
Quy tắc Hund nói rằng các electron sẽ chiếm các orbital riêng lẻ trong một phân lớp trước khi chúng bắt đầu ghép đôi trong cùng một orbital. Điều này có nghĩa là các electron sẽ cố gắng giữ cho spin của chúng song song (cùng hướng) càng lâu càng tốt.
6.5. Electron Hóa Trị
Electron hóa trị là các electron ở lớp ngoài cùng của một nguyên tử. Electron hóa trị quyết định tính chất hóa học của nguyên tử và cách nó tương tác với các nguyên tử khác để tạo thành các liên kết hóa học.
Các nguyên tử có cùng số lượng electron hóa trị có tính chất hóa học tương tự nhau. Ví dụ, tất cả các nguyên tố trong nhóm 1 của bảng tuần hoàn (kim loại kiềm) đều có 1 electron hóa trị và chúng có tính chất hóa học tương tự nhau.
7. Phản Ứng Hạt Nhân: Biến Đổi Nguyên Tử
Phản ứng hạt nhân là quá trình biến đổi hạt nhân của một nguyên tử, dẫn đến sự thay đổi về số lượng proton, neutron hoặc cả hai.
7.1. Các Loại Phản Ứng Hạt Nhân
Có nhiều loại phản ứng hạt nhân khác nhau, bao gồm:
- Phân hạch hạt nhân: Một hạt nhân nặng bị phân chia thành hai hoặc nhiều hạt nhân nhẹ hơn, giải phóng năng lượng lớn. Ví dụ: phân hạch uranium trong các nhà máy điện hạt nhân.
- Tổng hợp hạt nhân: Hai hoặc nhiều hạt nhân nhẹ hợp nhất thành một hạt nhân nặng hơn, giải phóng năng lượng lớn. Ví dụ: tổng hợp hydro thành helium trong Mặt Trời.
- Phóng xạ: Một hạt nhân không ổn định tự phát phân rã, phát ra các hạt hoặc tia phóng xạ. Ví dụ: phân rã của uranium-238.
- Bắn phá hạt nhân: Một hạt nhân bị bắn phá bởi một hạt khác (ví dụ: neutron, proton, hạt alpha), dẫn đến sự biến đổi hạt nhân.
7.2. Phương Trình Phản Ứng Hạt Nhân
Phản ứng hạt nhân được biểu diễn bằng phương trình phản ứng hạt nhân. Phương trình này cho biết các hạt nhân và hạt tham gia vào phản ứng, cũng như các sản phẩm của phản ứng.
Ví dụ, phương trình phản ứng phân hạch uranium-235 là:
²³⁵U + ¹n → ¹⁴¹Ba + ⁹²Kr + 3 ¹n + Năng lượng
7.3. Năng Lượng Trong Phản Ứng Hạt Nhân
Phản ứng hạt nhân thường giải phóng hoặc hấp thụ một lượng năng lượng lớn. Năng lượng này được gọi là năng lượng hạt nhân.
Năng lượng hạt nhân có thể được tính bằng công thức của Einstein:
E = mc²
Trong đó:
- E là năng lượng.
- m là độ hụt khối (sự khác biệt giữa khối lượng của các hạt phản ứng và khối lượng của các sản phẩm).
- c là vận tốc ánh sáng (khoảng 3 x 10⁸ m/s).
7.4. Ứng Dụng Của Phản Ứng Hạt Nhân
Phản ứng hạt nhân có nhiều ứng dụng quan trọng trong các lĩnh vực khác nhau, bao gồm:
- Năng lượng hạt nhân: Phản ứng phân hạch được sử dụng trong các nhà máy điện hạt nhân để sản xuất điện năng.
- Y học: Các đồng vị phóng xạ được sử dụng trong chẩn đoán và điều trị bệnh ung thư.
- Công nghiệp: Các kỹ thuật phân tích hạt nhân được sử dụng để kiểm tra chất lượng vật liệu và sản phẩm.
- Nghiên cứu khoa học: Phản ứng hạt nhân được sử dụng để nghiên cứu cấu trúc và tính chất của hạt nhân.
8. Các Câu Hỏi Thường Gặp Về Neutron Và Cấu Trúc Nguyên Tử
Dưới đây là một số câu hỏi thường gặp về neutron và cấu trúc nguyên tử, cùng với câu trả lời chi tiết:
-
Hạt nào quyết định nguyên tố hóa học của một nguyên tử?
- Số lượng proton trong hạt nhân quyết định nguyên tố hóa học của một nguyên tử.
-
Các đồng vị của cùng một nguyên tố khác nhau ở điểm nào?
- Các đồng vị của cùng một nguyên tố có cùng số proton nhưng khác nhau về số neutron.
-
Electron hóa trị là gì và chúng có vai trò gì?
- Electron hóa trị là các electron ở lớp ngoài cùng của một nguyên tử. Chúng quyết định tính chất hóa học của nguyên tử và cách nó tương tác với các nguyên tử khác.
-
Điện tích hạt nhân hiệu dụng là gì?
- Điện tích hạt nhân hiệu dụng là điện tích mà các electron bên ngoài thực sự cảm nhận được, sau khi đã trừ đi sự che chắn của các electron bên trong.
-
Khối lượng nguyên tử tương đối là gì?
- Khối lượng nguyên tử tương đối là khối lượng trung bình của các nguyên tử của một nguyên tố, tính đến sự phong phú tự nhiên của các đồng vị của nguyên tố đó.
-
Phản ứng hạt nhân là gì?
- Phản ứng hạt nhân là quá trình biến đổi hạt nhân của một nguyên tử, dẫn đến sự thay đổi về số lượng proton, neutron hoặc cả hai.
-
Neutron được sử dụng để làm gì trong các nhà máy điện hạt nhân?
- Neutron được sử dụng để gây ra phản ứng phân hạch trong các nhà máy điện hạt nhân, giải phóng năng lượng để sản xuất điện.
-
Làm thế nào để tính số neutron trong một nguyên tử?
- Số neutron (N) có thể được tính bằng công thức: N = A – Z, trong đó A là số khối và Z là số hiệu nguyên tử (số proton).
-
Tại sao neutron lại quan trọng đối với sự ổn định của hạt nhân?
- Neutron tạo ra lực hạt nhân mạnh, giúp cân bằng lực đẩy tĩnh điện giữa các proton trong hạt nhân, duy trì sự ổn định của hạt nhân.
-
tic.edu.vn có thể giúp tôi hiểu rõ hơn về cấu trúc nguyên tử như thế nào?
- tic.edu.vn cung cấp nguồn tài liệu học tập đa dạng, đầy đủ và được kiểm duyệt về cấu trúc nguyên tử, giúp bạn nắm vững kiến thức một cách dễ dàng và hiệu quả.
9. Khám Phá Thế Giới Nguyên Tử Cùng Tic.edu.vn
Bạn đang tìm kiếm tài liệu học tập chất lượng và đáng tin cậy về cấu trúc nguyên tử? Bạn muốn nâng cao kiến thức và kỹ năng của mình trong lĩnh vực hóa học và vật lý? Hãy đến với tic.edu.vn!
Tic.edu.vn là website giáo dục hàng đầu Việt Nam, cung cấp nguồn tài liệu học tập đa dạng, đầy đủ và được kiểm duyệt về tất cả các môn học từ lớp 1 đến lớp 12. Tại tic.edu.vn, bạn có thể tìm thấy:
- Bài giảng chi tiết và dễ hiểu về cấu trúc nguyên tử, proton, neutron, electron, điện tích hạt nhân, khối lượng nguyên tử, lớp electron và phản ứng hạt nhân.
- Bài tập trắc nghiệm và tự luận phong phú, giúp bạn ôn luyện và củng cố kiến thức.
- Các công cụ hỗ trợ học tập trực tuyến hiệu quả, giúp bạn học tập một cách chủ động và sáng tạo.
- Cộng đồng học tập sôi nổi, nơi bạn có thể giao lưu, học hỏi và chia sẻ kiến thức với các bạn học sinh và giáo viên khác.
Đừng bỏ lỡ cơ hội khám phá thế giới nguyên tử đầy thú vị và bổ ích cùng tic.edu.vn! Hãy truy cập website tic.edu.vn ngay hôm nay để bắt đầu hành trình chinh phục tri thức!
Liên hệ:
- Email: tic.edu@gmail.com
- Trang web: tic.edu.vn