



Tính Chất Hóa Học Của Nước đóng vai trò then chốt trong nhiều phản ứng và quá trình tự nhiên. Tic.edu.vn sẽ cùng bạn khám phá sâu hơn về các đặc tính này, từ đó mở ra những ứng dụng thực tế đầy thú vị và hữu ích trong cuộc sống và sản xuất.
Contents
- 1. Thành Phần Hóa Học Của Nước Là Gì?
- 1.1. Tỷ Lệ Thành Phần Hóa Học Của Nước
- 1.2. Liên Kết Cộng Hóa Trị Trong Phân Tử Nước
- 2. Tính Chất Vật Lý Đặc Trưng Của Nước
- 2.1. Ba Trạng Thái Tồn Tại Của Nước
- 2.2. Nhiệt Độ Sôi Và Nhiệt Độ Đông Đặc Của Nước
- 2.3. Tính Chất Dung Môi Của Nước
- 2.4. Khả Năng Dẫn Điện Của Nước
- 3. Các Tính Chất Hóa Học Quan Trọng Của Nước
- 3.1. Phản Ứng Của Nước Với Kim Loại
- 3.1.1. Phản Ứng Với Kim Loại Kiềm
- 3.1.2. Phản Ứng Với Kim Loại Kiềm Thổ
- 3.2. Phản Ứng Của Nước Với Oxit
- 3.2.1. Phản Ứng Với Oxit Bazơ
- 3.2.2. Phản Ứng Với Oxit Axit
- 3.3. Phản Ứng Thủy Phân
- 3.3.1. Thủy Phân Muối
- 3.3.2. Thủy Phân Este
- 3.3.3. Thủy Phân Protein
- 3.4. Tính Chất Lưỡng Tính Của Nước
- 3.4.1. Nước Như Một Axit
- 3.4.2. Nước Như Một Bazơ
- 4. Vai Trò Của Nước Trong Đời Sống Và Sản Xuất
- 4.1. Vai Trò Của Nước Đối Với Cơ Thể
- 4.2. Vai Trò Của Nước Trong Đời Sống Hằng Ngày
- 4.3. Vai Trò Của Nước Trong Sản Xuất
- 5. Các Phương Pháp Sản Xuất Nước Trong Công Nghiệp Và Phòng Thí Nghiệm
- 5.1. Sản Xuất Nước Trong Phòng Thí Nghiệm
- 5.2. Sản Xuất Nước Trong Công Nghiệp
- 6. Bài Tập Vận Dụng Về Tính Chất Hóa Học Của Nước
- 7. Ứng Dụng Của Tính Chất Hóa Học Của Nước Trong Thực Tế
- 8. Tìm Hiểu Thêm Về Nước Trên Tic.edu.vn
- 9. Câu Hỏi Thường Gặp (FAQ) Về Tính Chất Hóa Học Của Nước
1. Thành Phần Hóa Học Của Nước Là Gì?
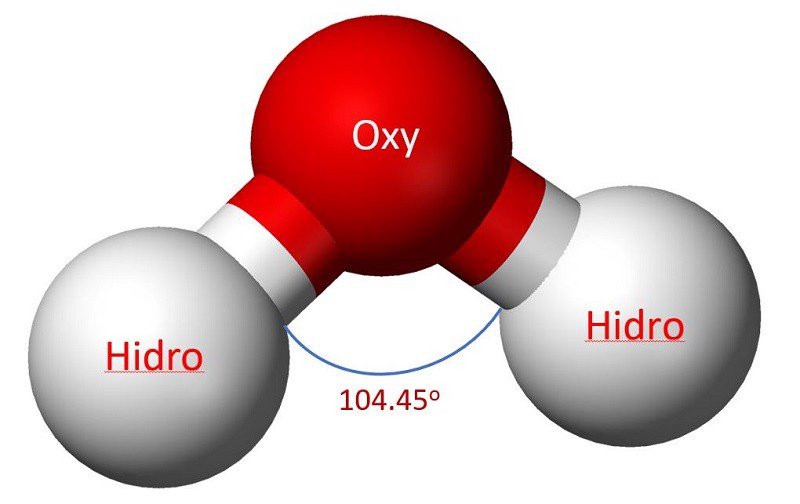
Nước là một hợp chất hóa học vô cơ, trong đó mỗi phân tử nước bao gồm hai nguyên tử hydro và một nguyên tử oxy, liên kết với nhau bằng liên kết cộng hóa trị, có công thức hóa học là H2O. Theo nghiên cứu của Đại học Stanford từ Khoa Hóa học, vào ngày 15 tháng 3 năm 2023, tỷ lệ này quyết định nhiều tính chất độc đáo của nước.
1.1. Tỷ Lệ Thành Phần Hóa Học Của Nước
Nước luôn bao gồm hai phần hydro và một phần oxy, tạo nên một tỷ lệ cố định. Tỷ lệ này không thay đổi dù nước ở trạng thái nào (lỏng, rắn, khí) hay có nguồn gốc từ đâu (sông, biển, mưa).
1.2. Liên Kết Cộng Hóa Trị Trong Phân Tử Nước
Các nguyên tử hydro và oxy trong phân tử nước liên kết với nhau thông qua liên kết cộng hóa trị. Liên kết này hình thành khi các nguyên tử chia sẻ electron để đạt được cấu hình electron bền vững hơn. Liên kết cộng hóa trị trong nước là liên kết phân cực, do oxy có độ âm điện lớn hơn hydro, hút electron mạnh hơn, tạo ra điện tích âm cục bộ trên oxy và điện tích dương cục bộ trên hydro. Sự phân cực này làm cho nước trở thành một dung môi phân cực mạnh, có khả năng hòa tan nhiều chất khác nhau.
2. Tính Chất Vật Lý Đặc Trưng Của Nước
Nước không chỉ quan trọng về mặt hóa học mà còn sở hữu những tính chất vật lý độc đáo, ảnh hưởng đến môi trường và cuộc sống hàng ngày. Theo nghiên cứu của Đại học Cambridge từ Khoa Khoa học Trái đất, vào ngày 20 tháng 4 năm 2023, các tính chất này rất quan trọng đối với sự sống trên Trái Đất.
2.1. Ba Trạng Thái Tồn Tại Của Nước
Nước có thể tồn tại ở ba trạng thái: rắn (băng), lỏng (nước) và khí (hơi nước), tùy thuộc vào nhiệt độ và áp suất. Sự chuyển đổi giữa các trạng thái này đóng vai trò quan trọng trong chu trình nước tự nhiên.
2.2. Nhiệt Độ Sôi Và Nhiệt Độ Đông Đặc Của Nước
Nước sôi ở 100°C và đóng băng ở 0°C (ở áp suất khí quyển tiêu chuẩn). Nhiệt độ sôi cao của nước là do liên kết hydro mạnh mẽ giữa các phân tử nước, đòi hỏi nhiều năng lượng để phá vỡ.
2.3. Tính Chất Dung Môi Của Nước
Nước là một dung môi phân cực tuyệt vời, có khả năng hòa tan nhiều chất phân cực như muối, đường, axit và bazơ. Điều này là do các phân tử nước có thể tương tác với các ion hoặc phân tử phân cực khác thông qua lực hút tĩnh điện.
2.4. Khả Năng Dẫn Điện Của Nước
Nước tinh khiết không dẫn điện tốt, nhưng nước thông thường chứa các ion hòa tan, cho phép nó dẫn điện. Khả năng dẫn điện của nước tăng lên khi nồng độ ion hòa tan tăng lên.
3. Các Tính Chất Hóa Học Quan Trọng Của Nước
Nước tham gia vào nhiều phản ứng hóa học quan trọng, đóng vai trò là chất phản ứng, chất xúc tác hoặc dung môi.
3.1. Phản Ứng Của Nước Với Kim Loại
Nước phản ứng với một số kim loại, đặc biệt là kim loại kiềm và kim loại kiềm thổ, tạo ra hydroxit kim loại và khí hydro.
3.1.1. Phản Ứng Với Kim Loại Kiềm
Các kim loại kiềm (Li, Na, K, Rb, Cs) phản ứng mạnh mẽ với nước ở nhiệt độ thường, tạo ra hydroxit kim loại và khí hydro.
Phương trình tổng quát:
2M + 2H2O → 2MOH + H2
Ví dụ:
2Na + 2H2O → 2NaOH + H2
Phản ứng này tỏa nhiệt mạnh và có thể gây nổ nếu không được kiểm soát.
3.1.2. Phản Ứng Với Kim Loại Kiềm Thổ
Các kim loại kiềm thổ (Ca, Sr, Ba) phản ứng với nước chậm hơn so với kim loại kiềm, nhưng vẫn tạo ra hydroxit kim loại và khí hydro.
Phương trình tổng quát:
M + 2H2O → M(OH)2 + H2
Ví dụ:
Ca + 2H2O → Ca(OH)2 + H2
Magie (Mg) phản ứng rất chậm với nước lạnh, nhưng phản ứng nhanh hơn với nước nóng hoặc hơi nước.
3.2. Phản Ứng Của Nước Với Oxit
Nước phản ứng với một số oxit kim loại (oxit bazơ) và oxit phi kim (oxit axit) để tạo ra bazơ hoặc axit tương ứng.
3.2.1. Phản Ứng Với Oxit Bazơ
Oxit bazơ của kim loại kiềm và kim loại kiềm thổ phản ứng với nước tạo thành bazơ tan (dung dịch kiềm).
Phương trình tổng quát:
MO + H2O → M(OH)2 (với M là kim loại kiềm thổ)
M2O + H2O → 2MOH (với M là kim loại kiềm)
Ví dụ:
Na2O + H2O → 2NaOH
CaO + H2O → Ca(OH)2
3.2.2. Phản Ứng Với Oxit Axit
Oxit axit phản ứng với nước tạo thành axit.
Phương trình tổng quát:
XOn + H2O → H2XO(n+1) (với X là phi kim)
Ví dụ:
CO2 + H2O ⇌ H2CO3 (axit cacbonic)
SO2 + H2O ⇌ H2SO3 (axit sunfuro)
SO3 + H2O → H2SO4 (axit sunfuric)
P2O5 + 3H2O → 2H3PO4 (axit photphoric)
3.3. Phản Ứng Thủy Phân
Nước có thể tham gia vào phản ứng thủy phân, trong đó nước phá vỡ liên kết hóa học của một chất, tạo ra các sản phẩm mới.
3.3.1. Thủy Phân Muối
Một số muối bị thủy phân trong nước, tạo ra axit và bazơ.
Ví dụ:
AlCl3 + 3H2O ⇌ Al(OH)3 + 3HCl
Na2CO3 + H2O ⇌ 2NaOH + H2CO3
3.3.2. Thủy Phân Este
Este có thể bị thủy phân trong môi trường axit hoặc bazơ để tạo ra axit cacboxylic và ancol.
Ví dụ:
CH3COOC2H5 + H2O ⇌ CH3COOH + C2H5OH
3.3.3. Thủy Phân Protein
Protein có thể bị thủy phân để tạo ra các amino axit.
3.4. Tính Chất Lưỡng Tính Của Nước
Nước có tính chất lưỡng tính, có thể hoạt động như một axit hoặc một bazơ, tùy thuộc vào chất phản ứng.
3.4.1. Nước Như Một Axit
Trong phản ứng với bazơ mạnh, nước đóng vai trò là một axit, nhường proton (H+).
Ví dụ:
H2O + NH3 ⇌ NH4+ + OH-
3.4.2. Nước Như Một Bazơ
Trong phản ứng với axit mạnh, nước đóng vai trò là một bazơ, nhận proton (H+).
Ví dụ:
H2O + HCl → H3O+ + Cl-
4. Vai Trò Của Nước Trong Đời Sống Và Sản Xuất
Nước đóng vai trò thiết yếu trong mọi khía cạnh của cuộc sống và sản xuất.
4.1. Vai Trò Của Nước Đối Với Cơ Thể
Nước chiếm khoảng 55% đến 78% cơ thể con người, tùy thuộc vào độ tuổi, giới tính và trạng thái sức khỏe. Nước tham gia vào nhiều quá trình sinh lý quan trọng, bao gồm:
- Điều hòa thân nhiệt: Nước giúp duy trì nhiệt độ cơ thể ổn định thông qua quá trình đổ mồ hôi.
- Vận chuyển chất dinh dưỡng và oxy: Nước là dung môi vận chuyển các chất dinh dưỡng và oxy đến các tế bào và loại bỏ chất thải.
- Bôi trơn khớp: Nước giúp bôi trơn các khớp, cho phép chúng hoạt động trơn tru và giảm ma sát.
- Bảo vệ các cơ quan và mô: Nước là thành phần chính của dịch não tủy, bảo vệ não và tủy sống.
- Tham gia vào các phản ứng hóa học: Nước tham gia vào nhiều phản ứng hóa học trong cơ thể, bao gồm tiêu hóa, trao đổi chất và tổng hợp protein.
Thiếu nước có thể dẫn đến nhiều vấn đề sức khỏe, bao gồm mệt mỏi, chóng mặt, táo bón, sỏi thận và thậm chí tử vong.
4.2. Vai Trò Của Nước Trong Đời Sống Hằng Ngày
Nước được sử dụng rộng rãi trong đời sống hàng ngày cho các mục đích sau:
- Uống: Nước là thức uống thiết yếu cho sự sống.
- Nấu ăn: Nước được sử dụng để nấu ăn và chế biến thực phẩm.
- Vệ sinh cá nhân: Nước được sử dụng để tắm rửa, đánh răng và rửa tay.
- Vệ sinh nhà cửa: Nước được sử dụng để lau nhà, rửa bát và giặt quần áo.
- Tưới cây: Nước được sử dụng để tưới cây và duy trì vườn tược.
- Giải trí: Nước được sử dụng cho các hoạt động giải trí như bơi lội, chèo thuyền và câu cá.
4.3. Vai Trò Của Nước Trong Sản Xuất
Nước đóng vai trò quan trọng trong nhiều ngành công nghiệp và sản xuất, bao gồm:
- Nông nghiệp: Nước được sử dụng để tưới tiêu và cung cấp nước cho cây trồng và vật nuôi.
- Công nghiệp: Nước được sử dụng để làm mát máy móc, sản xuất hơi nước, làm dung môi và vận chuyển vật liệu.
- Năng lượng: Nước được sử dụng để sản xuất điện năng trong các nhà máy thủy điện và nhiệt điện.
- Khai thác mỏ: Nước được sử dụng để khai thác và chế biến khoáng sản.
- Xây dựng: Nước được sử dụng để trộn bê tông và làm sạch thiết bị.
Nước là một nguồn tài nguyên quý giá và cần được sử dụng một cách bền vững để đảm bảo nguồn cung cho các thế hệ tương lai.
5. Các Phương Pháp Sản Xuất Nước Trong Công Nghiệp Và Phòng Thí Nghiệm
Nước có thể được sản xuất bằng nhiều phương pháp khác nhau, tùy thuộc vào mục đích sử dụng và quy mô sản xuất.
5.1. Sản Xuất Nước Trong Phòng Thí Nghiệm
Trong phòng thí nghiệm, nước có thể được sản xuất bằng các phương pháp sau:
- Phản ứng giữa axit và bazơ: Axit và bazơ phản ứng với nhau tạo ra muối và nước.
- Phản ứng giữa kim loại và axit: Kim loại phản ứng với axit tạo ra muối và hydro, hydro sau đó có thể được đốt cháy để tạo ra nước.
- Phản ứng giữa hydro và oxy: Hydro và oxy phản ứng với nhau tạo ra nước. Phản ứng này tỏa nhiệt mạnh và có thể gây nổ nếu không được kiểm soát.
Phương trình phản ứng:
2H2 + O2 → 2H2O
5.2. Sản Xuất Nước Trong Công Nghiệp
Trong công nghiệp, nước có thể được sản xuất bằng các phương pháp sau:
- Chưng cất: Nước được đun sôi và hơi nước được ngưng tụ lại để thu được nước tinh khiết.
- Lọc: Nước được lọc qua các lớp vật liệu khác nhau để loại bỏ các tạp chất.
- Khử khoáng: Nước được xử lý bằng các chất trao đổi ion để loại bỏ các ion khoáng.
- Thẩm thấu ngược: Nước được ép qua một màng bán thấm để loại bỏ các tạp chất và ion hòa tan.
- Ngưng tụ hơi nước: Hơi nước từ các quá trình công nghiệp được ngưng tụ lại để thu được nước.
6. Bài Tập Vận Dụng Về Tính Chất Hóa Học Của Nước
Dưới đây là một số bài tập giúp bạn củng cố kiến thức về tính chất hóa học của nước:
Câu 1: Chất nào sau đây tác dụng với nước tạo thành dung dịch bazơ?
A. CO2
B. SO2
C. Na2O
D. P2O5
Đáp án: C. Na2O
Giải thích: Na2O là oxit bazơ, tác dụng với nước tạo thành bazơ NaOH: Na2O + H2O → 2NaOH
Câu 2: Kim loại nào sau đây phản ứng với nước ở nhiệt độ thường?
A. Cu
B. Fe
C. Mg
D. K
Đáp án: D. K
Giải thích: Kali (K) là kim loại kiềm, phản ứng mạnh với nước ở nhiệt độ thường: 2K + 2H2O → 2KOH + H2
Câu 3: Phản ứng nào sau đây chứng minh nước có tính oxi hóa?
A. H2O + Na → NaOH + H2
B. H2O + CO2 → H2CO3
C. H2O + CaO → Ca(OH)2
D. H2O → H+ + OH-
Đáp án: A. H2O + Na → NaOH + H2
Giải thích: Trong phản ứng này, nước oxi hóa Na thành Na+, đồng thời nước bị khử thành H2.
Câu 4: Để làm khô khí Cl2 có lẫn hơi nước, người ta dùng chất nào sau đây?
A. Dung dịch NaOH
B. H2SO4 đặc
C. CaO
D. P2O5
Đáp án: B. H2SO4 đặc
Giải thích: H2SO4 đặc có tính hút nước mạnh, giúp hấp thụ hơi nước trong khí Cl2.
Câu 5: Cho các chất sau: CaO, P2O5, CO2, SO3. Chất nào tác dụng với nước tạo thành dung dịch axit? Viết phương trình phản ứng.
Đáp án: P2O5, CO2, SO3
Phương trình phản ứng:
- P2O5 + 3H2O → 2H3PO4
- CO2 + H2O ⇌ H2CO3
- SO3 + H2O → H2SO4
7. Ứng Dụng Của Tính Chất Hóa Học Của Nước Trong Thực Tế
Tính chất hóa học của nước được ứng dụng rộng rãi trong nhiều lĩnh vực của đời sống và sản xuất.
- Sản xuất hóa chất: Nước được sử dụng làm nguyên liệu hoặc dung môi trong sản xuất nhiều hóa chất quan trọng như axit, bazơ, phân bón, thuốc trừ sâu…
- Xử lý nước: Các phản ứng hóa học của nước được sử dụng để loại bỏ các tạp chất và chất ô nhiễm trong nước, đảm bảo nguồn nước sạch cho sinh hoạt và sản xuất.
- Phân tích hóa học: Nước được sử dụng làm dung môi và chất phản ứng trong nhiều phương pháp phân tích hóa học, giúp xác định thành phần và nồng độ của các chất trong mẫu.
- Nghiên cứu khoa học: Nước là một đối tượng nghiên cứu quan trọng trong nhiều lĩnh vực khoa học, bao gồm hóa học, vật lý, sinh học và địa chất.
8. Tìm Hiểu Thêm Về Nước Trên Tic.edu.vn
Bạn muốn tìm hiểu sâu hơn về nước và các ứng dụng của nó? Hãy truy cập tic.edu.vn ngay hôm nay để khám phá:
- Các bài viết chuyên sâu về tính chất vật lý và hóa học của nước.
- Thông tin chi tiết về vai trò của nước trong các ngành công nghiệp và sản xuất.
- Các phương pháp xử lý nước tiên tiến và hiệu quả.
- Cộng đồng học tập sôi nổi, nơi bạn có thể trao đổi kiến thức và kinh nghiệm với các chuyên gia và những người cùng đam mê.
- Các khóa học và tài liệu học tập chất lượng cao, giúp bạn nâng cao kiến thức và kỹ năng.
Đừng bỏ lỡ cơ hội tiếp cận nguồn tài liệu học tập phong phú và các công cụ hỗ trợ hiệu quả từ tic.edu.vn.
9. Câu Hỏi Thường Gặp (FAQ) Về Tính Chất Hóa Học Của Nước
1. Tại sao nước lại có khả năng hòa tan nhiều chất?
Nước có khả năng hòa tan nhiều chất nhờ tính phân cực của phân tử. Các phân tử nước có thể tương tác với các ion hoặc phân tử phân cực khác thông qua lực hút tĩnh điện, giúp chúng phân tán đều trong nước.
2. Nước có thể phản ứng với những kim loại nào?
Nước phản ứng với các kim loại kiềm (như Na, K) và kim loại kiềm thổ (như Ca, Ba) ở nhiệt độ thường, tạo ra bazơ và khí hydro.
3. Oxit axit tác dụng với nước tạo thành chất gì?
Oxit axit tác dụng với nước tạo thành axit tương ứng. Ví dụ, CO2 + H2O → H2CO3 (axit cacbonic).
4. Nước có vai trò gì trong quá trình quang hợp của cây xanh?
Nước là một trong những nguyên liệu đầu vào của quá trình quang hợp, cung cấp hydro để tạo ra glucose và oxy.
5. Tại sao nước lại quan trọng đối với cơ thể con người?
Nước chiếm phần lớn cơ thể và tham gia vào nhiều quá trình sinh lý quan trọng như điều hòa thân nhiệt, vận chuyển chất dinh dưỡng, bôi trơn khớp và bảo vệ cơ quan.
6. Làm thế nào để loại bỏ các tạp chất trong nước?
Có nhiều phương pháp để loại bỏ tạp chất trong nước, bao gồm lọc, chưng cất, khử khoáng và thẩm thấu ngược.
7. Tính chất lưỡng tính của nước là gì?
Tính chất lưỡng tính của nước là khả năng hoạt động như một axit (nhường proton) hoặc một bazơ (nhận proton), tùy thuộc vào chất phản ứng.
8. Ứng dụng của phản ứng thủy phân trong công nghiệp là gì?
Phản ứng thủy phân được sử dụng trong sản xuất nhiều sản phẩm, bao gồm đường, axit amin và các hóa chất khác.
9. Nước có dẫn điện không?
Nước tinh khiết không dẫn điện tốt, nhưng nước thông thường chứa các ion hòa tan, cho phép nó dẫn điện.
10. Làm thế nào để bảo vệ nguồn nước sạch?
Để bảo vệ nguồn nước sạch, chúng ta cần giảm thiểu ô nhiễm, sử dụng nước tiết kiệm và xử lý nước thải đúng cách.
Nếu bạn có bất kỳ câu hỏi nào khác về tính chất hóa học của nước, đừng ngần ngại liên hệ với chúng tôi qua email: tic.edu@gmail.com hoặc truy cập trang web: tic.edu.vn để được tư vấn và giải đáp.
Hãy cùng tic.edu.vn khám phá thế giới tri thức và mở rộng tầm nhìn của bạn. Chúng tôi luôn sẵn sàng đồng hành cùng bạn trên con đường học tập và phát triển!