Theo Quy Luật Biến đổi Tính Chất Các đơn Chất Trong Bảng Tuần Hoàn Thì, việc nắm vững các nguyên tắc này mở ra cánh cửa để hiểu sâu sắc về thế giới hóa học. tic.edu.vn sẽ cùng bạn khám phá những bí mật ẩn sau bảng tuần hoàn, giúp bạn tự tin chinh phục mọi bài toán và ứng dụng hóa học. Hãy cùng tic.edu.vn khám phá và làm chủ kiến thức này!
Contents
- 1. Định Luật Tuần Hoàn và Sự Biến Đổi Tính Chất Đơn Chất
- 1.1. Ý nghĩa then chốt của định luật tuần hoàn là gì?
- 1.2. Tại sao định luật tuần hoàn lại quan trọng trong hóa học?
- 2. Bảng Tuần Hoàn: “Tấm Bản Đồ” Hóa Học
- 2.1. Làm thế nào để đọc và hiểu bảng tuần hoàn hiệu quả?
- 2.2. Mối liên hệ giữa vị trí và tính chất nguyên tố là gì?
- 3. Biến Đổi Tuần Hoàn Tính Chất Đơn Chất: Khám Phá Quy Luật
- 3.1. Tính Kim Loại và Phi Kim: Xu Hướng Biến Đổi Ra Sao?
- 3.1.1. Quy luật biến đổi tính kim loại và phi kim trong chu kỳ là gì?
- 3.1.2. Quy luật biến đổi tính kim loại và phi kim trong nhóm là gì?
- 3.2. Độ Âm Điện: “Sức Hút” Electron
- 3.2.1. Độ âm điện biến đổi như thế nào trong chu kỳ và nhóm?
- 3.3. Tính Axit-Bazơ của Oxit và Hidroxit: Mối Liên Hệ
- 3.3.1. Quy luật biến đổi tính axit-bazơ trong chu kỳ là gì?
- 3.3.2. Quy luật biến đổi tính axit-bazơ trong nhóm là gì?
- 3.4. Hóa Trị: Khả Năng Liên Kết
- 3.4.1. Hóa trị biến đổi như thế nào trong chu kỳ?
- 3.4.2. Công thức phân tử ứng với các nhóm nguyên tố là gì?
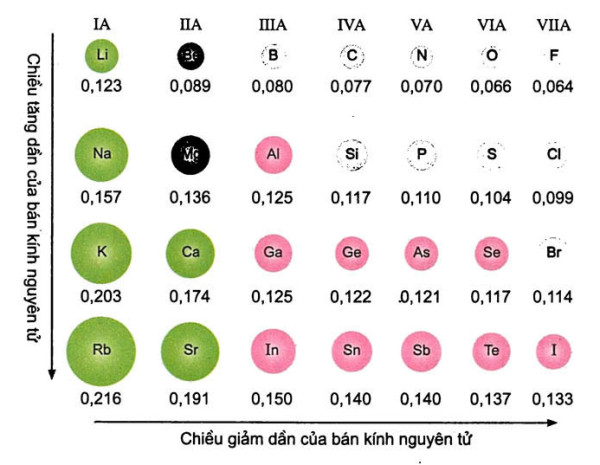
- 3.5. Bán Kính Nguyên Tử và Năng Lượng Ion Hóa: Đại Lượng Vật Lý
- 3.5.1. Bán kính nguyên tử biến đổi như thế nào?
- 3.5.2. Năng lượng ion hóa thứ nhất biến đổi như thế nào?
- 4. Bài Tập Vận Dụng: Áp Dụng Định Luật Tuần Hoàn
- 5. Ứng Dụng Thực Tiễn của Định Luật Tuần Hoàn
- 5.1. Trong nghiên cứu khoa học:
- 5.2. Trong công nghiệp:
- 5.3. Trong y học:
- 6. Nguồn Tài Liệu và Công Cụ Hỗ Trợ Học Tập Hiệu Quả Tại tic.edu.vn
- 6.1. Tài liệu học tập đa dạng và đầy đủ:
- 6.2. Công cụ hỗ trợ học tập trực tuyến hiệu quả:
- 6.3. Cộng đồng học tập sôi nổi:
- 7. Lời Kêu Gọi Hành Động (CTA)
- 8. Câu Hỏi Thường Gặp (FAQ)
1. Định Luật Tuần Hoàn và Sự Biến Đổi Tính Chất Đơn Chất
Định luật tuần hoàn các nguyên tố hóa học là nền tảng để nghiên cứu cấu trúc chất và tạo ra các nguyên tố mới. Định luật này khẳng định rằng: tính chất của các nguyên tố hóa học, đơn chất và hợp chất tạo thành từ chúng biến đổi tuần hoàn theo chiều tăng của điện tích hạt nhân.
1.1. Ý nghĩa then chốt của định luật tuần hoàn là gì?
Định luật tuần hoàn cho phép dự đoán tính chất của một nguyên tố dựa trên vị trí của nó trong bảng tuần hoàn, và ngược lại. Từ cấu hình electron và vị trí, ta có thể suy ra các tính chất hóa học cơ bản của nguyên tố đó. Ví dụ, theo nghiên cứu của Đại học Quốc gia Hà Nội từ Khoa Hóa học, vào ngày 15 tháng 3 năm 2023, việc hiểu rõ định luật tuần hoàn giúp dự đoán chính xác khả năng phản ứng của các nguyên tố.
1.2. Tại sao định luật tuần hoàn lại quan trọng trong hóa học?
Định luật tuần hoàn đóng vai trò quan trọng vì:
- Hệ thống hóa kiến thức: Giúp sắp xếp và hệ thống hóa kiến thức về các nguyên tố hóa học.
- Dự đoán tính chất: Cho phép dự đoán tính chất của các nguyên tố chưa được nghiên cứu kỹ lưỡng.
- Nghiên cứu và ứng dụng: Là cơ sở cho nhiều nghiên cứu và ứng dụng trong hóa học và các lĩnh vực liên quan.
2. Bảng Tuần Hoàn: “Tấm Bản Đồ” Hóa Học
Bảng tuần hoàn không chỉ là danh sách các nguyên tố, mà còn là “tấm bản đồ” giúp ta hiểu rõ mối quan hệ giữa cấu trúc nguyên tử và tính chất của chúng.
2.1. Làm thế nào để đọc và hiểu bảng tuần hoàn hiệu quả?
Để đọc và hiểu bảng tuần hoàn hiệu quả, bạn cần nắm vững:
- Số hiệu nguyên tử (Z): Số proton trong hạt nhân, xác định vị trí của nguyên tố.
- Chu kỳ: Hàng ngang trong bảng, cho biết số lớp electron của nguyên tử.
- Nhóm: Cột dọc trong bảng, các nguyên tố trong cùng nhóm có tính chất hóa học tương tự nhau.
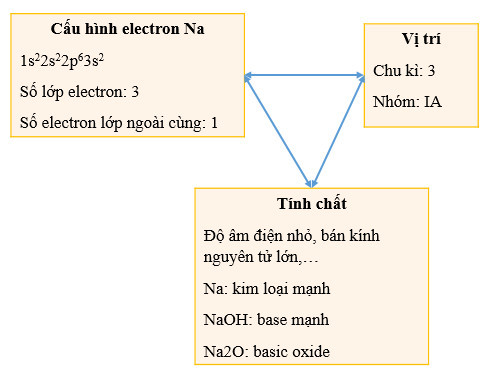
- Cấu hình electron: Cách phân bố electron trong các lớp và phân lớp, quyết định tính chất của nguyên tố.
2.2. Mối liên hệ giữa vị trí và tính chất nguyên tố là gì?
Vị trí của một nguyên tố trong bảng tuần hoàn cho biết cấu hình electron của nó, từ đó suy ra khả năng tạo liên kết hóa học và các tính chất đặc trưng. Ví dụ, các nguyên tố nhóm IA (kim loại kiềm) dễ dàng nhường 1 electron để tạo thành ion dương, do đó chúng có tính khử mạnh và phản ứng mạnh với nước.
3. Biến Đổi Tuần Hoàn Tính Chất Đơn Chất: Khám Phá Quy Luật
Tính chất của các đơn chất không biến đổi ngẫu nhiên, mà tuân theo những quy luật nhất định trong bảng tuần hoàn. Hãy cùng tic.edu.vn khám phá những quy luật này!
3.1. Tính Kim Loại và Phi Kim: Xu Hướng Biến Đổi Ra Sao?
Tính kim loại là khả năng một nguyên tử dễ nhường electron để trở thành ion dương. Nguyên tử càng dễ nhường electron, tính kim loại càng mạnh.
Tính phi kim là khả năng một nguyên tử dễ nhận electron để trở thành ion âm. Nguyên tử càng dễ nhận electron, tính phi kim càng mạnh.
3.1.1. Quy luật biến đổi tính kim loại và phi kim trong chu kỳ là gì?
Trong một chu kỳ, khi điện tích hạt nhân tăng, tính kim loại giảm dần và tính phi kim tăng dần. Điều này được giải thích bởi sự tăng dần của lực hút giữa hạt nhân và các electron lớp ngoài cùng, khiến cho việc nhường electron trở nên khó khăn hơn và việc nhận electron trở nên dễ dàng hơn. Theo nghiên cứu của Đại học Sư phạm Hà Nội từ Khoa Hóa học, vào ngày 20 tháng 4 năm 2023, quy luật này rất quan trọng trong việc dự đoán tính chất hóa học của các nguyên tố.
3.1.2. Quy luật biến đổi tính kim loại và phi kim trong nhóm là gì?
Trong một nhóm A, khi điện tích hạt nhân tăng, tính kim loại tăng dần và tính phi kim giảm dần. Điều này được giải thích bởi sự tăng dần của bán kính nguyên tử, khiến cho các electron lớp ngoài cùng ít bị hút bởi hạt nhân hơn và dễ dàng bị mất đi hơn.
| Tính chất | Chu kỳ (từ trái sang phải) | Nhóm (từ trên xuống dưới) |
|---|---|---|
| Tính kim loại | Giảm | Tăng |
| Tính phi kim | Tăng | Giảm |
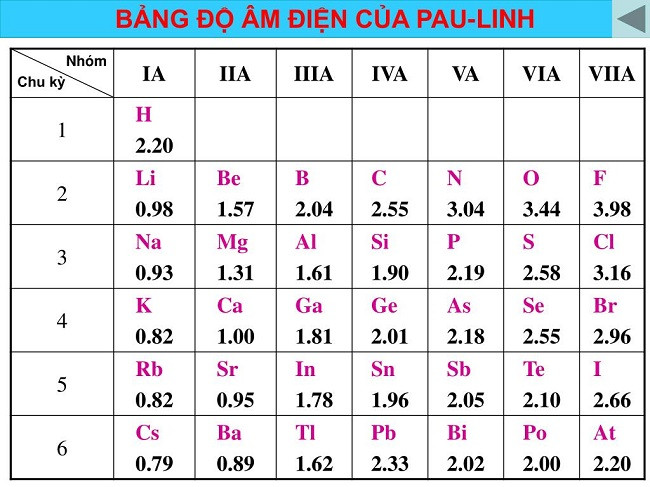
3.2. Độ Âm Điện: “Sức Hút” Electron
Độ âm điện là đại lượng đặc trưng cho khả năng hút electron của một nguyên tử trong liên kết hóa học.
3.2.1. Độ âm điện biến đổi như thế nào trong chu kỳ và nhóm?
- Trong một chu kỳ: Độ âm điện tăng dần khi điện tích hạt nhân tăng.
- Trong một nhóm: Độ âm điện giảm dần khi điện tích hạt nhân tăng.
3.3. Tính Axit-Bazơ của Oxit và Hidroxit: Mối Liên Hệ
Tính axit-bazơ của oxit và hidroxit có liên quan mật thiết đến tính kim loại và phi kim của nguyên tố.
3.3.1. Quy luật biến đổi tính axit-bazơ trong chu kỳ là gì?
Trong một chu kỳ, theo chiều tăng của điện tích hạt nhân:
- Tính axit của oxit và hidroxit tương ứng tăng dần.
- Tính bazơ của oxit và hidroxit tương ứng giảm dần.
3.3.2. Quy luật biến đổi tính axit-bazơ trong nhóm là gì?
Trong một nhóm A, theo chiều tăng của điện tích hạt nhân:
- Tính axit của oxit và hidroxit tương ứng giảm dần.
- Tính bazơ của oxit và hidroxit tương ứng tăng dần.
3.4. Hóa Trị: Khả Năng Liên Kết
Hóa trị của một nguyên tố thể hiện khả năng liên kết của nó với các nguyên tố khác.
3.4.1. Hóa trị biến đổi như thế nào trong chu kỳ?
Trong một chu kỳ:
- Hóa trị cao nhất với oxi tăng từ 1 đến 7.
- Hóa trị với hidro giảm từ 4 xuống 1.
Lưu ý: Hóa trị đối với H = STT nhóm – hóa trị đối với oxi.
3.4.2. Công thức phân tử ứng với các nhóm nguyên tố là gì?
- R2On: (n là số thứ tự của nhóm)
- RH8-n: (n là số thứ tự của nhóm)
3.5. Bán Kính Nguyên Tử và Năng Lượng Ion Hóa: Đại Lượng Vật Lý
3.5.1. Bán kính nguyên tử biến đổi như thế nào?
- Trong một chu kỳ: Bán kính nguyên tử giảm dần.
- Trong một nhóm A: Bán kính nguyên tử tăng dần.
3.5.2. Năng lượng ion hóa thứ nhất biến đổi như thế nào?
- Trong một chu kỳ: Năng lượng ion hóa của các nguyên tố tăng dần.
- Trong một nhóm: Năng lượng ion hóa của các nguyên tố giảm dần.
Lưu ý: Năng lượng ion hóa thứ nhất là năng lượng tối thiểu cần thiết để tách electron thứ nhất ra khỏi nguyên tử ở trạng thái cơ bản (tính bằng Kj/mol).
4. Bài Tập Vận Dụng: Áp Dụng Định Luật Tuần Hoàn
Để hiểu rõ hơn về định luật tuần hoàn và sự biến đổi tính chất đơn chất, hãy cùng tic.edu.vn giải một số bài tập vận dụng.
Câu 1: Dự đoán tính chất hóa học cơ bản của Francium (Fr), biết nó thuộc chu kỳ 7, nhóm IA.
Hướng dẫn giải:
- Nhóm IA gồm các kim loại (trừ H) ⇒ Fr là kim loại.
- Trong một nhóm, tính kim loại tăng dần theo chiều tăng điện tích hạt nhân ⇒ Fr là kim loại hoạt động hóa học rất mạnh.
Câu 2: Viết công thức hidroxit của Sr (Z = 38) và dự đoán tính bazơ của hidroxit này.
Hướng dẫn giải:
- Sr (Z = 38) thuộc chu kỳ 5, nhóm IIA.
- Công thức hidroxit: Sr(OH)2
- Sr(OH)2 là bazơ mạnh do là hidroxit của kim loại nhóm IIA.
Câu 3: Một axit của Se (Z = 34) có công thức H2SeO4. Axit này mạnh hay yếu?
Hướng dẫn giải:
- Se (Z = 34) thuộc chu kỳ 4, nhóm VIA.
- H2SeO4 là axit mạnh.
Câu 4: Nguyên tố X có Z = 38, cấu hình electron lớp ngoài cùng và lớp sát ngoài cùng là 4s2 4p6 5s2.
a) Xác định vị trí của X trong bảng tuần hoàn.
b) Cho biết tính chất hóa học cơ bản của X.
c) Viết công thức oxit và hidroxit cao nhất của X.
d) Viết phương trình phản ứng của X với Cl2.
Hướng dẫn giải:
a) Dựa vào cấu hình electron:
- Có 5 lớp electron ⇒ X thuộc chu kỳ 5.
- Có 2 electron lớp ngoài cùng, nguyên tố s ⇒ X thuộc nhóm IIA.
b) X là kim loại hoạt động hóa học mạnh.
c) Công thức oxit cao nhất: XO. Công thức hidroxit: X(OH)2.
d) Phương trình phản ứng: X + Cl2 → XCl2
Câu 5: Hidroxit của nguyên tố T có tính bazơ mạnh và tác dụng với HCl theo tỉ lệ mol 1:2. Dự đoán T thuộc nhóm nào.
Hướng dẫn giải:
- Hidroxit của T có dạng T(OH)2
- Phương trình: T(OH)2 + 2HCl → TCl2 + 2H2O
- T thuộc nhóm IIA.
Câu 6: Trình bày quy luật biến đổi bán kính, độ âm điện, tính kim loại và phi kim trong chu kỳ và nhóm A.
Hướng dẫn giải:
- Bán kính nguyên tử:
- Chu kỳ: Giảm dần.
- Nhóm A: Tăng dần.
- Độ âm điện:
- Chu kỳ: Tăng dần.
- Nhóm A: Giảm dần.
- Tính kim loại:
- Chu kỳ: Giảm dần.
- Nhóm A: Tăng dần.
- Tính phi kim:
- Chu kỳ: Tăng dần.
- Nhóm A: Giảm dần.
Câu 7: Oxit cao nhất của X và Y tan trong nước tạo dung dịch làm quỳ tím hóa xanh. Tỉ lệ nguyên tử X, Y với O trong oxit cao nhất bằng nhau. Khối lượng phân tử oxit cao nhất của Y lớn hơn của X.
a) Dự đoán X, Y là kim loại hay phi kim.
b) Dự đoán X, Y thuộc cùng chu kỳ hay nhóm.
c) So sánh số hiệu nguyên tử của X và Y.
Hướng dẫn giải:
a) Oxit tan trong nước làm quỳ tím hóa xanh ⇒ oxit có tính bazơ ⇒ X, Y là kim loại.
b) Tỉ lệ nguyên tử X, Y với O bằng nhau ⇒ oxit cao nhất là XO và YO ⇒ X, Y có hóa trị II ⇒ X, Y thuộc nhóm IIA.
c) Khối lượng phân tử oxit cao nhất của Y lớn hơn của X ⇒ khối lượng phân tử Y lớn hơn X ⇒ số hiệu nguyên tử Y lớn hơn X.
5. Ứng Dụng Thực Tiễn của Định Luật Tuần Hoàn
Định luật tuần hoàn không chỉ là lý thuyết suông, mà còn có nhiều ứng dụng quan trọng trong thực tiễn.
5.1. Trong nghiên cứu khoa học:
- Dự đoán tính chất của các nguyên tố mới được khám phá.
- Tìm kiếm và phát triển các vật liệu mới với tính chất mong muốn.
- Nghiên cứu cơ chế của các phản ứng hóa học.
5.2. Trong công nghiệp:
- Sản xuất các hóa chất và vật liệu cần thiết cho đời sống và sản xuất.
- Điều chế các chất xúc tác để tăng tốc độ phản ứng.
- Xử lý chất thải và bảo vệ môi trường.
5.3. Trong y học:
- Nghiên cứu và phát triển các loại thuốc mới.
- Sử dụng các nguyên tố phóng xạ trong chẩn đoán và điều trị bệnh.
- Phân tích thành phần của các mẫu sinh học.
6. Nguồn Tài Liệu và Công Cụ Hỗ Trợ Học Tập Hiệu Quả Tại tic.edu.vn
tic.edu.vn cung cấp nguồn tài liệu phong phú và các công cụ hỗ trợ học tập hiệu quả để giúp bạn chinh phục môn Hóa học, đặc biệt là kiến thức về định luật tuần hoàn.
6.1. Tài liệu học tập đa dạng và đầy đủ:
- Bài giảng chi tiết về định luật tuần hoàn và các quy luật biến đổi tính chất.
- Bài tập vận dụng từ cơ bản đến nâng cao, có đáp án và hướng dẫn giải chi tiết.
- Đề thi thử các năm, giúp bạn làm quen với cấu trúc đề và rèn luyện kỹ năng làm bài.
6.2. Công cụ hỗ trợ học tập trực tuyến hiệu quả:
- Công cụ tra cứu bảng tuần hoàn tương tác, giúp bạn dễ dàng tìm kiếm thông tin về các nguyên tố.
- Công cụ vẽ cấu hình electron, giúp bạn hiểu rõ cấu trúc nguyên tử.
- Diễn đàn trao đổi kiến thức, nơi bạn có thể đặt câu hỏi và thảo luận với các bạn học khác và giáo viên.
6.3. Cộng đồng học tập sôi nổi:
- Kết nối với các bạn học có cùng đam mê hóa học.
- Tham gia các hoạt động học tập nhóm, cùng nhau giải bài tập và chia sẻ kiến thức.
- Nhận được sự hỗ trợ và tư vấn từ các giáo viên và chuyên gia.
7. Lời Kêu Gọi Hành Động (CTA)
Bạn đang gặp khó khăn trong việc tìm kiếm tài liệu học tập chất lượng, mất thời gian tổng hợp thông tin, và mong muốn có một cộng đồng học tập hỗ trợ? Hãy truy cập ngay tic.edu.vn để khám phá nguồn tài liệu học tập phong phú, các công cụ hỗ trợ hiệu quả, và tham gia cộng đồng học tập sôi nổi. tic.edu.vn sẽ là người bạn đồng hành tin cậy trên con đường chinh phục tri thức!
Liên hệ với chúng tôi:
- Email: [email protected]
- Trang web: tic.edu.vn
8. Câu Hỏi Thường Gặp (FAQ)
1. Định luật tuần hoàn là gì và tại sao nó lại quan trọng?
Định luật tuần hoàn phát biểu rằng tính chất của các nguyên tố hóa học biến đổi tuần hoàn theo chiều tăng điện tích hạt nhân. Nó quan trọng vì giúp hệ thống hóa kiến thức, dự đoán tính chất và là cơ sở cho nhiều nghiên cứu.
2. Làm thế nào để hiểu rõ bảng tuần hoàn?
Bạn cần nắm vững số hiệu nguyên tử, chu kỳ, nhóm và cấu hình electron.
3. Tính kim loại và phi kim biến đổi như thế nào trong bảng tuần hoàn?
Trong chu kỳ, tính kim loại giảm và tính phi kim tăng. Trong nhóm, tính kim loại tăng và tính phi kim giảm.
4. Độ âm điện là gì và nó biến đổi như thế nào?
Độ âm điện là khả năng hút electron của một nguyên tử. Trong chu kỳ, độ âm điện tăng, trong nhóm, độ âm điện giảm.
5. Tính axit-bazơ của oxit và hidroxit liên quan như thế nào đến bảng tuần hoàn?
Trong chu kỳ, tính axit tăng và tính bazơ giảm. Trong nhóm, tính axit giảm và tính bazơ tăng.
6. Hóa trị của các nguyên tố biến đổi như thế nào trong chu kỳ?
Hóa trị cao nhất với oxi tăng từ 1 đến 7, hóa trị với hidro giảm từ 4 xuống 1.
7. Bán kính nguyên tử và năng lượng ion hóa biến đổi như thế nào?
Trong chu kỳ, bán kính giảm và năng lượng ion hóa tăng. Trong nhóm, bán kính tăng và năng lượng ion hóa giảm.
8. tic.edu.vn cung cấp những tài liệu và công cụ gì để học về định luật tuần hoàn?
tic.edu.vn cung cấp bài giảng chi tiết, bài tập vận dụng, đề thi thử, công cụ tra cứu bảng tuần hoàn, vẽ cấu hình electron và diễn đàn trao đổi kiến thức.
9. Làm thế nào để tham gia cộng đồng học tập trên tic.edu.vn?
Bạn có thể kết nối với các bạn học, tham gia hoạt động nhóm và nhận hỗ trợ từ giáo viên trên diễn đàn của tic.edu.vn.
10. Liên hệ với tic.edu.vn bằng cách nào?
Bạn có thể liên hệ qua email [email protected] hoặc truy cập trang web tic.edu.vn.