

Chào bạn đọc thân mến! Nếu bạn đang tìm kiếm câu trả lời cho câu hỏi “Phenol Có Làm đổi Màu Quỳ Tím Không?” và muốn hiểu rõ hơn về phenol, tính chất, ứng dụng của nó, thì bạn đã đến đúng nơi rồi đấy! tic.edu.vn sẽ cung cấp cho bạn thông tin chi tiết, dễ hiểu và được tối ưu hóa cho SEO, giúp bạn nắm vững kiến thức về phenol một cách hiệu quả.
Contents
- 1. Phenol Là Gì? Tổng Quan Về Hợp Chất Quan Trọng
- 2. Khám Phá Tính Chất Lý Hóa Độc Đáo Của Phenol
- 2.1. Tính Chất Vật Lý Của Phenol: Đặc Điểm Nhận Biết
- 2.2. Tính Chất Hóa Học Của Phenol: Phản Ứng Đặc Trưng
- 2.2.1. Phenol Có Tính Axit Yếu:
- 2.2.2. Phenol Có Làm Đổi Màu Quỳ Tím Không?
- 2.2.3. Phản Ứng Thế Brom:
- 2.2.4. Phản Ứng Với Axit Nitric:
- 2.2.5. Phản Ứng Với Natri Hydroxit (NaOH):
- 2.2.6. Phản Ứng Với Kim Loại Kiềm:
- 2.2.7. Phản Ứng Cháy:
- 2.2.8. Phản Ứng Với Sắt(III) Clorua (FeCl3):
- 2.2.9. Phản Ứng Tạo Este:
- 3. Các Phương Pháp Điều Chế Phenol Phổ Biến Hiện Nay
- 4. Ứng Dụng Rộng Rãi Của Phenol Trong Đời Sống Và Công Nghiệp
- 5. Cảnh Giác Với Độc Tính Của Phenol Và Biện Pháp An Toàn
- 5.1. Mức Độ Độc Hại Của Phenol:
- 5.2. Biện Pháp Phòng Ngừa Và An Toàn Khi Sử Dụng Phenol:
- 6. Vì Sao Nên Tìm Hiểu Về Phenol Tại tic.edu.vn?
- 7. Ý Định Tìm Kiếm Của Người Dùng Về Phenol
- 8. Câu Hỏi Thường Gặp Về Phenol (FAQ)
- 9. Kết Luận
1. Phenol Là Gì? Tổng Quan Về Hợp Chất Quan Trọng
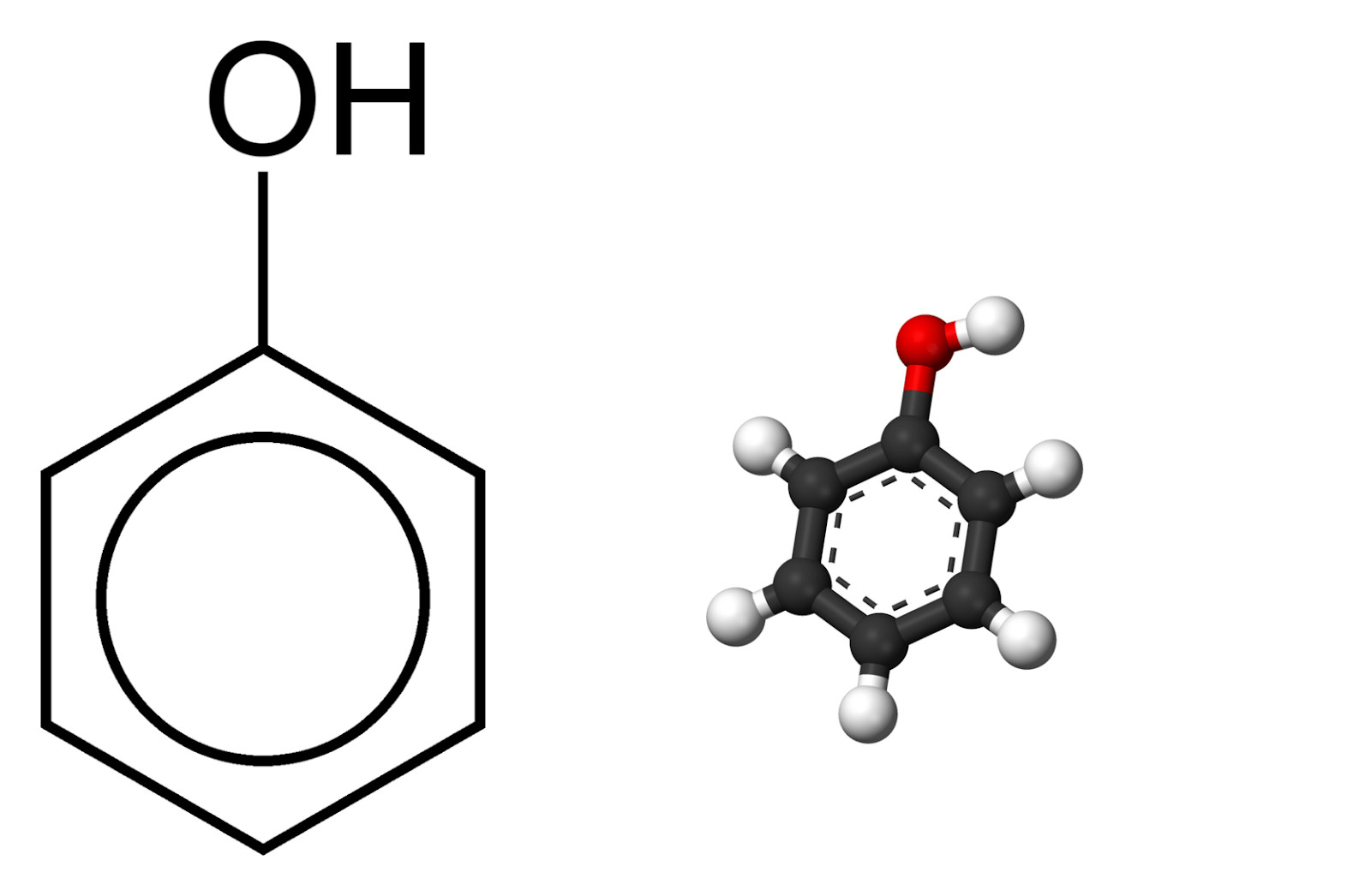
Phenol là một hợp chất hữu cơ quan trọng, thuộc loại hợp chất thơm, trong đó nhóm hydroxyl (-OH) liên kết trực tiếp với một nguyên tử carbon của vòng benzen. Phenol có công thức hóa học là C6H5OH, tồn tại ở dạng tinh thể không màu hoặc màu trắng, có mùi đặc trưng và có tính axit yếu. Vậy phenol có những tính chất và ứng dụng gì đặc biệt? Chúng ta hãy cùng tìm hiểu sâu hơn nhé!
2. Khám Phá Tính Chất Lý Hóa Độc Đáo Của Phenol
Phenol sở hữu những tính chất lý hóa đặc trưng, quyết định vai trò quan trọng của nó trong nhiều lĩnh vực.
2.1. Tính Chất Vật Lý Của Phenol: Đặc Điểm Nhận Biết
- Trạng thái: Ở điều kiện thường, phenol tồn tại ở dạng tinh thể rắn, không màu hoặc có màu trắng. Khi tiếp xúc với không khí, phenol dễ bị oxy hóa và chuyển sang màu hồng nhạt.
- Mùi: Phenol có mùi đặc trưng, hắc, tương tự như mùi thuốc khử trùng.
- Độ tan: Phenol ít tan trong nước lạnh, nhưng tan tốt trong các dung môi hữu cơ như ethanol, ether.
- Điểm nóng chảy: 40-43°C.
- Điểm sôi: 182°C.
2.2. Tính Chất Hóa Học Của Phenol: Phản Ứng Đặc Trưng
Alt: Công thức cấu tạo phân tử phenol (C6H5OH) thể hiện vòng benzen liên kết với nhóm hydroxyl (-OH)
Phenol tham gia vào nhiều phản ứng hóa học quan trọng, thể hiện tính chất hóa học đa dạng của nó.
2.2.1. Phenol Có Tính Axit Yếu:
Mặc dù có nhóm -OH, phenol có tính axit yếu hơn so với các alcohol thông thường. Điều này là do sự liên hợp của cặp electron tự do trên oxy của nhóm -OH với hệ thống pi electron của vòng benzene, làm tăng độ bền của anion phenolate (C6H5O-) sau khi phenol nhường proton. Theo nghiên cứu của Đại học Quốc gia Hà Nội từ Khoa Hóa học, vào tháng 3 năm 2020, tính axit của phenol mạnh hơn ethanol khoảng 1 triệu lần do hiệu ứng cộng hưởng trong vòng benzen.
2.2.2. Phenol Có Làm Đổi Màu Quỳ Tím Không?
Câu trả lời là không. Do tính axit của phenol rất yếu, dung dịch phenol không đủ khả năng làm đổi màu quỳ tím. Quỳ tím chỉ chuyển sang màu đỏ khi tiếp xúc với các axit mạnh hơn nhiều.
2.2.3. Phản Ứng Thế Brom:
Phenol dễ dàng tham gia phản ứng thế brom vào vòng benzene. Khi cho phenol tác dụng với nước brom, sẽ tạo thành kết tủa trắng của 2,4,6-tribromophenol. Phản ứng này được sử dụng để nhận biết phenol.
C6H5OH + 3Br2 → C6H2Br3OH + 3HBr2.2.4. Phản Ứng Với Axit Nitric:
Phenol phản ứng với axit nitric tạo thành các sản phẩm nitrophenol. Tùy thuộc vào điều kiện phản ứng, có thể thu được các sản phẩm khác nhau:
-
Với axit nitric loãng, tạo thành hỗn hợp 2-nitrophenol và 4-nitrophenol.
-
Với axit nitric đặc, tạo thành 2,4,6-trinitrophenol (axit picric), một chất nổ mạnh.
C6H5OH + 3HNO3 → C6H2(NO2)3OH + 3H2O
2.2.5. Phản Ứng Với Natri Hydroxit (NaOH):
Phenol phản ứng với NaOH tạo thành muối natri phenolat và nước. Phản ứng này chứng tỏ tính axit của phenol.
C6H5OH + NaOH → C6H5ONa + H2ONatri phenolat có thể phản ứng với CO2 và H2O để tái tạo phenol:
C6H5ONa + CO2 + H2O → C6H5OH + NaHCO32.2.6. Phản Ứng Với Kim Loại Kiềm:
Phenol phản ứng với các kim loại kiềm như natri (Na) tạo thành muối phenolat và giải phóng khí hydro.
C6H5OH + Na → C6H5ONa + 1/2H22.2.7. Phản Ứng Cháy:
Phenol cháy trong không khí tạo thành khí cacbon dioxit và nước.
C6H5OH + 7O2 → 6CO2 + 3H2O2.2.8. Phản Ứng Với Sắt(III) Clorua (FeCl3):
Phenol tạo phức màu tím với dung dịch FeCl3. Phản ứng này được sử dụng để nhận biết phenol.
6ArOH + FeCl3 → [Fe(OAr)6]3- + 3H+ + 3HCl2.2.9. Phản Ứng Tạo Este:
Phenol có thể phản ứng với các dẫn xuất của axit cacboxylic như clorua axit hoặc anhydride để tạo thành este.
C6H5OH + CH3COCl → CH3COOC6H5 + HCl
C6H5OH + (CH3CO)2O → CH3COOC6H5 + CH3COOH3. Các Phương Pháp Điều Chế Phenol Phổ Biến Hiện Nay
Phenol có thể được điều chế bằng nhiều phương pháp khác nhau, từ các nguyên liệu đầu vào khác nhau. Dưới đây là một số phương pháp phổ biến:
-
Từ benzen: Benzen được clo hóa thành clorobenzen, sau đó thủy phân để tạo thành natri phenolat, cuối cùng axit hóa để thu được phenol.
C6H6 → C6H5Cl → C6H5ONa → C6H5OH
-
Từ cumen: Cumen (isopropylbenzen) được oxy hóa để tạo thành cumen hydroperoxit, sau đó phân cắt trong môi trường axit để tạo thành phenol và axeton. Đây là phương pháp công nghiệp phổ biến nhất hiện nay.
C6H5 → C6H5CH(CH3)2 → C6H5OH
-
Từ nhựa than đá: Phenol có thể được tách ra từ nhựa than đá bằng cách chiết bằng dung dịch NaOH, sau đó axit hóa lớp chiết để thu được phenol.
Nhựa than đá + NaOH dư → C6H5ONa (trong lớp nước)
C6H5ONa + H+ → C6H5OH
4. Ứng Dụng Rộng Rãi Của Phenol Trong Đời Sống Và Công Nghiệp
Phenol là một hợp chất đa năng với nhiều ứng dụng quan trọng trong các lĩnh vực khác nhau.
- Sản xuất nhựa: Phenol là nguyên liệu quan trọng để sản xuất các loại nhựa như nhựa phenol-formaldehyd (bakelite), được sử dụng rộng rãi trong sản xuất vật liệu cách điện, đồ gia dụng, và các sản phẩm công nghiệp.
- Sản xuất dược phẩm: Phenol được sử dụng trong tổng hợp nhiều loại thuốc, bao gồm thuốc giảm đau, thuốc kháng viêm, và thuốc sát trùng.
- Sản xuất thuốc diệt cỏ và thuốc trừ sâu: Phenol là thành phần trong một số loại thuốc diệt cỏ và thuốc trừ sâu.
Alt: Hình ảnh minh họa ứng dụng của phenol (C6H5OH) trong sản xuất thuốc diệt cỏ, giúp bảo vệ mùa màng và tăng năng suất nông nghiệp.
- Sản xuất chất khử trùng và chất tẩy rửa: Phenol có tính sát trùng, do đó được sử dụng trong các sản phẩm khử trùng và tẩy rửa.
- Sản xuất phẩm nhuộm: Phenol là nguyên liệu để sản xuất một số phẩm nhuộm.
- Sản xuất chất nổ: Axit picric (2,4,6-trinitrophenol), một dẫn xuất của phenol, là một chất nổ mạnh.
- Trong y học: Phenol được sử dụng làm chất bảo quản vaccine và thuốc tiêm.
- Trong công nghiệp tơ sợi: Phenol được sử dụng để tổng hợp tơ polyamide.
5. Cảnh Giác Với Độc Tính Của Phenol Và Biện Pháp An Toàn
Mặc dù có nhiều ứng dụng hữu ích, phenol là một chất độc hại và cần được sử dụng và bảo quản cẩn thận.
5.1. Mức Độ Độc Hại Của Phenol:
- Phenol có thể gây kích ứng da, mắt và hệ hô hấp. Tiếp xúc với phenol có thể gây bỏng da, tổn thương mắt và khó thở.
- Phenol có thể hấp thụ qua da và gây ngộ độc toàn thân.
- Ngộ độc phenol có thể gây tổn thương gan, thận và hệ thần kinh.
- Liều gây chết người của phenol là khoảng 10 gram. Theo nghiên cứu của Tổ chức Y tế Thế giới (WHO) năm 2018, tiếp xúc lâu dài với nồng độ phenol thấp có thể gây ra các vấn đề sức khỏe mãn tính.
5.2. Biện Pháp Phòng Ngừa Và An Toàn Khi Sử Dụng Phenol:
- Sử dụng đồ bảo hộ cá nhân (PPE) như găng tay, kính bảo hộ và áo choàng khi làm việc với phenol.
- Làm việc trong khu vực thông gió tốt.
- Tránh tiếp xúc trực tiếp với da và mắt.
- Không hít phải hơi phenol.
- Bảo quản phenol trong容器 kín, ở nơi khô ráo, thoáng mát và tránh xa tầm tay trẻ em.
Alt: Hình ảnh minh họa biện pháp sơ cứu khi bị phenol (C6H5OH) bắn vào mắt hoặc da: rửa ngay lập tức bằng nước sạch trong ít nhất 15 phút và đến cơ sở y tế gần nhất để được điều trị kịp thời.
- Trong trường hợp phenol tiếp xúc với da hoặc mắt, rửa ngay lập tức bằng nhiều nước trong ít nhất 15 phút và tìm kiếm sự chăm sóc y tế.
- Trong trường hợp hít phải hơi phenol, di chuyển nạn nhân đến nơi thoáng khí và tìm kiếm sự chăm sóc y tế.
6. Vì Sao Nên Tìm Hiểu Về Phenol Tại tic.edu.vn?
Bạn đang gặp khó khăn trong việc tìm kiếm tài liệu học tập chất lượng và đáng tin cậy về phenol? Bạn mất thời gian tổng hợp thông tin từ nhiều nguồn khác nhau? Bạn mong muốn có một công cụ hỗ trợ học tập hiệu quả và kết nối với cộng đồng học tập để trao đổi kiến thức? tic.edu.vn chính là giải pháp hoàn hảo cho bạn!
- Nguồn tài liệu đa dạng và đầy đủ: tic.edu.vn cung cấp nguồn tài liệu học tập phong phú, bao gồm lý thuyết, bài tập, ví dụ minh họa và các ứng dụng thực tế của phenol.
- Thông tin được kiểm duyệt và cập nhật: Tất cả thông tin trên tic.edu.vn đều được đội ngũ chuyên gia kiểm duyệt kỹ lưỡng, đảm bảo tính chính xác và cập nhật.
- Công cụ hỗ trợ học tập hiệu quả: tic.edu.vn cung cấp các công cụ hỗ trợ học tập trực tuyến như công cụ ghi chú, công cụ quản lý thời gian, giúp bạn học tập hiệu quả hơn.
- Cộng đồng học tập sôi nổi: tic.edu.vn xây dựng cộng đồng học tập trực tuyến, nơi bạn có thể trao đổi kiến thức, kinh nghiệm và học hỏi lẫn nhau.
7. Ý Định Tìm Kiếm Của Người Dùng Về Phenol
Dưới đây là 5 ý định tìm kiếm phổ biến của người dùng khi tìm kiếm về phenol:
- Định nghĩa và khái niệm: Người dùng muốn hiểu rõ phenol là gì, công thức cấu tạo và các đặc điểm cơ bản của nó.
- Tính chất lý hóa: Người dùng muốn tìm hiểu về các tính chất vật lý (trạng thái, màu sắc, mùi, độ tan, điểm nóng chảy, điểm sôi) và tính chất hóa học (khả năng phản ứng với các chất khác) của phenol.
- Ứng dụng: Người dùng muốn biết phenol được ứng dụng trong những lĩnh vực nào của đời sống và công nghiệp.
- Điều chế: Người dùng muốn tìm hiểu các phương pháp điều chế phenol trong phòng thí nghiệm và trong công nghiệp.
- Độc tính và an toàn: Người dùng quan tâm đến độc tính của phenol và các biện pháp an toàn khi sử dụng và bảo quản phenol.
tic.edu.vn luôn nỗ lực cung cấp thông tin đầy đủ và chính xác, đáp ứng mọi ý định tìm kiếm của người dùng về phenol và các chủ đề liên quan đến hóa học.
8. Câu Hỏi Thường Gặp Về Phenol (FAQ)
Dưới đây là một số câu hỏi thường gặp về phenol, cùng với câu trả lời chi tiết:
- Phenol có độc không?
- Có, phenol là một chất độc hại. Tiếp xúc với phenol có thể gây kích ứng da, mắt và hệ hô hấp, và có thể gây ngộ độc toàn thân nếu hấp thụ qua da hoặc hít phải.
- Phenol được sử dụng để làm gì?
- Phenol có nhiều ứng dụng, bao gồm sản xuất nhựa, dược phẩm, thuốc diệt cỏ, chất khử trùng và phẩm nhuộm.
- Làm thế nào để nhận biết phenol?
- Phenol có thể được nhận biết bằng mùi đặc trưng của nó và bằng phản ứng với nước brom (tạo kết tủa trắng) hoặc với dung dịch FeCl3 (tạo dung dịch màu tím).
- Phenol có tan trong nước không?
- Phenol ít tan trong nước lạnh, nhưng tan tốt trong các dung môi hữu cơ như ethanol và ether.
- Phenol có ăn mòn không?
- Phenol có tính ăn mòn và có thể gây bỏng da nếu tiếp xúc trực tiếp.
- Điều gì xảy ra nếu hít phải hơi phenol?
- Hít phải hơi phenol có thể gây kích ứng hệ hô hấp, khó thở và ngộ độc. Cần di chuyển nạn nhân đến nơi thoáng khí và tìm kiếm sự chăm sóc y tế.
- Làm thế nào để xử lý phenol bị đổ?
- Sử dụng đồ bảo hộ cá nhân, hấp thụ phenol bị đổ bằng vật liệu trơ như cát hoặc đất, và xử lý theo quy định về chất thải nguy hại.
- Phenol có gây ô nhiễm môi trường không?
- Có, phenol là một chất ô nhiễm môi trường và cần được xử lý đúng cách để tránh gây hại cho môi trường.
- Tôi có thể tìm thêm thông tin về phenol ở đâu?
- Bạn có thể tìm thêm thông tin về phenol trên tic.edu.vn, sách giáo khoa hóa học, các trang web khoa học uy tín và các tài liệu tham khảo chuyên ngành.
- tic.edu.vn có những tài liệu gì về phenol?
- tic.edu.vn cung cấp đa dạng tài liệu về phenol, bao gồm lý thuyết, bài tập, ví dụ minh họa, ứng dụng thực tế và các bài viết chuyên sâu về các khía cạnh khác nhau của phenol.
9. Kết Luận
Hy vọng bài viết này đã cung cấp cho bạn những thông tin hữu ích về phenol, trả lời câu hỏi “Phenol có làm đổi màu quỳ tím không?” và giúp bạn hiểu rõ hơn về tính chất, ứng dụng và độc tính của phenol. Đừng quên truy cập tic.edu.vn để khám phá thêm nhiều tài liệu học tập phong phú và các công cụ hỗ trợ hiệu quả khác. Chúc bạn học tập tốt!
Bạn còn chần chừ gì nữa? Hãy truy cập tic.edu.vn ngay hôm nay để khám phá nguồn tài liệu học tập phong phú và các công cụ hỗ trợ hiệu quả, giúp bạn chinh phục kiến thức và đạt được thành công trong học tập! Email: [email protected]. Trang web: tic.edu.vn.