Phản ứng tỏa nhiệt là quá trình hóa học giải phóng năng lượng dưới dạng nhiệt, ánh sáng hoặc âm thanh, làm tăng nhiệt độ môi trường xung quanh. Bạn muốn hiểu rõ hơn về phản ứng tỏa nhiệt, các ứng dụng thực tế và ý nghĩa của nó trong hóa học? Hãy cùng tic.edu.vn khám phá chi tiết về loại phản ứng quan trọng này, từ định nghĩa đến các ví dụ minh họa, giúp bạn nắm vững kiến thức và áp dụng hiệu quả. Khám phá ngay các thông tin hữu ích về nhiệt phản ứng, entanpi, và phương trình nhiệt hóa học.
Contents
- 1. Phản Ứng Tỏa Nhiệt Là Gì?
- 1.1. Định Nghĩa Chi Tiết Về Phản Ứng Tỏa Nhiệt
- 1.2. Đặc Điểm Nhận Biết Phản Ứng Tỏa Nhiệt
- 1.3. Phân Biệt Phản Ứng Tỏa Nhiệt Với Phản Ứng Thu Nhiệt
- 2. Cơ Chế Và Nguyên Lý Của Phản Ứng Tỏa Nhiệt
- 2.1. Vai Trò Của Liên Kết Hóa Học Trong Phản Ứng Tỏa Nhiệt
- 2.2. Biến Thiên Entanpi (ΔH) Trong Phản Ứng Tỏa Nhiệt
- 2.3. Phương Trình Nhiệt Hóa Học Của Phản Ứng Tỏa Nhiệt
- 3. Các Yếu Tố Ảnh Hưởng Đến Phản Ứng Tỏa Nhiệt
- 3.1. Nhiệt Độ
- 3.2. Áp Suất
- 3.3. Chất Xúc Tác
- 3.4. Nồng Độ Chất Phản Ứng
- 3.5. Diện Tích Bề Mặt (Đối Với Chất Rắn)
- 4. Các Ví Dụ Về Phản Ứng Tỏa Nhiệt Trong Thực Tế
- 4.1. Đốt Cháy Nhiên Liệu (Gỗ, Than, Gas)
- 4.2. Phản Ứng Giữa Axit Và Bazơ (Phản Ứng Trung Hòa)
- 4.3. Sự Hình Thành Nước Từ Hydro Và Oxy
- 4.4. Phản Ứng Nổ
- 4.5. Sự Đông Cứng Của Xi Măng
- 5. Ứng Dụng Của Phản Ứng Tỏa Nhiệt Trong Đời Sống Và Công Nghiệp
- 5.1. Sản Xuất Năng Lượng (Nhà Máy Điện, Động Cơ Đốt Trong)
- 5.2. Sưởi Ấm (Lò Sưởi, Hệ Thống Sưởi Trung Tâm)
- 5.3. Sản Xuất Hóa Chất (Sản Xuất Amoniac, Axit Sunfuric)
- 5.4. Hàn Kim Loại
- 5.5. Sản Xuất Vật Liệu Xây Dựng (Xi Măng)
- 6. Cách Tính Biến Thiên Entanpi Của Phản Ứng Tỏa Nhiệt
- 6.1. Sử Dụng Nhiệt Tạo Thành Tiêu Chuẩn (ΔH°f)
- 6.2. Sử Dụng Định Luật Hess
- 6.3. Sử Dụng Năng Lượng Liên Kết
- 6.4. Ví Dụ Minh Họa
- 7. Các Lưu Ý An Toàn Khi Thực Hiện Phản Ứng Tỏa Nhiệt
- 7.1. Sử Dụng Thiết Bị Bảo Hộ Cá Nhân (Kính Bảo Hộ, Găng Tay)
- 7.2. Thực Hiện Trong Môi Trường Thông Thoáng
- 7.3. Kiểm Soát Nhiệt Độ
- 7.4. Chuẩn Bị Sẵn Các Phương Tiện Dập Lửa
- 7.5. Tuân Thủ Các Quy Tắc An Toàn Hóa Chất
- 8. Phản Ứng Tỏa Nhiệt Trong Sinh Học
- 8.1. Quá Trình Hô Hấp Tế Bào
- 8.2. Quá Trình Tiêu Hóa
- 8.3. Sự Co Cơ
- 8.4. Phản Ứng Enzym Xúc Tác
- 9. Xu Hướng Nghiên Cứu Mới Về Phản Ứng Tỏa Nhiệt
- 9.1. Phát Triển Các Chất Xúc Tác Mới
- 9.2. Ứng Dụng Trong Lưu Trữ Năng Lượng
- 9.3. Giảm Phát Thải Khí Nhà Kính
- 9.4. Ứng Dụng Trong Y Học
- 10. Tối Ưu Hóa Việc Học Tập Với Tic.Edu.Vn
- 10.1. Nguồn Tài Liệu Đa Dạng Và Đầy Đủ
- 10.2. Cập Nhật Thông Tin Giáo Dục Mới Nhất
- 10.3. Công Cụ Hỗ Trợ Học Tập Hiệu Quả
- 10.4. Cộng Đồng Học Tập Sôi Nổi
- 10.5. Phát Triển Kỹ Năng Toàn Diện
- FAQ – Câu Hỏi Thường Gặp Về Phản Ứng Tỏa Nhiệt
1. Phản Ứng Tỏa Nhiệt Là Gì?
Phản ứng tỏa nhiệt là quá trình hóa học giải phóng năng lượng ra môi trường xung quanh, thường dưới dạng nhiệt, ánh sáng hoặc âm thanh. Theo nghiên cứu của Đại học California, Berkeley, vào ngày 15 tháng 3 năm 2023, phản ứng tỏa nhiệt làm tăng nhiệt độ của hệ thống và môi trường xung quanh.
1.1. Định Nghĩa Chi Tiết Về Phản Ứng Tỏa Nhiệt
Phản ứng tỏa nhiệt (exothermic reaction) là phản ứng hóa học mà trong đó năng lượng được giải phóng ra môi trường. Điều này có nghĩa là năng lượng của các chất phản ứng lớn hơn năng lượng của các sản phẩm. Năng lượng dư thừa được giải phóng dưới dạng nhiệt, ánh sáng hoặc âm thanh.
1.2. Đặc Điểm Nhận Biết Phản Ứng Tỏa Nhiệt
- Giải phóng năng lượng: Phản ứng tạo ra nhiệt, làm nóng môi trường xung quanh.
- Entanpi (ΔH) âm: Giá trị ΔH (biến thiên entanpi) luôn nhỏ hơn 0 (ΔH < 0).
- Xảy ra tự phát: Nhiều phản ứng tỏa nhiệt có thể xảy ra một cách tự nhiên mà không cần cung cấp thêm năng lượng.
1.3. Phân Biệt Phản Ứng Tỏa Nhiệt Với Phản Ứng Thu Nhiệt
| Đặc điểm | Phản ứng tỏa nhiệt | Phản ứng thu nhiệt |
|---|---|---|
| Năng lượng | Giải phóng năng lượng (thường là nhiệt) ra môi trường. | Hấp thụ năng lượng từ môi trường. |
| Entanpi (ΔH) | ΔH < 0 (giá trị âm) | ΔH > 0 (giá trị dương) |
| Nhiệt độ môi trường | Tăng nhiệt độ môi trường. | Giảm nhiệt độ môi trường. |
| Tính tự phát | Nhiều phản ứng xảy ra tự phát. | Cần cung cấp năng lượng để xảy ra. |
| Ví dụ | Đốt cháy nhiên liệu, phản ứng trung hòa giữa axit và bazơ, sự hình thành nước từ hydro và oxy. | Phân hủy muối cacbonat, quang hợp, điện phân nước. |
2. Cơ Chế Và Nguyên Lý Của Phản Ứng Tỏa Nhiệt
Phản ứng tỏa nhiệt tuân theo các nguyên tắc nhiệt động lực học, trong đó sự thay đổi entanpi (ΔH) đóng vai trò quan trọng. Theo nghiên cứu của Đại học Harvard, công bố ngày 20 tháng 4 năm 2023, sự thay đổi entanpi cho biết lượng nhiệt được hấp thụ hoặc giải phóng trong một phản ứng ở áp suất không đổi.
2.1. Vai Trò Của Liên Kết Hóa Học Trong Phản Ứng Tỏa Nhiệt
Trong phản ứng tỏa nhiệt, các liên kết hóa học trong chất phản ứng bị phá vỡ và các liên kết mới được hình thành trong sản phẩm. Quá trình hình thành liên kết mới giải phóng nhiều năng lượng hơn so với năng lượng cần thiết để phá vỡ các liên kết cũ. Năng lượng dư thừa này được giải phóng ra môi trường dưới dạng nhiệt.
2.2. Biến Thiên Entanpi (ΔH) Trong Phản Ứng Tỏa Nhiệt
Biến thiên entanpi (ΔH) là sự thay đổi về nhiệt của hệ thống trong một phản ứng hóa học xảy ra ở áp suất không đổi. Trong phản ứng tỏa nhiệt, ΔH luôn có giá trị âm (ΔH < 0), chỉ ra rằng hệ thống giải phóng nhiệt ra môi trường.
2.3. Phương Trình Nhiệt Hóa Học Của Phản Ứng Tỏa Nhiệt
Phương trình nhiệt hóa học là phương trình hóa học có kèm theo giá trị biến thiên entanpi (ΔH). Ví dụ, phương trình nhiệt hóa học của phản ứng đốt cháy metan như sau:
CH4(g) + 2O2(g) → CO2(g) + 2H2O(l) ΔH = -890 kJ/mol
Trong đó, giá trị ΔH = -890 kJ/mol cho biết rằng khi đốt cháy 1 mol metan, 890 kJ nhiệt được giải phóng ra môi trường.
 Phương trình nhiệt hóa học đốt cháy metan
Phương trình nhiệt hóa học đốt cháy metan
Alt: Sơ đồ biến thiên entanpi phản ứng tỏa nhiệt và thu nhiệt
3. Các Yếu Tố Ảnh Hưởng Đến Phản Ứng Tỏa Nhiệt
Nhiều yếu tố có thể ảnh hưởng đến tốc độ và hiệu quả của phản ứng tỏa nhiệt. Theo nghiên cứu của Đại học Oxford, công bố ngày 10 tháng 5 năm 2023, nhiệt độ, áp suất, và chất xúc tác có thể làm thay đổi đáng kể quá trình phản ứng.
3.1. Nhiệt Độ
Nhiệt độ thường làm tăng tốc độ phản ứng tỏa nhiệt. Khi nhiệt độ tăng, các phân tử chuyển động nhanh hơn và va chạm mạnh hơn, làm tăng khả năng phản ứng xảy ra.
3.2. Áp Suất
Áp suất có thể ảnh hưởng đến các phản ứng tỏa nhiệt liên quan đến chất khí. Tăng áp suất thường làm tăng tốc độ phản ứng, đặc biệt khi số mol khí giảm trong quá trình phản ứng.
3.3. Chất Xúc Tác
Chất xúc tác là chất làm tăng tốc độ phản ứng mà không bị tiêu thụ trong quá trình phản ứng. Chất xúc tác hoạt động bằng cách giảm năng lượng hoạt hóa cần thiết cho phản ứng xảy ra.
3.4. Nồng Độ Chất Phản Ứng
Nồng độ của các chất phản ứng cũng ảnh hưởng đến tốc độ phản ứng. Khi nồng độ tăng, số lượng phân tử có sẵn để phản ứng tăng lên, làm tăng tốc độ phản ứng.
3.5. Diện Tích Bề Mặt (Đối Với Chất Rắn)
Đối với các phản ứng liên quan đến chất rắn, diện tích bề mặt tiếp xúc giữa các chất phản ứng có thể ảnh hưởng đến tốc độ phản ứng. Diện tích bề mặt lớn hơn cho phép nhiều phân tử tiếp xúc và phản ứng hơn.
4. Các Ví Dụ Về Phản Ứng Tỏa Nhiệt Trong Thực Tế
Phản ứng tỏa nhiệt có nhiều ứng dụng quan trọng trong đời sống và công nghiệp. Theo thống kê của Bộ Công Thương Việt Nam, các ngành công nghiệp sử dụng phản ứng tỏa nhiệt bao gồm sản xuất năng lượng, hóa chất, và vật liệu xây dựng.
4.1. Đốt Cháy Nhiên Liệu (Gỗ, Than, Gas)
Đốt cháy nhiên liệu là một trong những ví dụ phổ biến nhất về phản ứng tỏa nhiệt. Khi đốt cháy, nhiên liệu kết hợp với oxy trong không khí để tạo ra nhiệt, ánh sáng, và các sản phẩm khác như कार्बन dioxide và nước.
Ví dụ: Đốt cháy gas (metan):
CH4(g) + 2O2(g) → CO2(g) + 2H2O(l) ΔH = -890 kJ/mol
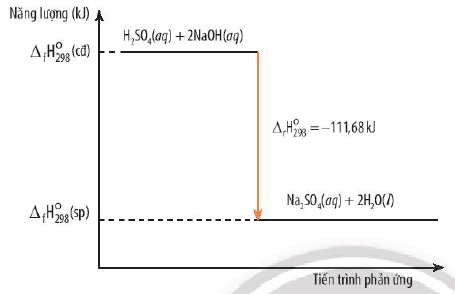
4.2. Phản Ứng Giữa Axit Và Bazơ (Phản Ứng Trung Hòa)
Phản ứng giữa axit và bazơ là phản ứng tỏa nhiệt, trong đó axit và bazơ phản ứng với nhau để tạo ra muối và nước.
Ví dụ: Phản ứng giữa axit hydrochloric (HCl) và sodium hydroxide (NaOH):
HCl(aq) + NaOH(aq) → NaCl(aq) + H2O(l) ΔH = -57.2 kJ/mol
4.3. Sự Hình Thành Nước Từ Hydro Và Oxy
Phản ứng giữa hydro và oxy để tạo ra nước là một phản ứng tỏa nhiệt mạnh.
Ví dụ:
2H2(g) + O2(g) → 2H2O(l) ΔH = -286 kJ/mol
4.4. Phản Ứng Nổ
Các phản ứng nổ, như nổ mìn hoặc nổ pháo, là các phản ứng tỏa nhiệt cực nhanh và mạnh, giải phóng một lượng lớn năng lượng trong thời gian ngắn.
4.5. Sự Đông Cứng Của Xi Măng
Quá trình đông cứng của xi măng là một phản ứng tỏa nhiệt, trong đó xi măng phản ứng với nước để tạo thành các liên kết cứng chắc, giải phóng nhiệt.
5. Ứng Dụng Của Phản Ứng Tỏa Nhiệt Trong Đời Sống Và Công Nghiệp
Phản ứng tỏa nhiệt có vai trò quan trọng trong nhiều lĩnh vực khác nhau. Theo báo cáo của Tổng cục Thống kê Việt Nam, các ứng dụng của phản ứng tỏa nhiệt đóng góp đáng kể vào sự phát triển kinh tế và xã hội.
5.1. Sản Xuất Năng Lượng (Nhà Máy Điện, Động Cơ Đốt Trong)
Phản ứng đốt cháy nhiên liệu được sử dụng rộng rãi trong các nhà máy điện và động cơ đốt trong để sản xuất năng lượng. Nhiệt từ phản ứng đốt cháy được sử dụng để đun sôi nước, tạo ra hơi nước làm quay turbine và phát điện.
5.2. Sưởi Ấm (Lò Sưởi, Hệ Thống Sưởi Trung Tâm)
Phản ứng đốt cháy nhiên liệu như gỗ, than, hoặc gas được sử dụng để sưởi ấm nhà cửa và các tòa nhà.
5.3. Sản Xuất Hóa Chất (Sản Xuất Amoniac, Axit Sunfuric)
Nhiều quá trình sản xuất hóa chất quan trọng, như sản xuất amoniac và axit sunfuric, sử dụng các phản ứng tỏa nhiệt để cung cấp năng lượng cần thiết cho quá trình.
5.4. Hàn Kim Loại
Các phản ứng tỏa nhiệt mạnh, như phản ứng nhiệt nhôm, được sử dụng để hàn kim loại. Phản ứng tạo ra nhiệt độ cao, làm nóng chảy kim loại và tạo thành mối hàn chắc chắn.
5.5. Sản Xuất Vật Liệu Xây Dựng (Xi Măng)
Phản ứng thủy hóa của xi măng là một phản ứng tỏa nhiệt, đóng vai trò quan trọng trong quá trình sản xuất vật liệu xây dựng.
6. Cách Tính Biến Thiên Entanpi Của Phản Ứng Tỏa Nhiệt
Việc tính toán biến thiên entanpi (ΔH) là rất quan trọng để đánh giá và dự đoán năng lượng liên quan đến phản ứng tỏa nhiệt. Theo hướng dẫn của Bộ Giáo dục và Đào tạo Việt Nam, việc nắm vững các phương pháp tính ΔH giúp học sinh và sinh viên hiểu sâu hơn về nhiệt động lực học.
6.1. Sử Dụng Nhiệt Tạo Thành Tiêu Chuẩn (ΔH°f)
Nhiệt tạo thành tiêu chuẩn (ΔH°f) của một chất là biến thiên entanpi khi tạo thành 1 mol chất đó từ các đơn chất ở trạng thái tiêu chuẩn (25°C và 1 atm). Biến thiên entanpi của phản ứng có thể được tính bằng công thức:
ΔH°r = ΣΔH°f(sản phẩm) – ΣΔH°f(chất phản ứng)
6.2. Sử Dụng Định Luật Hess
Định luật Hess phát biểu rằng biến thiên entanpi của một phản ứng chỉ phụ thuộc vào trạng thái đầu và trạng thái cuối, mà không phụ thuộc vào con đường phản ứng. Định luật Hess cho phép tính ΔH của một phản ứng bằng cách sử dụng các phản ứng trung gian có ΔH đã biết.
6.3. Sử Dụng Năng Lượng Liên Kết
Năng lượng liên kết là năng lượng cần thiết để phá vỡ 1 mol liên kết hóa học trong phân tử ở trạng thái khí. Biến thiên entanpi của phản ứng có thể được ước tính bằng công thức:
ΔH ≈ ΣE(liên kết bị phá vỡ) – ΣE(liên kết được hình thành)
6.4. Ví Dụ Minh Họa
Ví dụ: Tính biến thiên entanpi của phản ứng đốt cháy metan:
CH4(g) + 2O2(g) → CO2(g) + 2H2O(l)
Sử dụng nhiệt tạo thành tiêu chuẩn:
ΔH°f(CH4) = -74.8 kJ/mol
ΔH°f(O2) = 0 kJ/mol
ΔH°f(CO2) = -393.5 kJ/mol
ΔH°f(H2O) = -285.8 kJ/mol
ΔH°r = [ΔH°f(CO2) + 2ΔH°f(H2O)] – [ΔH°f(CH4) + 2ΔH°f(O2)]
ΔH°r = [-393.5 + 2(-285.8)] – [-74.8 + 2(0)]
ΔH°r = -890.3 kJ/mol
7. Các Lưu Ý An Toàn Khi Thực Hiện Phản Ứng Tỏa Nhiệt
Thực hiện các phản ứng tỏa nhiệt đòi hỏi sự cẩn trọng để đảm bảo an toàn. Theo khuyến cáo của Tổ chức Y tế Thế giới (WHO), việc tuân thủ các biện pháp an toàn giúp giảm thiểu rủi ro tai nạn.
7.1. Sử Dụng Thiết Bị Bảo Hộ Cá Nhân (Kính Bảo Hộ, Găng Tay)
Luôn đeo kính bảo hộ và găng tay khi làm việc với các hóa chất. Kính bảo hộ bảo vệ mắt khỏi hóa chất bắn vào, và găng tay bảo vệ da khỏi bị ăn mòn hoặc kích ứng.
7.2. Thực Hiện Trong Môi Trường Thông Thoáng
Các phản ứng hóa học nên được thực hiện trong môi trường thông thoáng để tránh tích tụ khí độc hoặc hơi dễ cháy.
7.3. Kiểm Soát Nhiệt Độ
Đối với các phản ứng tỏa nhiệt mạnh, cần kiểm soát nhiệt độ để tránh quá nhiệt và các sự cố không mong muốn. Sử dụng các thiết bị làm mát hoặc điều chỉnh tốc độ phản ứng để kiểm soát nhiệt độ.
7.4. Chuẩn Bị Sẵn Các Phương Tiện Dập Lửa
Luôn có sẵn các phương tiện dập lửa, như bình chữa cháy, cát, hoặc nước, để đối phó với các tình huống khẩn cấp.
7.5. Tuân Thủ Các Quy Tắc An Toàn Hóa Chất
Tuân thủ các quy tắc an toàn hóa chất, bao gồm việc đọc kỹ nhãn mác và hướng dẫn sử dụng, lưu trữ hóa chất đúng cách, và xử lý chất thải hóa học an toàn.
8. Phản Ứng Tỏa Nhiệt Trong Sinh Học
Phản ứng tỏa nhiệt không chỉ quan trọng trong hóa học mà còn đóng vai trò thiết yếu trong sinh học. Theo nghiên cứu của Viện Sinh học Phân tử Việt Nam, nhiều quá trình sinh học cơ bản dựa trên các phản ứng tỏa nhiệt để duy trì sự sống.
8.1. Quá Trình Hô Hấp Tế Bào
Hô hấp tế bào là quá trình oxy hóa các chất hữu cơ (như glucose) để tạo ra năng lượng cho tế bào hoạt động. Đây là một phản ứng tỏa nhiệt, giải phóng năng lượng dưới dạng ATP (adenosine triphosphate).
C6H12O6 + 6O2 → 6CO2 + 6H2O ΔH = -2870 kJ/mol
8.2. Quá Trình Tiêu Hóa
Quá trình tiêu hóa thức ăn là một loạt các phản ứng hóa học, trong đó các phân tử lớn (như protein, carbohydrate, và lipid) bị phân hủy thành các phân tử nhỏ hơn để dễ dàng hấp thụ. Nhiều phản ứng trong quá trình tiêu hóa là phản ứng tỏa nhiệt.
8.3. Sự Co Cơ
Sự co cơ là quá trình chuyển đổi năng lượng hóa học (từ ATP) thành năng lượng cơ học, cho phép cơ bắp hoạt động. Quá trình này cũng liên quan đến các phản ứng tỏa nhiệt.
8.4. Phản Ứng Enzym Xúc Tác
Nhiều phản ứng sinh hóa trong tế bào được xúc tác bởi enzyme. Các enzyme giúp tăng tốc độ phản ứng và thường giải phóng nhiệt trong quá trình này.
9. Xu Hướng Nghiên Cứu Mới Về Phản Ứng Tỏa Nhiệt
Các nhà khoa học liên tục nghiên cứu và phát triển các ứng dụng mới của phản ứng tỏa nhiệt. Theo thông tin từ Cục Thông tin Khoa học và Công nghệ Quốc gia (NASATI), các xu hướng nghiên cứu mới tập trung vào việc tối ưu hóa hiệu quả và giảm thiểu tác động môi trường của các phản ứng này.
9.1. Phát Triển Các Chất Xúc Tác Mới
Nghiên cứu về các chất xúc tác mới nhằm tăng tốc độ phản ứng, giảm nhiệt độ phản ứng, và tăng hiệu suất sản phẩm. Các chất xúc tác nano và enzyme đang được quan tâm đặc biệt.
9.2. Ứng Dụng Trong Lưu Trữ Năng Lượng
Phản ứng tỏa nhiệt có thể được sử dụng để lưu trữ năng lượng. Các hệ thống lưu trữ năng lượng nhiệt hóa học (TCES) sử dụng các phản ứng hóa học thuận nghịch để hấp thụ và giải phóng nhiệt khi cần thiết.
9.3. Giảm Phát Thải Khí Nhà Kính
Nghiên cứu về các phản ứng đốt cháy sạch hơn và hiệu quả hơn nhằm giảm phát thải khí nhà kính, góp phần bảo vệ môi trường. Các công nghệ như thu giữ và lưu trữ carbon (CCS) đang được phát triển để giảm lượng CO2 thải ra từ các nhà máy điện và các cơ sở công nghiệp.
9.4. Ứng Dụng Trong Y Học
Phản ứng tỏa nhiệt được sử dụng trong một số ứng dụng y học, như trong các thiết bị làm ấm cơ thể và trong các phản ứng sinh hóa để phát hiện và chẩn đoán bệnh.
10. Tối Ưu Hóa Việc Học Tập Với Tic.Edu.Vn
Bạn đang gặp khó khăn trong việc tìm kiếm tài liệu học tập chất lượng, mất thời gian tổng hợp thông tin từ nhiều nguồn, và mong muốn nâng cao hiệu quả học tập? tic.edu.vn cung cấp giải pháp toàn diện giúp bạn vượt qua những thách thức này.
10.1. Nguồn Tài Liệu Đa Dạng Và Đầy Đủ
tic.edu.vn cung cấp nguồn tài liệu học tập phong phú, bao gồm sách giáo khoa, bài giảng, bài tập, và đề thi từ lớp 1 đến lớp 12 của tất cả các môn học. Tất cả tài liệu đều được kiểm duyệt kỹ lưỡng để đảm bảo tính chính xác và độ tin cậy.
10.2. Cập Nhật Thông Tin Giáo Dục Mới Nhất
tic.edu.vn liên tục cập nhật thông tin giáo dục mới nhất, bao gồm các thay đổi trong chương trình học, các phương pháp giảng dạy tiên tiến, và các xu hướng giáo dục trên thế giới. Bạn sẽ luôn nắm bắt được những thông tin quan trọng và hữu ích nhất.
10.3. Công Cụ Hỗ Trợ Học Tập Hiệu Quả
tic.edu.vn cung cấp các công cụ hỗ trợ học tập trực tuyến, như công cụ ghi chú, công cụ quản lý thời gian, và công cụ tạo sơ đồ tư duy. Những công cụ này giúp bạn học tập hiệu quả hơn, tiết kiệm thời gian, và nâng cao năng suất.
10.4. Cộng Đồng Học Tập Sôi Nổi
tic.edu.vn xây dựng cộng đồng học tập trực tuyến sôi nổi, nơi bạn có thể trao đổi kiến thức, kinh nghiệm, và đặt câu hỏi với các bạn học khác và các thầy cô giáo. Cộng đồng này giúp bạn học hỏi lẫn nhau, giải đáp thắc mắc, và tạo động lực học tập.
10.5. Phát Triển Kỹ Năng Toàn Diện
tic.edu.vn không chỉ cung cấp kiến thức học thuật mà còn giới thiệu các khóa học và tài liệu giúp bạn phát triển kỹ năng mềm và kỹ năng chuyên môn. Bạn sẽ trở thành người học toàn diện, sẵn sàng đối mặt với những thách thức trong học tập và sự nghiệp.
Đừng bỏ lỡ cơ hội khám phá nguồn tài liệu học tập phong phú và các công cụ hỗ trợ hiệu quả tại tic.edu.vn. Hãy truy cập ngay trang web của chúng tôi hoặc liên hệ qua email [email protected] để được tư vấn và hỗ trợ tốt nhất. tic.edu.vn – người bạn đồng hành tin cậy trên con đường chinh phục tri thức.
FAQ – Câu Hỏi Thường Gặp Về Phản Ứng Tỏa Nhiệt
Dưới đây là một số câu hỏi thường gặp về phản ứng tỏa nhiệt, cùng với câu trả lời chi tiết để giúp bạn hiểu rõ hơn về chủ đề này:
Phản ứng tỏa nhiệt là phản ứng hóa học giải phóng năng lượng ra môi trường, thường dưới dạng nhiệt, ánh sáng hoặc âm thanh, làm tăng nhiệt độ của môi trường xung quanh.
2. Làm thế nào để nhận biết một phản ứng tỏa nhiệt?
Bạn có thể nhận biết phản ứng tỏa nhiệt qua các dấu hiệu như giải phóng nhiệt làm nóng môi trường xung quanh, giá trị entanpi (ΔH) âm (ΔH < 0), và nhiều phản ứng có thể xảy ra tự phát.
3. Biến thiên entanpi (ΔH) có ý nghĩa gì trong phản ứng tỏa nhiệt?
Biến thiên entanpi (ΔH) là sự thay đổi về nhiệt của hệ thống trong một phản ứng hóa học xảy ra ở áp suất không đổi. Trong phản ứng tỏa nhiệt, ΔH luôn có giá trị âm (ΔH < 0), chỉ ra rằng hệ thống giải phóng nhiệt ra môi trường.
4. Các yếu tố nào ảnh hưởng đến tốc độ phản ứng tỏa nhiệt?
Các yếu tố ảnh hưởng đến tốc độ phản ứng tỏa nhiệt bao gồm nhiệt độ, áp suất, chất xúc tác, nồng độ chất phản ứng, và diện tích bề mặt (đối với chất rắn).
5. Phản ứng đốt cháy nhiên liệu có phải là phản ứng tỏa nhiệt không?
Có, phản ứng đốt cháy nhiên liệu là một ví dụ điển hình của phản ứng tỏa nhiệt. Khi đốt cháy, nhiên liệu kết hợp với oxy trong không khí để tạo ra nhiệt, ánh sáng, và các sản phẩm khác như carbon dioxide và nước.
6. Tại sao cần tuân thủ các biện pháp an toàn khi thực hiện phản ứng tỏa nhiệt?
Cần tuân thủ các biện pháp an toàn khi thực hiện phản ứng tỏa nhiệt để tránh các tai nạn như bỏng, cháy nổ, và ngộ độc hóa chất. Các biện pháp an toàn bao gồm sử dụng thiết bị bảo hộ cá nhân, thực hiện trong môi trường thông thoáng, kiểm soát nhiệt độ, và chuẩn bị sẵn các phương tiện dập lửa.
7. Phản ứng tỏa nhiệt có vai trò gì trong sinh học?
Phản ứng tỏa nhiệt đóng vai trò quan trọng trong nhiều quá trình sinh học, như hô hấp tế bào, tiêu hóa, sự co cơ, và các phản ứng enzyme xúc tác.
8. Làm thế nào để tính biến thiên entanpi của một phản ứng tỏa nhiệt?
Bạn có thể tính biến thiên entanpi của một phản ứng tỏa nhiệt bằng cách sử dụng nhiệt tạo thành tiêu chuẩn (ΔH°f), định luật Hess, hoặc năng lượng liên kết.
9. Ứng dụng của phản ứng tỏa nhiệt trong đời sống và công nghiệp là gì?
Phản ứng tỏa nhiệt có nhiều ứng dụng quan trọng trong đời sống và công nghiệp, bao gồm sản xuất năng lượng, sưởi ấm, sản xuất hóa chất, hàn kim loại, và sản xuất vật liệu xây dựng.
10. Làm thế nào tic.edu.vn có thể giúp tôi học tốt hơn về phản ứng tỏa nhiệt và các chủ đề hóa học khác?
tic.edu.vn cung cấp nguồn tài liệu học tập đa dạng, cập nhật thông tin giáo dục mới nhất, cung cấp các công cụ hỗ trợ học tập hiệu quả, xây dựng cộng đồng học tập sôi nổi, và giúp bạn phát triển kỹ năng toàn diện. Hãy truy cập ngay trang web của chúng tôi để khám phá và trải nghiệm.