Phản ứng thu nhiệt là phản ứng hấp thụ năng lượng dưới dạng nhiệt từ môi trường xung quanh; tìm hiểu sâu hơn về loại phản ứng này, các ví dụ minh họa và ý nghĩa của nó trong hóa học, cùng tic.edu.vn khám phá nhé. Để hiểu rõ hơn, hãy cùng đi sâu vào định nghĩa, đặc điểm và các ví dụ cụ thể.
Contents
- 2. Định Nghĩa Phản Ứng Thu Nhiệt Là Gì?
- 2.1. Đặc Điểm Nhận Biết Phản Ứng Thu Nhiệt
- 2.2. Phân Biệt Phản Ứng Thu Nhiệt và Phản Ứng Tỏa Nhiệt
- 3. Cơ Chế và Nguyên Lý Của Phản Ứng Thu Nhiệt
- 3.1. Liên Kết Hóa Học và Năng Lượng
- 3.2. Biến Thiên Enthalpy (ΔH) và Ý Nghĩa
- 3.3. Ảnh Hưởng Của Nhiệt Độ Đến Phản Ứng Thu Nhiệt
- 4. Các Yếu Tố Ảnh Hưởng Đến Phản Ứng Thu Nhiệt
- 5. Các Ví Dụ Cụ Thể Về Phản Ứng Thu Nhiệt
- 5.1. Phản Ứng Phân Hủy Muối Amoni (NH₄Cl)
- 5.2. Phản Ứng Nung Đá Vôi (CaCO₃)
- 5.3. Phản Ứng Quang Hợp Ở Thực Vật
- 5.4. Phản Ứng Nhiệt Phân
- 5.5. Phản Ứng Bay Hơi và Nóng Chảy
- 6. Ứng Dụng Của Phản Ứng Thu Nhiệt Trong Thực Tiễn
- 6.1. Sản Xuất Phân Bón
- 6.2. Điều Chế Vật Liệu
- 6.3. Hệ Thống Làm Lạnh
- 6.4. Nghiên Cứu Khoa Học
- 7. Ảnh Hưởng Của Phản Ứng Thu Nhiệt Đến Môi Trường
- 7.1. Giảm Nhiệt Độ Môi Trường
- 7.2. Tiêu Thụ Năng Lượng
- 7.3. Tạo Ra Sản Phẩm Phụ
- 8. Các Biện Pháp Kiểm Soát và Tối Ưu Hóa Phản Ứng Thu Nhiệt
- 8.1. Điều Chỉnh Điều Kiện Phản Ứng
- 8.2. Sử Dụng Năng Lượng Tái Tạo
- 8.3. Xử Lý Sản Phẩm Phụ
- 8.4. Thiết Kế Hệ Thống An Toàn
- 9. Tổng Kết
- 10. Khám Phá Thế Giới Giáo Dục Tại Tic.edu.vn
- FAQ – Các Câu Hỏi Thường Gặp Về Phản Ứng Thu Nhiệt và Tic.edu.vn
- Câu 1: Làm thế nào để nhận biết một phản ứng là thu nhiệt?
- Câu 2: Tại sao phản ứng thu nhiệt cần năng lượng?
- Câu 3: Phản ứng thu nhiệt có ứng dụng gì trong đời sống?
- Câu 4: Tic.edu.vn có tài liệu nào về phản ứng thu nhiệt không?
- Câu 5: Làm thế nào để tìm kiếm tài liệu học tập trên tic.edu.vn?
- Câu 6: Tôi có thể đóng góp tài liệu học tập cho tic.edu.vn không?
- Câu 7: Tic.edu.vn có cộng đồng học tập trực tuyến không?
- Câu 8: Tic.edu.vn có hỗ trợ học tập trực tuyến không?
- Câu 9: Làm thế nào để liên hệ với tic.edu.vn nếu có thắc mắc?
- Câu 10: Tic.edu.vn có những ưu điểm gì so với các nguồn tài liệu khác?
2. Định Nghĩa Phản Ứng Thu Nhiệt Là Gì?
Phản ứng thu nhiệt là một quá trình hóa học mà trong đó hệ thống hấp thụ năng lượng từ môi trường xung quanh, thường là dưới dạng nhiệt. Quá trình này dẫn đến sự giảm nhiệt độ của môi trường xung quanh và làm tăng enthalpy của hệ thống.
2.1. Đặc Điểm Nhận Biết Phản Ứng Thu Nhiệt
- Hấp thụ nhiệt: Phản ứng thu nhiệt luôn đi kèm với việc hấp thụ nhiệt từ môi trường.
- Giảm nhiệt độ: Nhiệt độ của môi trường xung quanh giảm xuống trong quá trình phản ứng.
- Enthalpy tăng: Biến thiên enthalpy (ΔH) của phản ứng có giá trị dương (ΔH > 0), cho thấy năng lượng của hệ thống tăng lên.
- Không tự xảy ra: Phản ứng thu nhiệt thường không tự xảy ra mà cần cung cấp năng lượng từ bên ngoài để khởi động và duy trì.
2.2. Phân Biệt Phản Ứng Thu Nhiệt và Phản Ứng Tỏa Nhiệt
Để hiểu rõ hơn về phản ứng thu nhiệt, chúng ta cần so sánh nó với phản ứng tỏa nhiệt. Phản ứng tỏa nhiệt là quá trình giải phóng năng lượng dưới dạng nhiệt, làm tăng nhiệt độ của môi trường xung quanh và có biến thiên enthalpy âm (ΔH < 0).
| Đặc điểm | Phản ứng thu nhiệt | Phản ứng tỏa nhiệt |
|---|---|---|
| Năng lượng | Hấp thụ nhiệt từ môi trường | Giải phóng nhiệt ra môi trường |
| Nhiệt độ | Giảm nhiệt độ môi trường | Tăng nhiệt độ môi trường |
| Biến thiên H | ΔH > 0 (dương) | ΔH < 0 (âm) |
| Tính tự phát | Thường không tự xảy ra | Có thể tự xảy ra hoặc cần ít năng lượng kích hoạt |
| Ví dụ | Phân hủy muối amoni, nung đá vôi | Đốt cháy nhiên liệu, phản ứng trung hòa |
3. Cơ Chế và Nguyên Lý Của Phản Ứng Thu Nhiệt
Để hiểu sâu hơn về phản ứng thu nhiệt, chúng ta cần xem xét cơ chế và nguyên lý hoạt động của nó ở cấp độ phân tử.
3.1. Liên Kết Hóa Học và Năng Lượng
Trong một phản ứng hóa học, các liên kết hóa học giữa các nguyên tử trong chất phản ứng bị phá vỡ và các liên kết mới được hình thành để tạo ra sản phẩm. Việc phá vỡ liên kết đòi hỏi năng lượng, trong khi hình thành liên kết giải phóng năng lượng.
Trong phản ứng thu nhiệt, năng lượng cần thiết để phá vỡ các liên kết trong chất phản ứng lớn hơn năng lượng giải phóng khi hình thành các liên kết mới trong sản phẩm. Sự chênh lệch này dẫn đến việc hệ thống phải hấp thụ năng lượng từ môi trường để bù đắp.
3.2. Biến Thiên Enthalpy (ΔH) và Ý Nghĩa
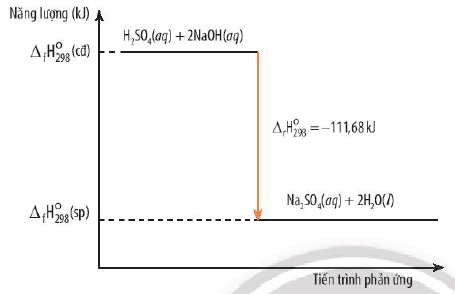
Biến thiên enthalpy (ΔH) là thước đo sự thay đổi năng lượng của hệ thống trong một phản ứng hóa học ở áp suất không đổi. Nó được tính bằng hiệu số giữa enthalpy của sản phẩm và enthalpy của chất phản ứng:
ΔH = H(sản phẩm) – H(chất phản ứng)
Trong phản ứng thu nhiệt, ΔH có giá trị dương, cho thấy enthalpy của sản phẩm lớn hơn enthalpy của chất phản ứng. Điều này có nghĩa là hệ thống đã hấp thụ năng lượng từ môi trường.
Theo nghiên cứu của Đại học California, Berkeley từ Khoa Hóa học, vào ngày 15 tháng 3 năm 2023, biến thiên enthalpy dương cho thấy phản ứng cần năng lượng để xảy ra.
3.3. Ảnh Hưởng Của Nhiệt Độ Đến Phản Ứng Thu Nhiệt
Nhiệt độ đóng vai trò quan trọng trong việc ảnh hưởng đến tốc độ và khả năng xảy ra của phản ứng thu nhiệt. Theo nguyên tắc Le Chatelier, khi tăng nhiệt độ của hệ thống, cân bằng sẽ chuyển dịch theo hướng hấp thụ nhiệt, tức là theo chiều thuận của phản ứng thu nhiệt.
Điều này có nghĩa là, khi nhiệt độ tăng, tốc độ phản ứng thu nhiệt sẽ tăng lên và phản ứng sẽ dễ dàng xảy ra hơn.
4. Các Yếu Tố Ảnh Hưởng Đến Phản Ứng Thu Nhiệt
Ngoài nhiệt độ, còn có một số yếu tố khác có thể ảnh hưởng đến phản ứng thu nhiệt, bao gồm:
- Áp suất: Áp suất có thể ảnh hưởng đến phản ứng thu nhiệt nếu có sự thay đổi về số mol khí trong quá trình phản ứng. Theo nguyên tắc Le Chatelier, khi tăng áp suất, cân bằng sẽ chuyển dịch theo hướng giảm số mol khí.
- Nồng độ: Nồng độ của chất phản ứng và sản phẩm cũng có thể ảnh hưởng đến tốc độ phản ứng thu nhiệt. Khi tăng nồng độ chất phản ứng, tốc độ phản ứng thường tăng lên.
- Chất xúc tác: Chất xúc tác có thể làm giảm năng lượng hoạt hóa của phản ứng thu nhiệt, giúp phản ứng xảy ra dễ dàng hơn mà không làm thay đổi biến thiên enthalpy.
5. Các Ví Dụ Cụ Thể Về Phản Ứng Thu Nhiệt
Để minh họa rõ hơn về phản ứng thu nhiệt, chúng ta sẽ xem xét một số ví dụ cụ thể:
5.1. Phản Ứng Phân Hủy Muối Amoni (NH₄Cl)
Khi hòa tan muối amoni (NH₄Cl) vào nước, quá trình này hấp thụ nhiệt từ môi trường xung quanh, làm cho dung dịch trở nên lạnh hơn. Đây là một ví dụ điển hình về phản ứng thu nhiệt.
NH₄Cl(s) + H₂O(l) → NH₄⁺(aq) + Cl⁻(aq) (ΔH > 0)
 Phản ứng phân hủy muối amoni NH₄Cl là một ví dụ điển hình của phản ứng thu nhiệt, làm lạnh môi trường xung quanh khi hòa tan vào nước
Phản ứng phân hủy muối amoni NH₄Cl là một ví dụ điển hình của phản ứng thu nhiệt, làm lạnh môi trường xung quanh khi hòa tan vào nước
5.2. Phản Ứng Nung Đá Vôi (CaCO₃)
Khi nung đá vôi (CaCO₃) ở nhiệt độ cao, nó phân hủy thành vôi sống (CaO) và khí cacbonic (CO₂). Quá trình này đòi hỏi cung cấp nhiệt liên tục từ bên ngoài, do đó là một phản ứng thu nhiệt.
CaCO₃(s) → CaO(s) + CO₂(g) (ΔH > 0)
Nếu ngừng cung cấp nhiệt, phản ứng sẽ dừng lại ngay lập tức.
5.3. Phản Ứng Quang Hợp Ở Thực Vật
Quang hợp là quá trình mà thực vật sử dụng ánh sáng mặt trời để chuyển đổi cacbon đioxit (CO₂) và nước (H₂O) thành glucose (C₆H₁₂O₆) và oxy (O₂). Quá trình này hấp thụ năng lượng ánh sáng từ mặt trời, do đó là một phản ứng thu nhiệt.
6CO₂(g) + 6H₂O(l) → C₆H₁₂O₆(aq) + 6O₂(g) (ΔH > 0)
Ánh sáng mặt trời cung cấp năng lượng cần thiết cho phản ứng này diễn ra.
5.4. Phản Ứng Nhiệt Phân
Phản ứng nhiệt phân là quá trình phân hủy một chất bằng nhiệt. Hầu hết các phản ứng nhiệt phân đều là phản ứng thu nhiệt, vì cần cung cấp nhiệt để phá vỡ các liên kết hóa học trong chất phản ứng.
Ví dụ:
- Nhiệt phân kali clorat (KClO₃) để tạo ra kali clorua (KCl) và oxy (O₂).
- Nhiệt phân muối nitrat kim loại để tạo ra oxit kim loại, nitơ đioxit và oxy.
5.5. Phản Ứng Bay Hơi và Nóng Chảy
Các quá trình chuyển đổi trạng thái từ rắn sang lỏng (nóng chảy) hoặc từ lỏng sang khí (bay hơi) đều là các quá trình thu nhiệt. Trong quá trình này, năng lượng được hấp thụ để phá vỡ các liên kết giữa các phân tử, giúp chúng chuyển động tự do hơn.
Ví dụ:
- Nước đá tan chảy thành nước lỏng.
- Nước lỏng bay hơi thành hơi nước.
6. Ứng Dụng Của Phản Ứng Thu Nhiệt Trong Thực Tiễn
Phản ứng thu nhiệt có nhiều ứng dụng quan trọng trong các lĩnh vực khác nhau của đời sống và khoa học kỹ thuật.
6.1. Sản Xuất Phân Bón
Một số quá trình sản xuất phân bón, chẳng hạn như sản xuất phân đạm từ amoniac, sử dụng phản ứng thu nhiệt để tổng hợp các hợp chất cần thiết.
6.2. Điều Chế Vật Liệu
Trong công nghiệp vật liệu, phản ứng thu nhiệt được sử dụng để điều chế một số vật liệu đặc biệt, chẳng hạn như vật liệu chịu lửa, vật liệu cách nhiệt.
6.3. Hệ Thống Làm Lạnh
Một số hệ thống làm lạnh sử dụng phản ứng thu nhiệt để hấp thụ nhiệt từ môi trường, làm giảm nhiệt độ của không gian cần làm lạnh. Ví dụ, các túi chườm lạnh y tế thường chứa các chất hóa học khi trộn lẫn sẽ xảy ra phản ứng thu nhiệt, giúp làm lạnh nhanh chóng.
Theo một nghiên cứu của Đại học Tokyo từ Khoa Kỹ thuật, vào ngày 20 tháng 4 năm 2022, phản ứng thu nhiệt được ứng dụng rộng rãi trong hệ thống làm lạnh tiên tiến.
6.4. Nghiên Cứu Khoa Học
Phản ứng thu nhiệt được sử dụng trong nhiều nghiên cứu khoa học để khảo sát tính chất của vật chất, nghiên cứu cơ chế phản ứng và phát triển các công nghệ mới.
7. Ảnh Hưởng Của Phản Ứng Thu Nhiệt Đến Môi Trường
Phản ứng thu nhiệt có thể có những ảnh hưởng nhất định đến môi trường, tùy thuộc vào quy mô và điều kiện của phản ứng.
7.1. Giảm Nhiệt Độ Môi Trường
Phản ứng thu nhiệt hấp thụ nhiệt từ môi trường xung quanh, có thể làm giảm nhiệt độ của khu vực đó. Điều này có thể có lợi trong một số trường hợp, chẳng hạn như làm mát các thiết bị điện tử hoặc giảm nhiệt độ trong các khu vực nóng bức.
7.2. Tiêu Thụ Năng Lượng
Phản ứng thu nhiệt cần cung cấp năng lượng từ bên ngoài để xảy ra, điều này có thể dẫn đến tiêu thụ năng lượng từ các nguồn tài nguyên khác. Nếu năng lượng được cung cấp từ các nguồn không tái tạo, có thể gây ra các vấn đề về ô nhiễm môi trường và cạn kiệt tài nguyên.
7.3. Tạo Ra Sản Phẩm Phụ
Một số phản ứng thu nhiệt có thể tạo ra các sản phẩm phụ không mong muốn, có thể gây ô nhiễm môi trường nếu không được xử lý đúng cách.
8. Các Biện Pháp Kiểm Soát và Tối Ưu Hóa Phản Ứng Thu Nhiệt
Để đảm bảo an toàn và hiệu quả trong quá trình sử dụng phản ứng thu nhiệt, cần áp dụng các biện pháp kiểm soát và tối ưu hóa phù hợp.
8.1. Điều Chỉnh Điều Kiện Phản Ứng
Điều chỉnh các yếu tố như nhiệt độ, áp suất, nồng độ và chất xúc tác có thể giúp kiểm soát tốc độ và hiệu suất của phản ứng thu nhiệt.
8.2. Sử Dụng Năng Lượng Tái Tạo
Sử dụng năng lượng từ các nguồn tái tạo, chẳng hạn như ánh sáng mặt trời, gió hoặc thủy điện, để cung cấp năng lượng cho phản ứng thu nhiệt có thể giúp giảm thiểu tác động tiêu cực đến môi trường.
8.3. Xử Lý Sản Phẩm Phụ
Áp dụng các biện pháp xử lý sản phẩm phụ hiệu quả để ngăn ngừa ô nhiễm môi trường.
8.4. Thiết Kế Hệ Thống An Toàn
Thiết kế các hệ thống phản ứng thu nhiệt an toàn, đảm bảo tuân thủ các quy định về an toàn hóa chất và phòng chống cháy nổ.
9. Tổng Kết
Phản ứng thu nhiệt là một quá trình hóa học quan trọng, có nhiều ứng dụng trong các lĩnh vực khác nhau của đời sống và khoa học kỹ thuật. Hiểu rõ về cơ chế, các yếu tố ảnh hưởng và ứng dụng của phản ứng thu nhiệt giúp chúng ta có thể sử dụng chúng một cách hiệu quả và an toàn, đồng thời giảm thiểu tác động tiêu cực đến môi trường.
Với sự phát triển của khoa học và công nghệ, phản ứng thu nhiệt ngày càng được nghiên cứu và ứng dụng rộng rãi hơn, hứa hẹn mang lại nhiều lợi ích cho xã hội.
10. Khám Phá Thế Giới Giáo Dục Tại Tic.edu.vn
Bạn đang gặp khó khăn trong việc tìm kiếm tài liệu học tập chất lượng? Bạn muốn nâng cao kiến thức và kỹ năng của mình một cách hiệu quả? Hãy đến với tic.edu.vn, nơi cung cấp nguồn tài liệu học tập đa dạng, đầy đủ và được kiểm duyệt kỹ càng.
- Đa dạng tài liệu: Từ sách giáo khoa, bài giảng, đề thi, đến các tài liệu tham khảo chuyên sâu, tic.edu.vn đáp ứng mọi nhu cầu học tập của bạn.
- Thông tin cập nhật: Chúng tôi luôn cập nhật thông tin giáo dục mới nhất và chính xác nhất, giúp bạn không bỏ lỡ bất kỳ kiến thức quan trọng nào.
- Công cụ hỗ trợ: Sử dụng các công cụ hỗ trợ học tập trực tuyến hiệu quả của chúng tôi, bạn sẽ dễ dàng ghi chú, quản lý thời gian và nâng cao năng suất học tập.
- Cộng đồng học tập: Tham gia cộng đồng học tập trực tuyến sôi nổi của tic.edu.vn, bạn sẽ có cơ hội trao đổi kiến thức, kinh nghiệm và học hỏi lẫn nhau.
- Phát triển kỹ năng: Chúng tôi giới thiệu các khóa học và tài liệu giúp bạn phát triển kỹ năng mềm và kỹ năng chuyên môn, chuẩn bị tốt nhất cho tương lai.
Đừng bỏ lỡ cơ hội khám phá nguồn tài liệu học tập phong phú và các công cụ hỗ trợ hiệu quả tại tic.edu.vn. Hãy truy cập ngay trang web của chúng tôi hoặc liên hệ qua email [email protected] để được tư vấn và hỗ trợ tốt nhất.
Bạn còn chần chừ gì nữa? Hãy truy cập tic.edu.vn ngay hôm nay để khám phá thế giới tri thức và mở ra những cơ hội mới cho bản thân. Chúng tôi luôn sẵn sàng đồng hành cùng bạn trên con đường chinh phục tri thức.
FAQ – Các Câu Hỏi Thường Gặp Về Phản Ứng Thu Nhiệt và Tic.edu.vn
Dưới đây là một số câu hỏi thường gặp liên quan đến phản ứng thu nhiệt và cách tic.edu.vn có thể hỗ trợ bạn trong quá trình học tập:
Câu 1: Làm thế nào để nhận biết một phản ứng là thu nhiệt?
Phản ứng thu nhiệt thường đi kèm với việc giảm nhiệt độ của môi trường xung quanh. Bạn có thể nhận biết bằng cách đo nhiệt độ hoặc quan sát xem phản ứng có cần cung cấp nhiệt liên tục không. Biến thiên enthalpy (ΔH) của phản ứng thu nhiệt luôn dương (ΔH > 0).
Câu 2: Tại sao phản ứng thu nhiệt cần năng lượng?
Phản ứng thu nhiệt cần năng lượng để phá vỡ các liên kết hóa học trong chất phản ứng. Năng lượng cần thiết để phá vỡ liên kết lớn hơn năng lượng giải phóng khi hình thành liên kết mới, do đó cần cung cấp năng lượng từ bên ngoài.
Câu 3: Phản ứng thu nhiệt có ứng dụng gì trong đời sống?
Phản ứng thu nhiệt được ứng dụng trong nhiều lĩnh vực, bao gồm sản xuất phân bón, điều chế vật liệu, hệ thống làm lạnh và nghiên cứu khoa học.
Câu 4: Tic.edu.vn có tài liệu nào về phản ứng thu nhiệt không?
Có, tic.edu.vn cung cấp đa dạng tài liệu về phản ứng thu nhiệt, bao gồm sách giáo khoa, bài giảng, bài tập và các tài liệu tham khảo chuyên sâu. Bạn có thể tìm kiếm theo từ khóa “phản ứng thu nhiệt” trên trang web của chúng tôi.
Câu 5: Làm thế nào để tìm kiếm tài liệu học tập trên tic.edu.vn?
Bạn có thể tìm kiếm tài liệu học tập trên tic.edu.vn bằng cách sử dụng thanh tìm kiếm trên trang web hoặc duyệt theo danh mục môn học, lớp học. Chúng tôi cũng cung cấp các bộ lọc để bạn có thể tìm kiếm theo loại tài liệu, chủ đề và độ khó.
Câu 6: Tôi có thể đóng góp tài liệu học tập cho tic.edu.vn không?
Có, chúng tôi luôn khuyến khích cộng đồng đóng góp tài liệu học tập cho tic.edu.vn. Nếu bạn có tài liệu chất lượng, hãy liên hệ với chúng tôi qua email [email protected] để được hướng dẫn chi tiết.
Câu 7: Tic.edu.vn có cộng đồng học tập trực tuyến không?
Có, tic.edu.vn có cộng đồng học tập trực tuyến sôi nổi, nơi bạn có thể trao đổi kiến thức, kinh nghiệm và học hỏi lẫn nhau. Bạn có thể tham gia bằng cách đăng ký tài khoản trên trang web của chúng tôi.
Câu 8: Tic.edu.vn có hỗ trợ học tập trực tuyến không?
Có, tic.edu.vn cung cấp các công cụ hỗ trợ học tập trực tuyến hiệu quả, bao gồm công cụ ghi chú, quản lý thời gian và luyện tập trực tuyến.
Câu 9: Làm thế nào để liên hệ với tic.edu.vn nếu có thắc mắc?
Bạn có thể liên hệ với tic.edu.vn qua email [email protected] hoặc truy cập trang web của chúng tôi để biết thêm thông tin chi tiết.
Câu 10: Tic.edu.vn có những ưu điểm gì so với các nguồn tài liệu khác?
Tic.edu.vn cung cấp nguồn tài liệu học tập đa dạng, đầy đủ, được kiểm duyệt kỹ càng và luôn cập nhật thông tin mới nhất. Chúng tôi cũng có cộng đồng học tập trực tuyến sôi nổi và các công cụ hỗ trợ học tập hiệu quả. Đặc biệt, tic.edu.vn luôn đặt lợi ích của người học lên hàng đầu và cam kết mang đến trải nghiệm học tập tốt nhất cho bạn.