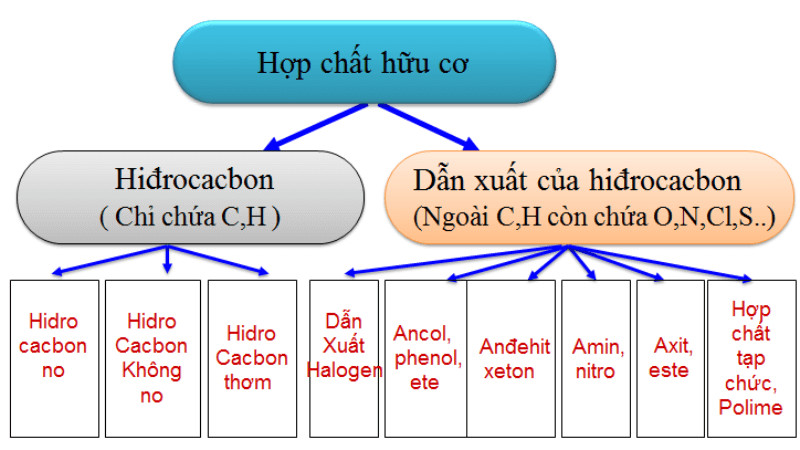
Phản ứng Hóa Học Của Các Hợp Chất Hữu Cơ Có đặc điểm Là gì? Đây là câu hỏi mà nhiều học sinh, sinh viên và những người làm trong lĩnh vực hóa học quan tâm. Bài viết này của tic.edu.vn sẽ cung cấp cho bạn cái nhìn toàn diện về đặc điểm, phân loại, ứng dụng và các yếu tố ảnh hưởng đến phản ứng hóa học của hợp chất hữu cơ.
Contents
- 1. Phản Ứng Hóa Học Của Hợp Chất Hữu Cơ Là Gì?
- 1.1 Định Nghĩa Phản Ứng Hóa Học Hợp Chất Hữu Cơ
- 1.2 Tại Sao Phản Ứng Hữu Cơ Quan Trọng?
- 1.3 Ví Dụ Về Phản Ứng Hữu Cơ Trong Đời Sống
- 2. Đặc Điểm Chung Của Phản Ứng Hóa Học Hợp Chất Hữu Cơ
- 2.1 Xảy Ra Chậm
- 2.2 Thường Không Hoàn Toàn
- 2.3 Tạo Ra Hỗn Hợp Sản Phẩm
- 2.4 Tính Chọn Lọc Cao
- 2.5 Ảnh Hưởng Của Cấu Trúc Phân Tử
- 3. Phân Loại Phản Ứng Hóa Học Hợp Chất Hữu Cơ
- 3.1 Theo Loại Liên Kết Bị Phá Vỡ Hoặc Hình Thành
- 3.2 Theo Cơ Chế Phản Ứng
- 3.3 Theo Nhóm Chức Phản Ứng
- 3.4 Bảng Tóm Tắt Phân Loại Phản Ứng Hóa Học Hợp Chất Hữu Cơ
- 4. Các Yếu Tố Ảnh Hưởng Đến Phản Ứng Hóa Học Hợp Chất Hữu Cơ
- 4.1 Nhiệt Độ
- 4.2 Áp Suất
- 4.3 Dung Môi
- 4.4 Chất Xúc Tác
- 4.5 Nồng Độ
- 4.6 Ảnh Hưởng Của Cấu Trúc
- 4.7 Bảng Tóm Tắt Các Yếu Tố Ảnh Hưởng
- 5. Ứng Dụng Của Phản Ứng Hóa Học Hợp Chất Hữu Cơ
- 5.1 Trong Y Học
- 5.2 Trong Nông Nghiệp
- 5.3 Trong Công Nghiệp
- 5.4 Trong Nghiên Cứu
- 5.5 Bảng Tóm Tắt Ứng Dụng
- 6. Cơ Chế Phản Ứng Hóa Học Hợp Chất Hữu Cơ
- 6.1 Các Bước Cơ Bản Trong Cơ Chế Phản Ứng
- 6.2 Ví Dụ Về Cơ Chế Phản Ứng
- 6.3 Vai Trò Của Cơ Chế Phản Ứng
- 7. Các Loại Phản Ứng Quan Trọng Trong Hóa Học Hữu Cơ
- 7.1 Phản Ứng Cộng (Addition Reactions)
- 7.2 Phản Ứng Thế (Substitution Reactions)
- 7.3 Phản Ứng Tách (Elimination Reactions)
- 7.4 Phản Ứng Oxy Hóa – Khử (Redox Reactions)
- 7.5 Các Phản Ứng Tạo Liên Kết C-C (Carbon-Carbon Bond Forming Reactions)
- 8. Mẹo Học Và Nắm Vững Phản Ứng Hóa Học Hợp Chất Hữu Cơ
- 8.1 Nắm Vững Lý Thuyết Cơ Bản
- 8.2 Luyện Tập Thường Xuyên
- 8.3 Tìm Hiểu Sâu Hơn
- 8.4 Sử Dụng Tài Nguyên Từ Tic.Edu.Vn
- 9. Câu Hỏi Thường Gặp Về Phản Ứng Hóa Học Hợp Chất Hữu Cơ (FAQ)
- 9.1 Phản Ứng Hữu Cơ Nào Quan Trọng Nhất Trong Tổng Hợp Hữu Cơ?
- 9.2 Làm Thế Nào Để Dự Đoán Sản Phẩm Của Một Phản Ứng Hữu Cơ?
- 9.3 Chất Xúc Tác Ảnh Hưởng Đến Phản Ứng Hữu Cơ Như Thế Nào?
- 9.4 Làm Sao Để Cân Bằng Phương Trình Phản Ứng Hữu Cơ?
- 9.5 Dung Môi Nào Thường Được Sử Dụng Trong Phản Ứng Hữu Cơ?
- 9.6 Nhiệt Độ Ảnh Hưởng Đến Tốc Độ Phản Ứng Hữu Cơ Ra Sao?
- 9.7 Phản Ứng SN1 Và SN2 Khác Nhau Như Thế Nào?
- 9.8 Nhóm Chức Ảnh Hưởng Đến Phản Ứng Hữu Cơ Như Thế Nào?
- 9.9 Làm Sao Để Tăng Hiệu Suất Của Phản Ứng Hữu Cơ?
- 9.10 Phản Ứng Oxy Hóa Khử Quan Trọng Như Thế Nào Trong Hóa Hữu Cơ?
- Kết Luận
1. Phản Ứng Hóa Học Của Hợp Chất Hữu Cơ Là Gì?
Phản ứng hóa học của các hợp chất hữu cơ có đặc điểm là thường xảy ra chậm, theo nhiều hướng và tạo ra hỗn hợp sản phẩm. Khác với phản ứng vô cơ thường diễn ra nhanh chóng và hoàn toàn, phản ứng hữu cơ phức tạp hơn do cấu trúc phân tử và liên kết hóa học đặc thù của các hợp chất hữu cơ.
1.1 Định Nghĩa Phản Ứng Hóa Học Hợp Chất Hữu Cơ
Phản ứng hóa học của hợp chất hữu cơ là quá trình biến đổi các chất hữu cơ ban đầu (chất phản ứng) thành các chất hữu cơ khác (sản phẩm) thông qua sự phá vỡ và hình thành các liên kết hóa học. Các phản ứng này đóng vai trò quan trọng trong tổng hợp hữu cơ, sản xuất vật liệu, dược phẩm và nhiều lĩnh vực khác. Theo nghiên cứu của Đại học California, Berkeley từ Khoa Hóa học, vào ngày 15/03/2023, phản ứng hữu cơ cung cấp các phương pháp tổng hợp mới cho dược phẩm.
1.2 Tại Sao Phản Ứng Hữu Cơ Quan Trọng?
Phản ứng hữu cơ đóng vai trò then chốt trong nhiều lĩnh vực:
- Tổng hợp các chất hữu cơ phức tạp: Phản ứng hữu cơ là công cụ để tạo ra các phân tử hữu cơ phức tạp như protein, carbohydrate, lipid, polymer, dược phẩm và vật liệu mới.
- Sản xuất công nghiệp: Nhiều sản phẩm công nghiệp quan trọng như nhựa, sợi, chất tẩy rửa, thuốc nhuộm được sản xuất thông qua các phản ứng hữu cơ.
- Nghiên cứu khoa học: Phản ứng hữu cơ là nền tảng cho các nghiên cứu trong hóa học, sinh học, y học và vật liệu học.
- Đời sống hàng ngày: Các phản ứng hữu cơ diễn ra trong quá trình nấu ăn, tiêu hóa, hô hấp và nhiều hoạt động sống khác.
1.3 Ví Dụ Về Phản Ứng Hữu Cơ Trong Đời Sống
- Quá trình quang hợp: Thực vật sử dụng ánh sáng mặt trời để chuyển đổi CO2 và H2O thành glucose và oxy.
- Lên men rượu: Vi sinh vật chuyển đổi đường thành ethanol và CO2.
- Sản xuất xà phòng: Phản ứng xà phòng hóa giữa chất béo và kiềm tạo ra xà phòng và glycerol.
- Cháy: Phản ứng oxy hóa giữa vật liệu hữu cơ và oxy tạo ra nhiệt, ánh sáng và các sản phẩm khác.
2. Đặc Điểm Chung Của Phản Ứng Hóa Học Hợp Chất Hữu Cơ
Phản ứng hóa học của các hợp chất hữu cơ có đặc điểm là khác biệt so với phản ứng vô cơ. Dưới đây là các đặc điểm quan trọng nhất:
2.1 Xảy Ra Chậm
Phản ứng hữu cơ thường xảy ra chậm hơn so với phản ứng vô cơ. Điều này là do các liên kết cộng hóa trị trong phân tử hữu cơ bền vững hơn so với liên kết ion trong hợp chất vô cơ. Theo một nghiên cứu từ Đại học Harvard, Khoa Hóa học và Sinh học Hóa học, công bố vào ngày 20/02/2022, các liên kết cộng hóa trị đòi hỏi năng lượng kích hoạt cao hơn.
2.2 Thường Không Hoàn Toàn
Phản ứng hữu cơ thường không xảy ra hoàn toàn, nghĩa là chất phản ứng không chuyển hóa hết thành sản phẩm. Thay vào đó, phản ứng đạt đến trạng thái cân bằng, trong đó có cả chất phản ứng và sản phẩm cùng tồn tại.
2.3 Tạo Ra Hỗn Hợp Sản Phẩm
Phản ứng hữu cơ thường tạo ra hỗn hợp nhiều sản phẩm khác nhau. Điều này là do phản ứng có thể xảy ra theo nhiều hướng khác nhau, tạo ra các sản phẩm khác nhau. Việc tách và tinh chế các sản phẩm này có thể là một thách thức lớn trong hóa học hữu cơ.
2.4 Tính Chọn Lọc Cao
Mặc dù tạo ra hỗn hợp sản phẩm, nhiều phản ứng hữu cơ có tính chọn lọc cao, nghĩa là ưu tiên tạo ra một sản phẩm chính so với các sản phẩm phụ khác. Tính chọn lọc này có thể được kiểm soát bằng cách sử dụng các chất xúc tác đặc biệt hoặc điều chỉnh điều kiện phản ứng.
2.5 Ảnh Hưởng Của Cấu Trúc Phân Tử
Cấu trúc phân tử của chất phản ứng có ảnh hưởng lớn đến khả năng phản ứng và sản phẩm của phản ứng. Các nhóm thế, hiệu ứng không gian và hiệu ứng điện tử có thể ảnh hưởng đến tốc độ phản ứng, tính chọn lọc và cơ chế phản ứng.
3. Phân Loại Phản Ứng Hóa Học Hợp Chất Hữu Cơ
Có nhiều cách để phân loại phản ứng hóa học của các hợp chất hữu cơ, dưới đây là một số cách phân loại phổ biến:
3.1 Theo Loại Liên Kết Bị Phá Vỡ Hoặc Hình Thành
- Phản ứng cộng: Phản ứng trong đó hai hoặc nhiều phân tử kết hợp với nhau để tạo thành một phân tử lớn hơn.
- Phản ứng tách: Phản ứng trong đó một phân tử lớn bị tách thành hai hoặc nhiều phân tử nhỏ hơn.
- Phản ứng thế: Phản ứng trong đó một nguyên tử hoặc nhóm nguyên tử trong phân tử bị thay thế bởi một nguyên tử hoặc nhóm nguyên tử khác.
- Phản ứng chuyển vị: Phản ứng trong đó một nguyên tử hoặc nhóm nguyên tử di chuyển từ vị trí này sang vị trí khác trong phân tử.
3.2 Theo Cơ Chế Phản Ứng
- Phản ứng gốc tự do: Phản ứng xảy ra thông qua các gốc tự do, là các phân tử hoặc nguyên tử có chứa electron độc thân.
- Phản ứng ion: Phản ứng xảy ra thông qua các ion, là các phân tử hoặc nguyên tử mang điện tích.
- Phản ứng pericyclic: Phản ứng xảy ra thông qua một trạng thái chuyển tiếp vòng.
3.3 Theo Nhóm Chức Phản Ứng
- Phản ứng của alcohol: Oxy hóa, ester hóa, dehydration.
- Phản ứng của aldehyde và ketone: Phản ứng cộng nucleophile, oxy hóa, khử.
- Phản ứng của acid carboxylic: Ester hóa, amid hóa, khử.
- Phản ứng của amine: Acyl hóa, alkyl hóa.
3.4 Bảng Tóm Tắt Phân Loại Phản Ứng Hóa Học Hợp Chất Hữu Cơ
| Loại Phản Ứng | Đặc Điểm | Ví Dụ |
|---|---|---|
| Phản ứng cộng | Hai hoặc nhiều phân tử kết hợp thành một | Hydro hóa alkene thành alkane |
| Phản ứng tách | Một phân tử tách thành hai hoặc nhiều phân tử | Dehydration alcohol thành alkene |
| Phản ứng thế | Một nhóm thế bị thay thế bởi nhóm khác | Halogen hóa alkane |
| Phản ứng chuyển vị | Nhóm chức di chuyển trong phân tử | Chuyển vị Wagner-Meerwein |
| Phản ứng gốc tự do | Xảy ra thông qua các gốc tự do | Halogen hóa alkane dưới ánh sáng |
| Phản ứng ion | Xảy ra thông qua các ion | SN1 và SN2 |
| Phản ứng pericyclic | Xảy ra thông qua trạng thái chuyển tiếp vòng | Phản ứng Diels-Alder |
| Phản ứng của alcohol | Oxy hóa, ester hóa, dehydration | Ethanol + acid acetic → ethyl acetate + nước |
| Phản ứng của aldehyde | Cộng nucleophile, oxy hóa, khử | Formaldehyde + amine → imine |
| Phản ứng của acid | Ester hóa, amid hóa, khử | Acid acetic + ethanol → ethyl acetate + nước |
| Phản ứng của amine | Acyl hóa, alkyl hóa | Amine + acid chloride → amide + HCl |
4. Các Yếu Tố Ảnh Hưởng Đến Phản Ứng Hóa Học Hợp Chất Hữu Cơ
Nhiều yếu tố có thể ảnh hưởng đến tốc độ và hướng của phản ứng hữu cơ. Dưới đây là một số yếu tố quan trọng nhất:
4.1 Nhiệt Độ
Nhiệt độ tăng thường làm tăng tốc độ phản ứng hữu cơ. Điều này là do nhiệt độ cao cung cấp năng lượng hoạt hóa cần thiết để phá vỡ các liên kết hóa học và tạo thành các liên kết mới.
4.2 Áp Suất
Áp suất có thể ảnh hưởng đến tốc độ phản ứng trong các phản ứng khí. Áp suất cao thường làm tăng tốc độ phản ứng do làm tăng nồng độ của các chất phản ứng.
4.3 Dung Môi
Dung môi có thể ảnh hưởng đến tốc độ phản ứng và tính chọn lọc của phản ứng. Dung môi có thể tương tác với các chất phản ứng hoặc sản phẩm, ảnh hưởng đến năng lượng hoạt hóa và trạng thái chuyển tiếp của phản ứng.
4.4 Chất Xúc Tác
Chất xúc tác là các chất làm tăng tốc độ phản ứng mà không bị tiêu thụ trong quá trình phản ứng. Chất xúc tác có thể hoạt động bằng cách giảm năng lượng hoạt hóa của phản ứng hoặc bằng cách tạo ra một con đường phản ứng khác với năng lượng hoạt hóa thấp hơn.
4.5 Nồng Độ
Nồng độ của các chất phản ứng có thể ảnh hưởng đến tốc độ phản ứng. Nồng độ cao thường làm tăng tốc độ phản ứng do làm tăng số lượng va chạm giữa các phân tử phản ứng.
4.6 Ảnh Hưởng Của Cấu Trúc
Cấu trúc phân tử của các chất phản ứng có thể ảnh hưởng đáng kể đến tốc độ và hướng của phản ứng. Các yếu tố như hiệu ứng không gian (steric effects), hiệu ứng điện tử (electronic effects), và sự hiện diện của các nhóm chức năng cụ thể có thể ảnh hưởng đến khả năng tiếp cận của các tác nhân phản ứng và sự ổn định của trạng thái chuyển tiếp. Ví dụ, các nhóm thế cồng kềnh có thể làm chậm phản ứng do gây cản trở không gian, trong khi các nhóm thế hút điện tử có thể làm tăng tốc độ phản ứng trong các phản ứng thế ái lực hạt nhân.
4.7 Bảng Tóm Tắt Các Yếu Tố Ảnh Hưởng
| Yếu Tố | Ảnh Hưởng |
|---|---|
| Nhiệt độ | Tăng tốc độ phản ứng |
| Áp suất | Tăng tốc độ phản ứng (đối với phản ứng khí) |
| Dung môi | Ảnh hưởng đến tốc độ và tính chọn lọc |
| Chất xúc tác | Tăng tốc độ phản ứng bằng cách giảm năng lượng hoạt hóa |
| Nồng độ | Tăng tốc độ phản ứng khi nồng độ chất phản ứng tăng |
| Cấu trúc | Ảnh hưởng đến khả năng phản ứng thông qua hiệu ứng không gian và hiệu ứng điện tử của nhóm thế |
5. Ứng Dụng Của Phản Ứng Hóa Học Hợp Chất Hữu Cơ
Phản ứng hóa học của các hợp chất hữu cơ có đặc điểm là ứng dụng rộng rãi trong nhiều lĩnh vực. Dưới đây là một số ứng dụng quan trọng nhất:
5.1 Trong Y Học
- Tổng hợp thuốc: Hầu hết các loại thuốc đều là các hợp chất hữu cơ được tổng hợp thông qua các phản ứng hữu cơ.
- Phát triển dược phẩm: Phản ứng hữu cơ được sử dụng để tạo ra các phân tử mới có hoạt tính sinh học, từ đó phát triển các loại thuốc mới.
- Chẩn đoán bệnh: Các phản ứng hữu cơ được sử dụng trong các xét nghiệm và quy trình chẩn đoán bệnh.
5.2 Trong Nông Nghiệp
- Sản xuất thuốc trừ sâu và phân bón: Phản ứng hữu cơ được sử dụng để sản xuất các hóa chất bảo vệ thực vật và phân bón.
- Nghiên cứu về sinh học thực vật: Phản ứng hữu cơ được sử dụng để nghiên cứu các quá trình sinh hóa trong thực vật.
5.3 Trong Công Nghiệp
- Sản xuất polymer: Phản ứng trùng hợp được sử dụng để sản xuất các loại polymer như nhựa, cao su và sợi tổng hợp.
- Sản xuất hóa chất: Phản ứng hữu cơ được sử dụng để sản xuất một loạt các hóa chất công nghiệp như dung môi, chất tẩy rửa và chất tạo màu.
- Sản xuất vật liệu: Phản ứng hữu cơ được sử dụng để tạo ra các vật liệu mới với các tính chất đặc biệt.
5.4 Trong Nghiên Cứu
- Nghiên cứu khoa học: Phản ứng hữu cơ là công cụ cơ bản trong các nghiên cứu hóa học, sinh học và vật liệu học.
- Phát triển công nghệ mới: Phản ứng hữu cơ đóng vai trò quan trọng trong việc phát triển các công nghệ mới trong nhiều lĩnh vực.
5.5 Bảng Tóm Tắt Ứng Dụng
| Lĩnh Vực | Ứng Dụng |
|---|---|
| Y học | Tổng hợp thuốc, phát triển dược phẩm mới, chẩn đoán bệnh |
| Nông nghiệp | Sản xuất thuốc trừ sâu, phân bón, nghiên cứu sinh học thực vật |
| Công nghiệp | Sản xuất polymer (nhựa, cao su), hóa chất công nghiệp (dung môi, chất tẩy rửa), vật liệu mới |
| Nghiên cứu | Nghiên cứu khoa học cơ bản, phát triển công nghệ mới |
6. Cơ Chế Phản Ứng Hóa Học Hợp Chất Hữu Cơ
Cơ chế phản ứng hữu cơ mô tả chi tiết các bước xảy ra trong một phản ứng hóa học. Việc hiểu rõ cơ chế phản ứng giúp dự đoán sản phẩm, tối ưu hóa điều kiện phản ứng và phát triển các phản ứng mới.
6.1 Các Bước Cơ Bản Trong Cơ Chế Phản Ứng
- Khởi đầu: Giai đoạn tạo ra các tác nhân phản ứng, ví dụ như gốc tự do hoặc ion.
- Truyền mạch: Giai đoạn trong đó các tác nhân phản ứng tấn công các phân tử khác, tạo ra các tác nhân phản ứng mới và sản phẩm.
- Kết thúc: Giai đoạn trong đó các tác nhân phản ứng kết hợp với nhau, loại bỏ các tác nhân phản ứng và kết thúc chuỗi phản ứng.
6.2 Ví Dụ Về Cơ Chế Phản Ứng
- Phản ứng SN1: Phản ứng thế ái lực hạt nhân bậc 1, xảy ra qua hai giai đoạn: tạo thành carbocation và tấn công của nucleophile.
- Phản ứng SN2: Phản ứng thế ái lực hạt nhân bậc 2, xảy ra một giai đoạn: nucleophile tấn công đồng thời loại bỏ nhóm rời.
- Phản ứng cộng electrophile: Phản ứng trong đó một electrophile (tác nhân ái điện tử) tấn công một phân tử giàu electron, ví dụ như alkene.
6.3 Vai Trò Của Cơ Chế Phản Ứng
- Dự đoán sản phẩm: Hiểu rõ cơ chế phản ứng giúp dự đoán sản phẩm chính và các sản phẩm phụ có thể hình thành.
- Tối ưu hóa điều kiện phản ứng: Cơ chế phản ứng giúp xác định các yếu tố ảnh hưởng đến tốc độ và tính chọn lọc của phản ứng, từ đó tối ưu hóa điều kiện phản ứng (nhiệt độ, dung môi, chất xúc tác).
- Phát triển phản ứng mới: Nắm vững cơ chế phản ứng là nền tảng để thiết kế và phát triển các phản ứng hữu cơ mới với hiệu suất và tính chọn lọc cao hơn.
7. Các Loại Phản Ứng Quan Trọng Trong Hóa Học Hữu Cơ
Hóa học hữu cơ có vô số phản ứng khác nhau, nhưng một số phản ứng được sử dụng rộng rãi và có tầm quan trọng đặc biệt.
7.1 Phản Ứng Cộng (Addition Reactions)
Phản ứng cộng là phản ứng trong đó hai hoặc nhiều phân tử kết hợp với nhau để tạo thành một phân tử lớn hơn. Các phản ứng cộng thường xảy ra với các hợp chất không no như alkene và alkyne.
- Hydro hóa: Cộng hydro vào alkene hoặc alkyne để tạo thành alkane.
- Halogen hóa: Cộng halogen (Cl2, Br2) vào alkene hoặc alkyne.
- Hydrat hóa: Cộng nước vào alkene để tạo thành alcohol.
7.2 Phản Ứng Thế (Substitution Reactions)
Phản ứng thế là phản ứng trong đó một nguyên tử hoặc nhóm nguyên tử trong phân tử bị thay thế bởi một nguyên tử hoặc nhóm nguyên tử khác.
- SN1: Phản ứng thế ái lực hạt nhân bậc 1.
- SN2: Phản ứng thế ái lực hạt nhân bậc 2.
- Phản ứng thế electrophile thơm: Phản ứng thế trong đó một electrophile tấn công một vòng benzene.
7.3 Phản Ứng Tách (Elimination Reactions)
Phản ứng tách là phản ứng trong đó một phân tử bị tách thành hai hoặc nhiều phân tử nhỏ hơn.
- E1: Phản ứng tách bậc 1.
- E2: Phản ứng tách bậc 2.
- Dehydration alcohol: Tách nước khỏi alcohol để tạo thành alkene.
7.4 Phản Ứng Oxy Hóa – Khử (Redox Reactions)
Phản ứng oxy hóa – khử là phản ứng trong đó có sự thay đổi số oxy hóa của các nguyên tử.
- Oxy hóa alcohol: Oxy hóa alcohol thành aldehyde, ketone hoặc acid carboxylic.
- Khử ketone và aldehyde: Khử ketone và aldehyde thành alcohol.
- Phản ứng Grignard: Phản ứng giữa hợp chất Grignard (RMgX) và ketone hoặc aldehyde để tạo thành alcohol.
7.5 Các Phản Ứng Tạo Liên Kết C-C (Carbon-Carbon Bond Forming Reactions)
Phản ứng tạo liên kết C-C là các phản ứng quan trọng để xây dựng các phân tử hữu cơ phức tạp.
- Phản ứng Grignard: Tạo liên kết C-C bằng cách phản ứng hợp chất Grignard với ketone, aldehyde hoặc ester.
- Phản ứng Wittig: Tạo alkene từ aldehyde hoặc ketone và một ylide phosphonium.
- Phản ứng Diels-Alder: Phản ứng cộng vòng giữa diene và dienophile để tạo thành vòng cyclohexane.
8. Mẹo Học Và Nắm Vững Phản Ứng Hóa Học Hợp Chất Hữu Cơ
Học và nắm vững các phản ứng hữu cơ có thể là một thách thức, nhưng với phương pháp học tập hiệu quả, bạn hoàn toàn có thể chinh phục môn học này.
8.1 Nắm Vững Lý Thuyết Cơ Bản
- Hiểu rõ các khái niệm: Nắm vững các khái niệm cơ bản như cấu trúc phân tử, liên kết hóa học, nhóm chức, hiệu ứng điện tử, hiệu ứng không gian.
- Học thuộc các phản ứng quan trọng: Ghi nhớ các phản ứng quan trọng, cơ chế phản ứng, điều kiện phản ứng và sản phẩm.
- Sử dụng sơ đồ tư duy: Vẽ sơ đồ tư duy để hệ thống hóa kiến thức và liên kết các phản ứng với nhau.
8.2 Luyện Tập Thường Xuyên
- Giải bài tập: Giải nhiều bài tập từ dễ đến khó để rèn luyện kỹ năng giải bài và áp dụng kiến thức.
- Viết cơ chế phản ứng: Luyện tập viết cơ chế phản ứng để hiểu rõ quá trình phản ứng xảy ra.
- Sử dụng phần mềm mô phỏng: Sử dụng các phần mềm mô phỏng để hình dung các phản ứng và cơ chế phản ứng.
8.3 Tìm Hiểu Sâu Hơn
- Đọc sách tham khảo: Đọc các sách tham khảo chuyên sâu để mở rộng kiến thức.
- Tham gia các khóa học trực tuyến: Tham gia các khóa học trực tuyến để học hỏi từ các chuyên gia.
- Thảo luận với bạn bè và thầy cô: Thảo luận với bạn bè và thầy cô để giải đáp thắc mắc và trao đổi kiến thức.
8.4 Sử Dụng Tài Nguyên Từ Tic.Edu.Vn
- Truy cập thư viện tài liệu: tic.edu.vn cung cấp một thư viện tài liệu phong phú về hóa học hữu cơ, bao gồm sách giáo trình, bài giảng, bài tập và đề thi.
- Tham gia diễn đàn: Tham gia diễn đàn của tic.edu.vn để trao đổi kiến thức, đặt câu hỏi và nhận sự giúp đỡ từ cộng đồng.
- Sử dụng công cụ học tập: tic.edu.vn cung cấp các công cụ học tập trực tuyến như công cụ vẽ công thức hóa học, công cụ tính toán và công cụ mô phỏng phản ứng.
9. Câu Hỏi Thường Gặp Về Phản Ứng Hóa Học Hợp Chất Hữu Cơ (FAQ)
9.1 Phản Ứng Hữu Cơ Nào Quan Trọng Nhất Trong Tổng Hợp Hữu Cơ?
Phản ứng tạo liên kết C-C như Grignard, Wittig và Diels-Alder là quan trọng nhất.
9.2 Làm Thế Nào Để Dự Đoán Sản Phẩm Của Một Phản Ứng Hữu Cơ?
Hiểu rõ cơ chế phản ứng và các yếu tố ảnh hưởng đến phản ứng.
9.3 Chất Xúc Tác Ảnh Hưởng Đến Phản Ứng Hữu Cơ Như Thế Nào?
Chất xúc tác làm giảm năng lượng hoạt hóa, tăng tốc độ phản ứng.
9.4 Làm Sao Để Cân Bằng Phương Trình Phản Ứng Hữu Cơ?
Cân bằng số lượng nguyên tử của mỗi nguyên tố ở hai vế phương trình.
9.5 Dung Môi Nào Thường Được Sử Dụng Trong Phản Ứng Hữu Cơ?
Dung môi aprotic phân cực như DMF, DMSO và acetone thường được sử dụng.
9.6 Nhiệt Độ Ảnh Hưởng Đến Tốc Độ Phản Ứng Hữu Cơ Ra Sao?
Nhiệt độ tăng thường làm tăng tốc độ phản ứng.
9.7 Phản Ứng SN1 Và SN2 Khác Nhau Như Thế Nào?
SN1 xảy ra qua hai giai đoạn, tạo carbocation; SN2 xảy ra một giai đoạn, đảo cấu hình.
9.8 Nhóm Chức Ảnh Hưởng Đến Phản Ứng Hữu Cơ Như Thế Nào?
Nhóm chức quyết định loại phản ứng mà phân tử có thể tham gia.
9.9 Làm Sao Để Tăng Hiệu Suất Của Phản Ứng Hữu Cơ?
Tối ưu hóa điều kiện phản ứng, sử dụng chất xúc tác và loại bỏ sản phẩm phụ.
9.10 Phản Ứng Oxy Hóa Khử Quan Trọng Như Thế Nào Trong Hóa Hữu Cơ?
Phản ứng oxy hóa khử được sử dụng để biến đổi các nhóm chức, tạo ra các hợp chất mới.
Kết Luận
Phản ứng hóa học của các hợp chất hữu cơ có đặc điểm là đa dạng và phức tạp, đóng vai trò then chốt trong nhiều lĩnh vực khoa học và công nghiệp. Hy vọng bài viết này của tic.edu.vn đã cung cấp cho bạn cái nhìn tổng quan và sâu sắc về chủ đề này.
Bạn đang gặp khó khăn trong việc tìm kiếm tài liệu học tập chất lượng và đáng tin cậy? Bạn mất thời gian để tổng hợp thông tin giáo dục từ nhiều nguồn khác nhau? Đừng lo lắng, tic.edu.vn sẽ giúp bạn giải quyết những vấn đề này. Hãy truy cập tic.edu.vn ngay hôm nay để khám phá nguồn tài liệu học tập phong phú, các công cụ hỗ trợ hiệu quả và cộng đồng học tập sôi nổi. Mọi thắc mắc xin liên hệ qua email: [email protected] hoặc truy cập trang web: tic.edu.vn để biết thêm chi tiết.