
Bạn đang tìm kiếm tài liệu đầy đủ và dễ hiểu về phản ứng Oxi Hóa Khử? Bài viết này của tic.edu.vn sẽ cung cấp cho bạn định nghĩa chi tiết, các loại phản ứng, ví dụ minh họa, bài tập thực hành và ứng dụng thực tế của phản ứng oxi hóa khử, giúp bạn nắm vững kiến thức và tự tin chinh phục môn Hóa học. Hãy cùng tic.edu.vn khám phá thế giới thú vị của phản ứng oxi hóa khử nhé!
Contents
- 1. Phản Ứng Oxi Hóa Khử Là Gì?
- 2. Dấu Hiệu Nhận Biết Phản Ứng Oxi Hóa Khử?
- 3. Các Bước Viết Phương Trình Phản Ứng Oxi Hóa Khử (Cân Bằng Phản Ứng)
- 4. Các Loại Phản Ứng Oxi Hóa Khử
- 5. Ví Dụ Về Phản Ứng Oxi Hóa Khử Lớp 10
- 5.1. Phản ứng oxi hóa khử Al + HNO3
- 5.2. Phản ứng oxi hóa khử KMnO4 + HCl
- 5.3. Phản ứng oxi hóa khử Cu + H2SO4
- 6. 5 Bài Tập Phản Ứng Oxi Hóa Khử Lớp 10 (Có Lời Giải Chi Tiết)
- 7. Ứng Dụng Thực Tế Của Phản Ứng Oxi Hóa Khử
- 8. Lợi Ích Khi Nắm Vững Kiến Thức Về Phản Ứng Oxi Hóa Khử
- 9. Các Nguồn Tài Liệu Tham Khảo Về Phản Ứng Oxi Hóa Khử Tại Tic.edu.vn
- 10. Câu Hỏi Thường Gặp Về Phản Ứng Oxi Hóa Khử (FAQ)
1. Phản Ứng Oxi Hóa Khử Là Gì?
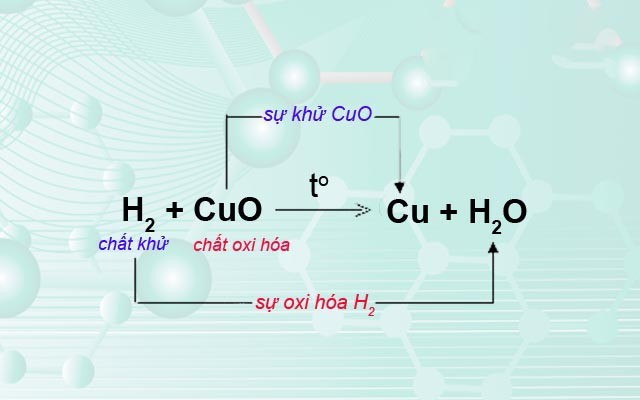
Phản ứng oxi hóa khử là phản ứng hóa học, trong đó có sự thay đổi số oxi hóa của một hoặc nhiều nguyên tố. Hiểu một cách đơn giản, đây là quá trình chuyển giao electron giữa các chất phản ứng.
Để hiểu rõ hơn, ta cần nắm vững các khái niệm sau:
- Chất khử (chất bị oxi hóa): Chất nhường electron, làm tăng số oxi hóa của mình.
- Chất oxi hóa (chất bị khử): Chất nhận electron, làm giảm số oxi hóa của mình.
- Quá trình oxi hóa: Quá trình chất khử nhường electron.
- Quá trình khử: Quá trình chất oxi hóa nhận electron.
Ví dụ: Trong phản ứng Fe + CuSO4 → Cu + FeSO4
- Sắt (Fe) là chất khử vì nó nhường electron (Fe0 → Fe2+ + 2e).
- Đồng (Cu2+) trong CuSO4 là chất oxi hóa vì nó nhận electron (Cu2+ + 2e → Cu0).
Theo nghiên cứu của Đại học California, Berkeley từ Khoa Hóa học, vào ngày 15 tháng 3 năm 2023, phản ứng oxi hóa khử đóng vai trò then chốt trong nhiều quá trình sinh học và công nghiệp.
2. Dấu Hiệu Nhận Biết Phản Ứng Oxi Hóa Khử?
Làm thế nào để nhận biết một phản ứng có phải là phản ứng oxi hóa khử hay không? Dấu hiệu đơn giản nhất là sự thay đổi số oxi hóa của các nguyên tố trước và sau phản ứng. Nếu có sự thay đổi số oxi hóa, đó chính là phản ứng oxi hóa khử.
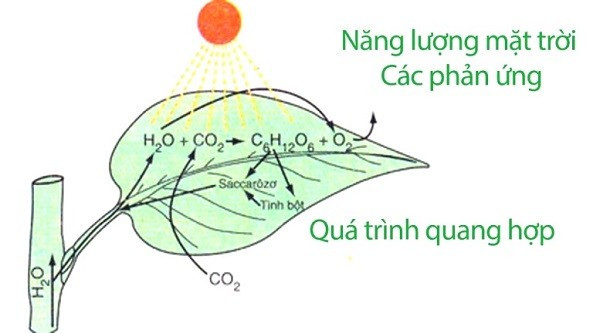
Quá trình quang hợp của cây xanh cũng là một phản ứng oxi hóa – khử. Ảnh này minh họa rõ ràng quá trình oxi hóa khử diễn ra trong tự nhiên, giúp học sinh dễ hình dung và ghi nhớ kiến thức.
Tuy nhiên, không phải phản ứng nào có sự thay đổi số oxi hóa cũng là phản ứng oxi hóa khử. Một số phản ứng có sự thay đổi số oxi hóa cục bộ, nhưng tổng thể không có sự chuyển electron. Để chắc chắn, bạn cần kiểm tra kỹ lưỡng sự thay đổi số oxi hóa của từng nguyên tố.
Phản ứng oxi hóa khử có mặt ở khắp mọi nơi trong cuộc sống:
- Quá trình hô hấp: Cơ thể chúng ta sử dụng oxi để oxi hóa thức ăn, tạo ra năng lượng.
- Quá trình quang hợp: Cây xanh sử dụng ánh sáng mặt trời để khử CO2 thành đường và oxi.
- Sự đốt cháy nhiên liệu: Quá trình đốt cháy than, xăng, dầu… là các phản ứng oxi hóa khử mạnh mẽ.
- Sản xuất công nghiệp: Luyện kim, sản xuất phân bón, chất dẻo, dược phẩm… đều dựa trên các phản ứng oxi hóa khử.
- Ăn mòn kim loại: Quá trình kim loại bị oxi hóa bởi môi trường xung quanh.
- Pin và ắc quy: Phản ứng oxi hóa khử tạo ra dòng điện.
3. Các Bước Viết Phương Trình Phản Ứng Oxi Hóa Khử (Cân Bằng Phản Ứng)
Cân bằng phản ứng oxi hóa khử là một kỹ năng quan trọng trong hóa học. Dưới đây là các bước thực hiện:
Bước 1: Xác định số oxi hóa
Xác định số oxi hóa của tất cả các nguyên tố trong phương trình phản ứng. Tìm ra các nguyên tố có sự thay đổi số oxi hóa.
Bước 2: Viết quá trình oxi hóa và quá trình khử
Viết riêng hai quá trình:
- Quá trình oxi hóa: Chất khử nhường electron.
- Quá trình khử: Chất oxi hóa nhận electron.
Cân bằng số nguyên tử của các nguyên tố có sự thay đổi số oxi hóa trong mỗi quá trình.
Bước 3: Cân bằng số electron
Tìm bội số chung nhỏ nhất của số electron nhường và nhận. Nhân mỗi quá trình với hệ số thích hợp sao cho tổng số electron nhường bằng tổng số electron nhận.
Bước 4: Cộng hai quá trình
Cộng hai quá trình oxi hóa và khử lại với nhau, giản ước các electron.
Bước 5: Hoàn thành phương trình phản ứng
Chuyển các hệ số từ quá trình oxi hóa khử vào phương trình phản ứng ban đầu. Cân bằng lại phương trình nếu cần thiết.
Ví dụ: Cân bằng phương trình: KMnO4 + HCl → KCl + MnCl2 + Cl2 + H2O
-
Xác định số oxi hóa:
- KMnO4: K(+1), Mn(+7), O(-2)
- HCl: H(+1), Cl(-1)
- KCl: K(+1), Cl(-1)
- MnCl2: Mn(+2), Cl(-1)
- Cl2: Cl(0)
- H2O: H(+1), O(-2)
- Vậy Mn và Cl có sự thay đổi số oxi hóa.
-
Viết quá trình oxi hóa và quá trình khử:
- Quá trình khử: Mn(+7) + 5e → Mn(+2)
- Quá trình oxi hóa: 2Cl(-1) → Cl2 + 2e
-
Cân bằng số electron:
- Nhân quá trình khử với 2: 2Mn(+7) + 10e → 2Mn(+2)
- Nhân quá trình oxi hóa với 5: 10Cl(-1) → 5Cl2 + 10e
-
Cộng hai quá trình:
- 2Mn(+7) + 10Cl(-1) → 2Mn(+2) + 5Cl2
-
Hoàn thành phương trình phản ứng:
- 2KMnO4 + 10HCl → 2KCl + 2MnCl2 + 5Cl2 + H2O
- Cân bằng lại H2O và HCl: 2KMnO4 + 16HCl → 2KCl + 2MnCl2 + 5Cl2 + 8H2O
Hình ảnh minh họa các bước cân bằng phương trình oxi hóa khử giúp người học dễ dàng nắm bắt và áp dụng vào các bài tập cụ thể.
4. Các Loại Phản Ứng Oxi Hóa Khử
Phản ứng oxi hóa khử có thể được phân loại theo nhiều cách khác nhau:
-
Phản ứng oxi hóa khử thông thường: Chất oxi hóa và chất khử là hai chất khác nhau.
Ví dụ: C + 4HNO3 → CO2 + 4NO2 + 2H2O
-
Phản ứng oxi hóa khử nội phân tử: Chất oxi hóa và chất khử cùng thuộc một phân tử nhưng ở hai nguyên tử khác nhau.
Ví dụ: NH4NO2 → N2 + 2H2O (Nitơ trong NH4+ đóng vai trò chất khử, nitơ trong NO2- đóng vai trò chất oxi hóa)
-
Phản ứng tự oxi hóa khử (tự phản ứng): Một chất vừa là chất oxi hóa, vừa là chất khử.
Ví dụ: Cl2 + 2NaOH → NaCl + NaClO + H2O (Clo vừa bị oxi hóa thành NaClO, vừa bị khử thành NaCl)
5. Ví Dụ Về Phản Ứng Oxi Hóa Khử Lớp 10
5.1. Phản ứng oxi hóa khử Al + HNO3
Trong phản ứng Al + HNO3, nhôm (Al) là chất khử và axit nitric (HNO3) là chất oxi hóa.
- Al nhường electron và bị oxi hóa thành Al3+
- Nitơ trong HNO3 nhận electron và bị khử thành các sản phẩm khác nhau, tùy thuộc vào điều kiện phản ứng (ví dụ: NO, NO2, N2O, NH4NO3).
Ví dụ: Al + 6HNO3 (đặc, nóng) → Al(NO3)3 + 3NO2 + 3H2O
5.2. Phản ứng oxi hóa khử KMnO4 + HCl
Trong phản ứng KMnO4 + HCl, kali pemanganat (KMnO4) là chất oxi hóa mạnh và axit clohidric (HCl) là chất khử.
- Mn trong KMnO4 nhận electron và bị khử thành Mn2+
- Clo trong HCl nhường electron và bị oxi hóa thành Cl2
Phương trình phản ứng: 2KMnO4 + 16HCl → 2KCl + 2MnCl2 + 5Cl2 + 8H2O
5.3. Phản ứng oxi hóa khử Cu + H2SO4
Trong phản ứng Cu + H2SO4, đồng (Cu) là chất khử và axit sulfuric (H2SO4) là chất oxi hóa.
- Cu nhường electron và bị oxi hóa thành Cu2+
- Lưu huỳnh trong H2SO4 nhận electron và bị khử thành SO2 (trong điều kiện đặc, nóng) hoặc S (trong điều kiện loãng).
Ví dụ: Cu + 2H2SO4 (đặc, nóng) → CuSO4 + SO2 + 2H2O
Hình ảnh này minh họa phản ứng oxi hóa khử giữa Cu và H2SO4, giúp học sinh hiểu rõ vai trò của chất khử và chất oxi hóa trong phản ứng.
6. 5 Bài Tập Phản Ứng Oxi Hóa Khử Lớp 10 (Có Lời Giải Chi Tiết)
Để củng cố kiến thức, hãy cùng làm một số bài tập về phản ứng oxi hóa khử:
Bài tập 1: Cho các phản ứng sau, phản ứng nào là phản ứng oxi hóa khử?
A. CaCO3 → CaO + CO2
B. 2KClO3 → 2KCl + 3O2
C. NaOH + HCl → NaCl + H2O
D. AgNO3 + NaCl → AgCl + NaNO3
Lời giải: Đáp án B. Trong phản ứng B, số oxi hóa của Clo và Oxi thay đổi.
Bài tập 2: Trong phản ứng nào sau đây, NH3 đóng vai trò là chất khử?
A. NH3 + HCl → NH4Cl
B. 4NH3 + 5O2 → 4NO + 6H2O
C. NH3 + H2O → NH4+ + OH-
D. NH3 + Ag+ → [Ag(NH3)2]+
Lời giải: Đáp án B. Trong phản ứng B, số oxi hóa của N trong NH3 tăng từ -3 lên +2.
Bài tập 3: Cho phản ứng: Fe + H2SO4 → FeSO4 + H2. Chất oxi hóa trong phản ứng này là:
A. Fe
B. H2SO4
C. FeSO4
D. H2
Lời giải: Đáp án B. Trong phản ứng này, H+ trong H2SO4 nhận electron và bị khử thành H2.
Bài tập 4: Cân bằng phương trình phản ứng sau bằng phương pháp thăng bằng electron: Fe + HNO3 → Fe(NO3)3 + NO + H2O
Lời giải:
- Quá trình oxi hóa: Fe → Fe3+ + 3e
- Quá trình khử: N+5 + 3e → N+2
- Phương trình cân bằng: Fe + 4HNO3 → Fe(NO3)3 + NO + 2H2O
Bài tập 5: Cho 11,2 gam Fe tác dụng hoàn toàn với dung dịch CuSO4 dư. Tính khối lượng Cu thu được sau phản ứng.
Lời giải:
- Số mol Fe = 11,2/56 = 0,2 mol
- Phương trình phản ứng: Fe + CuSO4 → FeSO4 + Cu
- Số mol Cu = số mol Fe = 0,2 mol
- Khối lượng Cu = 0,2 x 64 = 12,8 gam
Hình ảnh này cung cấp một ví dụ cụ thể về bài tập phản ứng oxi hóa khử, giúp học sinh nắm vững phương pháp giải và tự tin hơn khi làm bài.
7. Ứng Dụng Thực Tế Của Phản Ứng Oxi Hóa Khử
Phản ứng oxi hóa khử có vai trò vô cùng quan trọng trong nhiều lĩnh vực của đời sống và công nghiệp:
- Sản xuất điện: Pin và ắc quy hoạt động dựa trên các phản ứng oxi hóa khử để tạo ra dòng điện.
- Luyện kim: Các phản ứng oxi hóa khử được sử dụng để tách kim loại từ quặng.
- Sản xuất hóa chất: Nhiều hóa chất quan trọng được sản xuất thông qua các phản ứng oxi hóa khử, như axit sulfuric, amoniac, clo…
- Xử lý nước: Các chất oxi hóa như clo, ozon được sử dụng để khử trùng nước.
- Bảo quản thực phẩm: Các chất chống oxi hóa được thêm vào thực phẩm để ngăn chặn quá trình oxi hóa, giúp thực phẩm tươi lâu hơn.
- Y học: Các chất oxi hóa và khử được sử dụng trong nhiều loại thuốc và phương pháp điều trị.
- Năng lượng: Quá trình đốt cháy nhiên liệu (than, dầu, khí đốt) là các phản ứng oxi hóa khử, cung cấp năng lượng cho các hoạt động của con người.
- Bảo vệ môi trường: Các phản ứng oxi hóa khử được sử dụng để xử lý khí thải, nước thải, và các chất ô nhiễm khác.
Theo một báo cáo từ Bộ Khoa học và Công nghệ năm 2022, việc nghiên cứu và ứng dụng các phản ứng oxi hóa khử tiên tiến có thể giúp giải quyết nhiều vấn đề cấp bách của xã hội, như ô nhiễm môi trường, thiếu năng lượng, và bệnh tật.
8. Lợi Ích Khi Nắm Vững Kiến Thức Về Phản Ứng Oxi Hóa Khử
Việc nắm vững kiến thức về phản ứng oxi hóa khử mang lại nhiều lợi ích:
- Học tốt môn Hóa học: Phản ứng oxi hóa khử là một phần quan trọng của chương trình Hóa học phổ thông và đại học. Hiểu rõ về nó giúp bạn dễ dàng tiếp thu các kiến thức khác liên quan.
- Giải thích các hiện tượng tự nhiên: Phản ứng oxi hóa khử diễn ra ở khắp mọi nơi trong tự nhiên. Hiểu về nó giúp bạn giải thích được nhiều hiện tượng xung quanh, như quá trình hô hấp, quang hợp, ăn mòn kim loại…
- Ứng dụng vào thực tế: Kiến thức về phản ứng oxi hóa khử có thể được ứng dụng vào nhiều lĩnh vực của đời sống và công nghiệp.
- Phát triển tư duy: Học về phản ứng oxi hóa khử giúp bạn rèn luyện tư duy logic, khả năng phân tích, tổng hợp, và giải quyết vấn đề.
9. Các Nguồn Tài Liệu Tham Khảo Về Phản Ứng Oxi Hóa Khử Tại Tic.edu.vn
tic.edu.vn cung cấp đa dạng tài liệu và công cụ hỗ trợ học tập về phản ứng oxi hóa khử, bao gồm:
- Bài giảng chi tiết: Các bài giảng được trình bày một cách dễ hiểu, có ví dụ minh họa và bài tập thực hành.
- Bài tập trắc nghiệm: Giúp bạn kiểm tra kiến thức và rèn luyện kỹ năng làm bài.
- Đề thi thử: Giúp bạn làm quen với cấu trúc đề thi và rèn luyện tốc độ làm bài.
- Diễn đàn hỏi đáp: Nơi bạn có thể đặt câu hỏi và nhận được sự giải đáp từ các thầy cô giáo và các bạn học sinh khác.
- Công cụ tính toán: Giúp bạn cân bằng phương trình phản ứng oxi hóa khử một cách nhanh chóng và chính xác.
Với nguồn tài liệu phong phú và đa dạng, tic.edu.vn là người bạn đồng hành tin cậy trên con đường chinh phục môn Hóa học.
10. Câu Hỏi Thường Gặp Về Phản Ứng Oxi Hóa Khử (FAQ)
-
Làm thế nào để xác định chất oxi hóa và chất khử trong một phản ứng?
- Xác định số oxi hóa của các nguyên tố trước và sau phản ứng. Chất nào có số oxi hóa giảm là chất oxi hóa, chất nào có số oxi hóa tăng là chất khử.
-
Phản ứng trung hòa có phải là phản ứng oxi hóa khử không?
- Không, phản ứng trung hòa (ví dụ: axit + bazơ → muối + nước) không phải là phản ứng oxi hóa khử vì không có sự thay đổi số oxi hóa của các nguyên tố.
-
Làm thế nào để cân bằng phương trình phản ứng oxi hóa khử?
- Sử dụng phương pháp thăng bằng electron hoặc phương pháp ion-electron.
-
Phản ứng oxi hóa khử có vai trò gì trong đời sống?
- Phản ứng oxi hóa khử có vai trò quan trọng trong nhiều lĩnh vực, như sản xuất điện, luyện kim, sản xuất hóa chất, xử lý nước, bảo quản thực phẩm, y học, năng lượng, và bảo vệ môi trường.
-
Tại sao cần phải học về phản ứng oxi hóa khử?
- Học về phản ứng oxi hóa khử giúp bạn học tốt môn Hóa học, giải thích các hiện tượng tự nhiên, ứng dụng vào thực tế, và phát triển tư duy.
-
Tìm tài liệu về phản ứng oxi hóa khử ở đâu trên tic.edu.vn?
- Bạn có thể tìm thấy các bài giảng chi tiết, bài tập trắc nghiệm, đề thi thử, diễn đàn hỏi đáp, và công cụ tính toán về phản ứng oxi hóa khử trên tic.edu.vn.
-
Phản ứng oxi hóa khử nào quan trọng nhất trong cơ thể sống?
- Quá trình hô hấp tế bào, trong đó glucose bị oxi hóa để tạo ra năng lượng, là một phản ứng oxi hóa khử vô cùng quan trọng.
-
Chất xúc tác có ảnh hưởng đến phản ứng oxi hóa khử không?
- Có, chất xúc tác có thể làm tăng tốc độ của phản ứng oxi hóa khử mà không bị tiêu thụ trong quá trình phản ứng.
-
Ứng dụng của phản ứng oxi hóa khử trong công nghiệp luyện kim là gì?
- Phản ứng oxi hóa khử được sử dụng để khử các oxit kim loại thành kim loại tự do, ví dụ như trong quá trình sản xuất gang thép.
-
Làm thế nào để phân biệt phản ứng oxi hóa khử nội phân tử và phản ứng tự oxi hóa khử?
- Trong phản ứng oxi hóa khử nội phân tử, chất oxi hóa và chất khử nằm trong cùng một phân tử nhưng ở các nguyên tử khác nhau. Trong phản ứng tự oxi hóa khử, một chất vừa đóng vai trò là chất oxi hóa, vừa đóng vai trò là chất khử.
Bạn đang gặp khó khăn trong việc tìm kiếm tài liệu học tập chất lượng, mất thời gian tổng hợp thông tin, và mong muốn có một cộng đồng học tập sôi nổi? Hãy truy cập tic.edu.vn ngay hôm nay để khám phá nguồn tài liệu học tập phong phú, các công cụ hỗ trợ hiệu quả, và kết nối với cộng đồng học tập năng động. Đừng bỏ lỡ cơ hội nâng cao kiến thức và phát triển kỹ năng cùng tic.edu.vn!
Liên hệ với chúng tôi qua email: tic.edu@gmail.com hoặc truy cập trang web: tic.edu.vn để biết thêm chi tiết.