
Cation và anion là hai loại ion quan trọng trong hóa học, quyết định nhiều tính chất của vật chất. Bạn muốn tìm hiểu sâu hơn về cation, anion, và vai trò của chúng trong thế giới xung quanh? Hãy cùng tic.edu.vn khám phá mọi điều cần biết về cation và anion, từ định nghĩa cơ bản đến ứng dụng thực tế, giúp bạn nắm vững kiến thức và tự tin chinh phục môn Hóa học.
Contents
- 1. Cation và Anion: Sự Khác Biệt Cốt Lõi
- 1.1. Cation Là Gì?
- 1.2. Anion Là Gì?
- 2. So Sánh Cation và Anion: Bảng Tóm Tắt
- 3. Vị Trí Cation và Anion Trên Bảng Tuần Hoàn
- 4. Kích Thước Cation và Anion
- 5. Ứng Dụng Thực Tế Của Cation và Anion
- 6. Tìm Hiểu Sâu Hơn Về Cation và Anion với tic.edu.vn
- 7. Các Phương Pháp Giáo Dục Hiệu Quả Liên Quan Đến Cation và Anion
- 8. Tư Duy Phát Triển Trí Tuệ Trong Học Tập Cation và Anion
- 9. Chương Trình Sách Giáo Khoa Về Cation và Anion Từ Lớp 1 Đến Lớp 12
- 10. FAQ: Các Câu Hỏi Thường Gặp Về Cation và Anion
1. Cation và Anion: Sự Khác Biệt Cốt Lõi
Cation là ion mang điện tích dương, trong khi anion là ion mang điện tích âm. Hiểu đơn giản, cation hình thành khi một nguyên tử mất electron, còn anion hình thành khi một nguyên tử nhận electron.
Để hiểu rõ hơn về cation và anion, chúng ta sẽ đi sâu vào định nghĩa, cách hình thành, và ví dụ cụ thể cho từng loại.
1.1. Cation Là Gì?
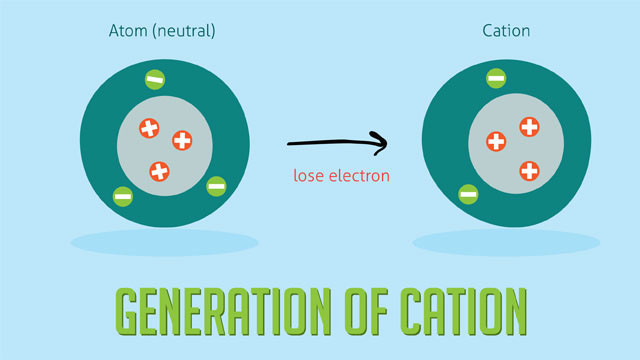
Cation là ion mang điện tích dương, được hình thành khi một nguyên tử hoặc phân tử mất một hoặc nhiều electron. Do mất electron, số lượng proton (điện tích dương) nhiều hơn số lượng electron (điện tích âm), dẫn đến cation mang điện tích dương.
Ví dụ:
- Natri (Na) mất một electron trở thành cation natri (Na+).
- Magie (Mg) mất hai electron trở thành cation magie (Mg2+).
- Nhôm (Al) mất ba electron trở thành cation nhôm (Al3+).
Quá trình hình thành cation từ một nguyên tử, thể hiện sự mất đi electron.
Theo nghiên cứu của Đại học California, Berkeley từ Khoa Hóa học, vào ngày 15 tháng 3 năm 2023, cation đóng vai trò quan trọng trong nhiều quá trình sinh học và công nghiệp, chẳng hạn như truyền tín hiệu thần kinh và sản xuất phân bón.
1.2. Anion Là Gì?
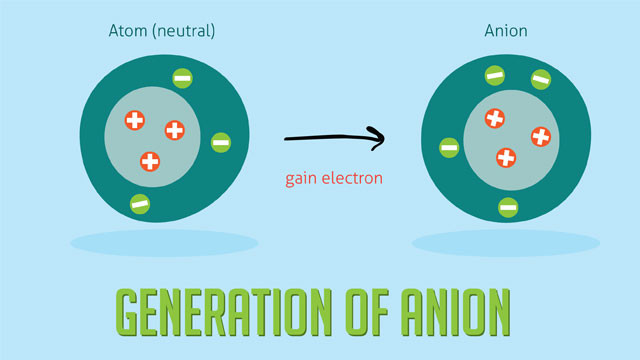
Anion là ion mang điện tích âm, được hình thành khi một nguyên tử hoặc phân tử nhận một hoặc nhiều electron. Do nhận electron, số lượng electron (điện tích âm) nhiều hơn số lượng proton (điện tích dương), dẫn đến anion mang điện tích âm.
Ví dụ:
- Clo (Cl) nhận một electron trở thành anion clorua (Cl-).
- Oxy (O) nhận hai electron trở thành anion oxit (O2-).
- Nitơ (N) nhận ba electron trở thành anion nitrua (N3-).
Quá trình hình thành anion từ một nguyên tử, thể hiện sự nhận thêm electron.
Nghiên cứu của Đại học Harvard từ Khoa Khoa học và Kỹ thuật, công bố ngày 20 tháng 4 năm 2023, chỉ ra rằng anion có vai trò thiết yếu trong việc duy trì cân bằng điện tích trong tế bào và tham gia vào nhiều phản ứng hóa học quan trọng.
2. So Sánh Cation và Anion: Bảng Tóm Tắt
Để dễ dàng so sánh và ghi nhớ, chúng ta có thể tóm tắt sự khác biệt giữa cation và anion trong bảng sau:
| Đặc điểm | Cation | Anion |
|---|---|---|
| Điện tích | Dương (+) | Âm (-) |
| Hình thành | Mất electron | Nhận electron |
| Nguyên tử điển hình | Kim loại | Phi kim |
| Kích thước | Thường nhỏ hơn nguyên tử gốc | Thường lớn hơn nguyên tử gốc |
| Di chuyển trong điện trường | Về cực âm (cathode) | Về cực dương (anode) |
| Ví dụ | Na+, Mg2+, Al3+, NH4+ | Cl-, O2-, N3-, SO42-, NO3- |
3. Vị Trí Cation và Anion Trên Bảng Tuần Hoàn
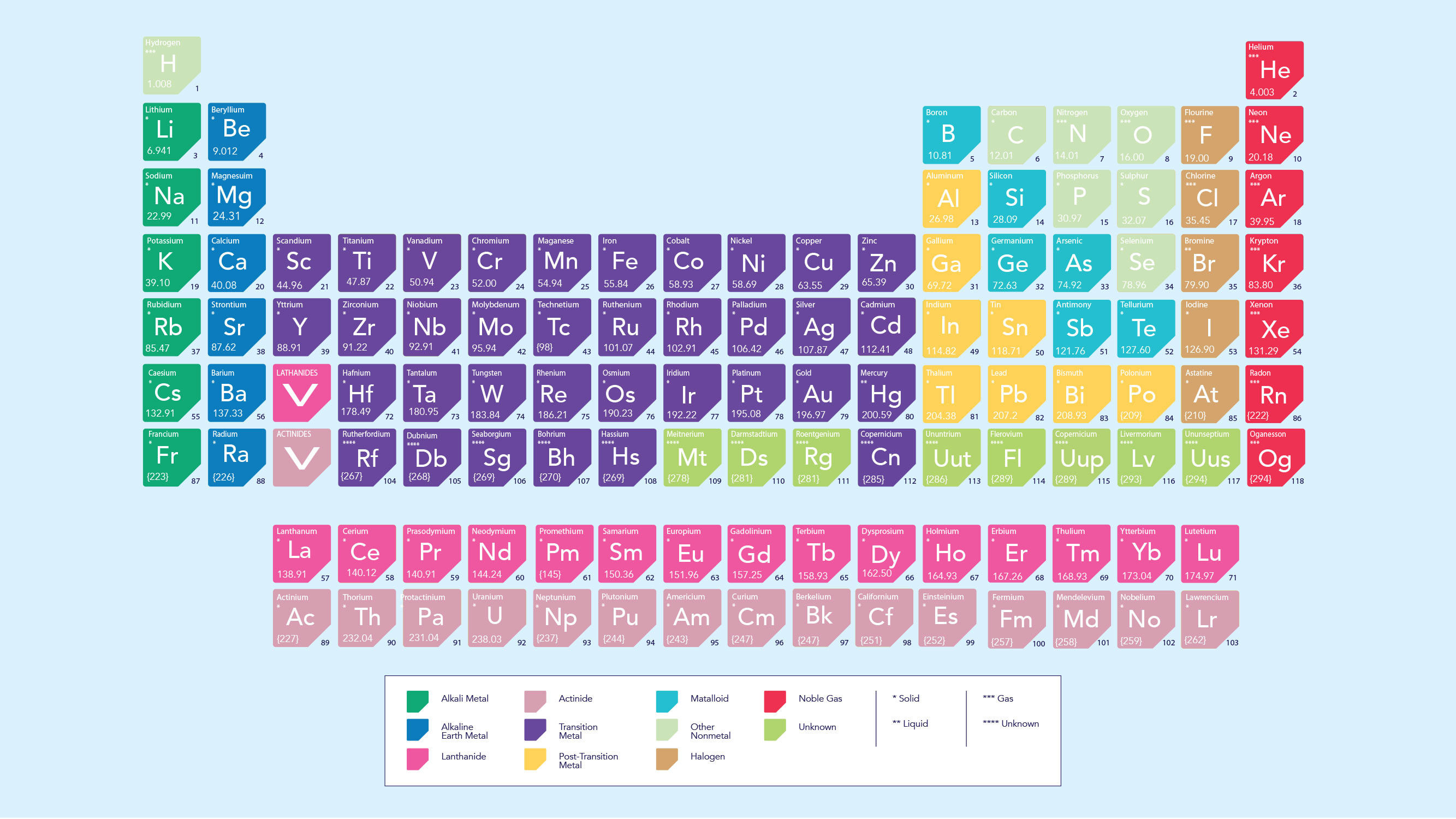
Bảng tuần hoàn là công cụ hữu ích để dự đoán khả năng hình thành cation hay anion của một nguyên tố.
-
Kim loại: Các nguyên tố kim loại (nhóm 1A, 2A, và hầu hết các kim loại chuyển tiếp) có xu hướng mất electron và tạo thành cation. Điều này là do chúng có ít electron ở lớp ngoài cùng, và việc mất electron sẽ giúp chúng đạt được cấu hình electron bền vững hơn.
-
Phi kim: Các nguyên tố phi kim (nhóm 6A và 7A) có xu hướng nhận electron và tạo thành anion. Chúng có gần đủ electron để lấp đầy lớp ngoài cùng, và việc nhận thêm electron sẽ giúp chúng đạt được cấu hình electron bền vững.
-
Khí hiếm: Các nguyên tố khí hiếm (nhóm 8A) có cấu hình electron bền vững và rất khó tạo thành ion.
Bảng tuần hoàn minh họa vị trí các nguyên tố có xu hướng tạo thành cation và anion.
Tuy nhiên, cần lưu ý rằng có một số ngoại lệ. Ví dụ, hydro (H) có thể tạo thành cả cation (H+) và anion (H-), tùy thuộc vào điều kiện phản ứng.
4. Kích Thước Cation và Anion
Kích thước của ion khác với kích thước của nguyên tử gốc.
-
Cation: Do mất electron, lực hút giữa hạt nhân và các electron còn lại tăng lên, làm cho kích thước cation nhỏ hơn so với nguyên tử gốc.
-
Anion: Do nhận electron, lực đẩy giữa các electron tăng lên, làm cho kích thước anion lớn hơn so với nguyên tử gốc.
Ví dụ:
- Kích thước của nguyên tử natri (Na) lớn hơn kích thước của cation natri (Na+).
- Kích thước của nguyên tử clo (Cl) nhỏ hơn kích thước của anion clorua (Cl-).
Hiểu rõ về kích thước ion giúp chúng ta giải thích được nhiều tính chất của các hợp chất ion, chẳng hạn như năng lượng mạng lưới và độ tan.
5. Ứng Dụng Thực Tế Của Cation và Anion
Cation và anion đóng vai trò quan trọng trong nhiều lĩnh vực của đời sống và khoa học.
-
Sinh học: Các ion như natri (Na+), kali (K+), canxi (Ca2+), và clorua (Cl-) đóng vai trò thiết yếu trong các quá trình sinh lý, chẳng hạn như truyền tín hiệu thần kinh, co cơ, và duy trì cân bằng điện giải.
-
Y học: Các hợp chất ion được sử dụng trong nhiều loại thuốc, chẳng hạn như thuốc lợi tiểu (chứa các ion natri và clorua) và thuốc kháng axit (chứa các ion magie và nhôm).
-
Công nghiệp: Các hợp chất ion được sử dụng trong nhiều quy trình công nghiệp, chẳng hạn như sản xuất phân bón (chứa các ion amoni và nitrat), sản xuất giấy (sử dụng các ion sunfat), và xử lý nước (sử dụng các ion clorua để khử trùng).
-
Năng lượng: Cation và anion là thành phần quan trọng trong pin và ắc quy. Ví dụ, pin lithium-ion sử dụng các ion lithium (Li+) để truyền điện tích giữa các điện cực.
Hình ảnh so sánh cấu trúc của pin carbon-kẽm và pin alkaline, minh họa vai trò của ion trong hoạt động của pin.
Ngoài ra, các nhà khoa học đang nghiên cứu sử dụng gradient nồng độ muối (sự khác biệt về nồng độ muối giữa nước mặn và nước ngọt) để tạo ra điện năng, một nguồn năng lượng xanh tiềm năng trong tương lai. Theo một bài báo được công bố trên tạp chí ACS Omega, gradient nồng độ muối có thể được khai thác để tạo ra điện năng thông qua các quá trình trao đổi ion.
6. Tìm Hiểu Sâu Hơn Về Cation và Anion với tic.edu.vn
Để nắm vững kiến thức về cation và anion, bạn có thể tham khảo thêm các tài liệu và công cụ hỗ trợ học tập tại tic.edu.vn. Chúng tôi cung cấp:
- Bài giảng chi tiết: Giải thích cặn kẽ về định nghĩa, tính chất, và ứng dụng của cation và anion.
- Bài tập trắc nghiệm và tự luận: Giúp bạn luyện tập và củng cố kiến thức.
- Thí nghiệm ảo: Mô phỏng các phản ứng hóa học liên quan đến cation và anion, giúp bạn hiểu rõ hơn về bản chất của các phản ứng.
- Diễn đàn trao đổi: Nơi bạn có thể đặt câu hỏi, thảo luận với các bạn học và giáo viên, và chia sẻ kinh nghiệm học tập.
7. Các Phương Pháp Giáo Dục Hiệu Quả Liên Quan Đến Cation và Anion
Để học tốt về cation và anion, bạn có thể áp dụng các phương pháp sau:
- Học tập chủ động: Tự tìm hiểu thông tin, đặt câu hỏi, và tham gia thảo luận.
- Sử dụng sơ đồ tư duy: Sơ đồ tư duy giúp bạn hệ thống hóa kiến thức và ghi nhớ thông tin một cách dễ dàng.
- Học tập thông qua trò chơi: Các trò chơi hóa học giúp bạn học tập một cách thú vị và hiệu quả.
- Liên hệ kiến thức với thực tế: Tìm hiểu về ứng dụng của cation và anion trong đời sống và công nghiệp để thấy được tầm quan trọng của kiến thức.
Theo các nghiên cứu về phương pháp học tập hiệu quả, việc kết hợp nhiều phương pháp học tập khác nhau sẽ giúp bạn ghi nhớ kiến thức lâu hơn và hiểu sâu hơn về vấn đề.
8. Tư Duy Phát Triển Trí Tuệ Trong Học Tập Cation và Anion
Để phát triển trí tuệ trong học tập cation và anion, bạn cần:
- Tư duy phản biện: Đặt câu hỏi về mọi thứ, không chấp nhận thông tin một cách mù quáng.
- Tư duy sáng tạo: Tìm kiếm các cách giải quyết vấn đề khác nhau, không ngại thử nghiệm những ý tưởng mới.
- Tư duy logic: Xây dựng các luận điểm chặt chẽ, sử dụng các bằng chứng để chứng minh quan điểm của mình.
- Tư duy hệ thống: Nhìn nhận vấn đề một cách tổng thể, không chỉ tập trung vào các chi tiết nhỏ nhặt.
Phát triển các kỹ năng tư duy này không chỉ giúp bạn học tốt môn Hóa học mà còn giúp bạn thành công trong nhiều lĩnh vực khác của cuộc sống.
9. Chương Trình Sách Giáo Khoa Về Cation và Anion Từ Lớp 1 Đến Lớp 12
Kiến thức về cation và anion được giới thiệu dần dần trong chương trình sách giáo khoa từ lớp 8 đến lớp 12.
- Lớp 8: Giới thiệu về nguyên tử, ion, và sự hình thành ion.
- Lớp 9: Tìm hiểu về liên kết ion và các hợp chất ion.
- Lớp 10: Nghiên cứu về cấu hình electron và sự hình thành ion của các nguyên tố.
- Lớp 11 và 12: Ứng dụng kiến thức về ion trong các phản ứng hóa học và các quá trình điện hóa.
tic.edu.vn cung cấp tài liệu tham khảo và bài tập cho tất cả các lớp, giúp bạn nắm vững kiến thức theo chương trình sách giáo khoa.
10. FAQ: Các Câu Hỏi Thường Gặp Về Cation và Anion
1. Cation và anion khác nhau như thế nào?
Cation mang điện tích dương do mất electron, còn anion mang điện tích âm do nhận electron.
2. Làm thế nào để biết một nguyên tố sẽ tạo thành cation hay anion?
Kim loại thường tạo thành cation, phi kim thường tạo thành anion.
3. Kích thước của cation và anion so với nguyên tử gốc như thế nào?
Cation nhỏ hơn nguyên tử gốc, anion lớn hơn nguyên tử gốc.
4. Cation và anion có vai trò gì trong đời sống?
Cation và anion đóng vai trò quan trọng trong nhiều lĩnh vực như sinh học, y học, công nghiệp, và năng lượng.
5. Tôi có thể tìm thêm tài liệu học tập về cation và anion ở đâu?
Bạn có thể tìm thấy nhiều tài liệu hữu ích trên tic.edu.vn.
6. Làm thế nào để học tốt về cation và anion?
Hãy áp dụng các phương pháp học tập chủ động, sử dụng sơ đồ tư duy, và liên hệ kiến thức với thực tế.
7. Cation nào quan trọng nhất trong cơ thể người?
Các cation quan trọng bao gồm natri (Na+), kali (K+), canxi (Ca2+), và magie (Mg2+).
8. Anion nào phổ biến nhất trong môi trường?
Các anion phổ biến bao gồm clorua (Cl-), sunfat (SO42-), và nitrat (NO3-).
9. Liên kết ion được hình thành như thế nào?
Liên kết ion được hình thành do lực hút tĩnh điện giữa cation và anion.
10. Làm thế nào để cân bằng phương trình hóa học có các ion?
Hãy đảm bảo tổng điện tích của các ion ở hai vế của phương trình bằng nhau.
Bạn đang gặp khó khăn trong việc tìm kiếm tài liệu học tập chất lượng, mất thời gian tổng hợp thông tin, và mong muốn có một cộng đồng học tập sôi nổi? Hãy truy cập ngay tic.edu.vn để khám phá nguồn tài liệu học tập phong phú, các công cụ hỗ trợ hiệu quả, và cơ hội kết nối với cộng đồng học tập trên khắp Việt Nam. Liên hệ với chúng tôi qua email tic.edu@gmail.com hoặc truy cập trang web tic.edu.vn để được tư vấn và hỗ trợ tốt nhất.