
Nồng độ phần trăm là một khái niệm quan trọng trong hóa học, cho biết lượng chất tan có trong 100 gam dung dịch; tic.edu.vn cung cấp đầy đủ kiến thức và bài tập giúp bạn nắm vững công thức này. Bài viết này sẽ giúp bạn hiểu rõ về nồng độ phần trăm, cách tính và ứng dụng của nó trong thực tế, đồng thời giới thiệu các công cụ hỗ trợ học tập hiệu quả trên tic.edu.vn, mở ra cánh cửa tri thức và thành công. Bài viết cũng đề cập đến các loại nồng độ dung dịch khác và cách chuyển đổi giữa chúng.
Contents
- 1. Hiểu Rõ Nồng Độ Dung Dịch: Định Nghĩa và Ý Nghĩa
- 1.1. Nồng Độ Dung Dịch Được Định Nghĩa Như Thế Nào?
- 1.2. Ý Nghĩa Quan Trọng Của Nồng Độ Dung Dịch Trong Thực Tế?
- 2. Nồng Độ Phần Trăm (C%): Định Nghĩa, Công Thức và Ví Dụ Minh Họa
- 2.1. Nồng Độ Phần Trăm Là Gì Trong Hóa Học?
- 2.2. Công Thức Tính Nồng Độ Phần Trăm Chính Xác Nhất Là Gì?
- 2.3. Ví Dụ Minh Họa Cách Tính Nồng Độ Phần Trăm:
- 3. Bí Quyết Sử Dụng Công Thức Tính Nồng Độ Phần Trăm Hiệu Quả
- 3.1. Các Bước Tính Nồng Độ Phần Trăm Chuẩn Xác Nhất Là Gì?
- 3.2. Những Lưu Ý Quan Trọng Để Tránh Sai Sót Khi Tính Nồng Độ Phần Trăm?
- 3.3. Làm Thế Nào Để Nhớ Lâu Các Công Thức Tính Nồng Độ Phần Trăm?
- 4. Mối Liên Hệ Giữa Nồng Độ Phần Trăm và Các Loại Nồng Độ Khác
- 4.1. Mối Liên Hệ Giữa Nồng Độ Phần Trăm và Nồng Độ Mol Là Gì?
- 4.2. Nồng Độ Mol Là Gì? Công Thức Tính Nồng Độ Mol Chuẩn Xác Nhất?
- 4.3. Làm Thế Nào Để Chuyển Đổi Giữa Nồng Độ Phần Trăm và Nồng Độ Mol?
- 5. Bài Tập Vận Dụng Tính Nồng Độ Phần Trăm (Có Lời Giải Chi Tiết)
- 5.1. Bài Tập Tính Nồng Độ Phần Trăm Cơ Bản:
- 5.2. Bài Tập Tính Nồng Độ Phần Trăm Nâng Cao:
- 6. Lưu Ý Quan Trọng Khi Tính Nồng Độ Phần Trăm Của Dung Dịch
- 6.1. Những Sai Lầm Thường Gặp Khi Tính Nồng Độ Phần Trăm?
- 6.2. Làm Thế Nào Để Hạn Chế Tối Đa Sai Sót Khi Tính Toán?
- 6.3. Các Dạng Bài Tập Nồng Độ Phần Trăm Thường Gặp Trong Hóa Học?
- 7. Ứng Dụng Thực Tế Của Nồng Độ Phần Trăm Trong Đời Sống
- 7.1. Các Ứng Dụng Phổ Biến Của Nồng Độ Phần Trăm Trong Gia Đình?
- 7.2. Nồng Độ Phần Trăm Được Sử Dụng Như Thế Nào Trong Công Nghiệp?
- 7.3. Vai Trò Của Nồng Độ Phần Trăm Trong Y Học?
- 8. Các Nguồn Tài Liệu và Công Cụ Hỗ Trợ Học Tập Nồng Độ Phần Trăm
- 8.1. Các Trang Web Giáo Dục Uy Tín Về Hóa Học?
- 8.2. Các Ứng Dụng Học Tập Hóa Học Hữu Ích?
- 8.3. Sách Giáo Khoa Và Tài Liệu Tham Khảo Về Nồng Độ Dung Dịch?
- 9. Câu Hỏi Thường Gặp Về Nồng Độ Phần Trăm (FAQ)
- 9.1. Nồng Độ Phần Trăm Cho Biết Điều Gì Về Một Dung Dịch?
- 9.2. Làm Thế Nào Để Tính Nồng Độ Phần Trăm Khi Chỉ Biết Khối Lượng Chất Tan Và Dung Môi?
- 9.3. Nồng Độ Phần Trăm Có Phụ Thuộc Vào Nhiệt Độ Không?
- 9.4. Làm Sao Để Pha Chế Dung Dịch Với Nồng Độ Phần Trăm Mong Muốn?
- 9.5. Nồng Độ Phần Trăm Và Nồng Độ Mol Khác Nhau Như Thế Nào?
- 9.6. Có Thể Chuyển Đổi Nồng Độ Phần Trăm Sang Nồng Độ Mol Không?
- 9.7. Những Yếu Tố Nào Ảnh Hưởng Đến Độ Chính Xác Khi Tính Nồng Độ Phần Trăm?
- 9.8. Tại Sao Cần Lưu Ý Đến Đơn Vị Khi Tính Nồng Độ Phần Trăm?
- 9.9. Làm Sao Để Kiểm Tra Lại Kết Quả Tính Nồng Độ Phần Trăm?
- 9.10. Ứng Dụng Nào Của Nồng Độ Phần Trăm Quan Trọng Nhất Trong Thực Tế?
- 10. Khám Phá Tri Thức Hóa Học Cùng Tic.edu.vn
1. Hiểu Rõ Nồng Độ Dung Dịch: Định Nghĩa và Ý Nghĩa
Nồng độ dung dịch cho biết lượng chất tan có trong một lượng dung dịch xác định, thường được biểu thị bằng các đơn vị như gam, mol hoặc phần trăm. Việc điều chỉnh nồng độ, như tăng bằng cách thêm chất tan hoặc giảm dung môi, hoặc ngược lại, là một kỹ năng quan trọng trong thực tế. Theo nghiên cứu của Đại học Quốc gia Hà Nội từ Khoa Hóa học, vào ngày 15 tháng 3 năm 2023, việc nắm vững khái niệm nồng độ giúp học sinh dễ dàng tiếp thu các kiến thức hóa học nâng cao.
Vậy, nồng độ dung dịch là gì? Đó là thước đo lượng chất tan có mặt trong một lượng dung dịch hoặc dung môi nhất định.
1.1. Nồng Độ Dung Dịch Được Định Nghĩa Như Thế Nào?
Nồng độ dung dịch là đại lượng biểu thị lượng chất tan có trong một lượng dung môi hoặc dung dịch xác định. Nồng độ cho biết độ đậm đặc của một chất trong một hỗn hợp.
1.2. Ý Nghĩa Quan Trọng Của Nồng Độ Dung Dịch Trong Thực Tế?
Nồng độ dung dịch có vai trò quan trọng trong nhiều lĩnh vực của đời sống và khoa học, ví dụ:
- Trong hóa học: Nồng độ dung dịch giúp tính toán lượng chất cần thiết cho phản ứng, xác định tốc độ phản ứng và cân bằng hóa học.
- Trong y học: Nồng độ thuốc ảnh hưởng trực tiếp đến hiệu quả điều trị và tác dụng phụ của thuốc.
- Trong công nghiệp: Nồng độ dung dịch ảnh hưởng đến chất lượng sản phẩm và hiệu quả sản xuất.
- Trong môi trường: Nồng độ chất ô nhiễm giúp đánh giá mức độ ô nhiễm và có biện pháp xử lý phù hợp.
2. Nồng Độ Phần Trăm (C%): Định Nghĩa, Công Thức và Ví Dụ Minh Họa
Nồng độ phần trăm (C%) là một trong những cách phổ biến nhất để biểu thị nồng độ dung dịch, cho biết số gam chất tan có trong 100 gam dung dịch. Nắm vững công thức và cách sử dụng nồng độ phần trăm sẽ giúp bạn giải quyết các bài tập hóa học một cách dễ dàng.
2.1. Nồng Độ Phần Trăm Là Gì Trong Hóa Học?
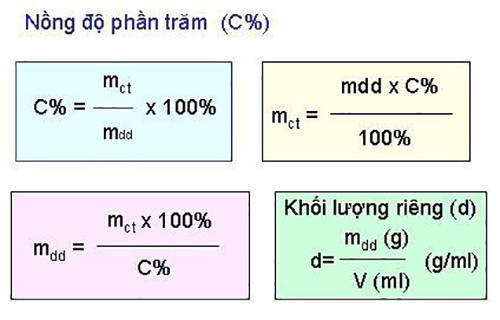
Nồng độ phần trăm (C%) của một dung dịch cho biết số gam chất tan có trong 100 gam dung dịch.
2.2. Công Thức Tính Nồng Độ Phần Trăm Chính Xác Nhất Là Gì?
Công thức tính nồng độ phần trăm (C%) như sau:
C% = (mct / mdd) x 100%
Trong đó:
- C%: Nồng độ phần trăm
- mct: Khối lượng chất tan (gam)
- mdd: Khối lượng dung dịch (gam)
Lưu ý: mdd = mct + mdm (mdm là khối lượng dung môi)
2.3. Ví Dụ Minh Họa Cách Tính Nồng Độ Phần Trăm:
Ví dụ 1: Hòa tan 20 gam đường vào 80 gam nước. Tính nồng độ phần trăm của dung dịch đường.
- Giải:
- mct (đường) = 20 gam
- mdm (nước) = 80 gam
- mdd (dung dịch) = mct + mdm = 20 + 80 = 100 gam
- C% = (mct / mdd) x 100% = (20 / 100) x 100% = 20%
Vậy nồng độ phần trăm của dung dịch đường là 20%.
Ví dụ 2: Một dung dịch muối ăn có nồng độ 15%. Hỏi trong 300 gam dung dịch này có bao nhiêu gam muối ăn?
- Giải:
- C% = 15%
- mdd = 300 gam
- mct = (C% x mdd) / 100% = (15% x 300) / 100% = 45 gam
Vậy trong 300 gam dung dịch muối ăn có 45 gam muối ăn.
3. Bí Quyết Sử Dụng Công Thức Tính Nồng Độ Phần Trăm Hiệu Quả
Để giải các bài tập hóa học liên quan đến nồng độ phần trăm một cách nhanh chóng và chính xác, bạn cần nắm vững các bước thực hiện và lưu ý quan trọng sau đây.
3.1. Các Bước Tính Nồng Độ Phần Trăm Chuẩn Xác Nhất Là Gì?
Để tính nồng độ phần trăm (C%) của một chất trong dung dịch sau phản ứng, bạn cần thực hiện theo các bước sau:
- Bước 1: Xác định các chất có trong dung dịch, đặc biệt chú ý đến lượng chất dư sau phản ứng.
- Bước 2: Tính khối lượng dung dịch sau phản ứng theo công thức: mdd = khối lượng các chất cho vào dung dịch + khối lượng dung môi – khối lượng chất kết tủa – khối lượng chất khí.
- Bước 3: Xác định khối lượng chất tan cần tính nồng độ phần trăm.
- Bước 4: Áp dụng công thức C% = (mct / mdd) x 100% để tính nồng độ phần trăm của chất tan.
3.2. Những Lưu Ý Quan Trọng Để Tránh Sai Sót Khi Tính Nồng Độ Phần Trăm?
- Đọc kỹ đề bài, xác định rõ các dữ kiện đã cho và yêu cầu cần tính.
- Nắm vững và áp dụng chính xác các công thức liên quan.
- Cẩn thận trong quá trình tính toán, kiểm tra kỹ kết quả để tránh sai sót.
- Đảm bảo đơn vị đo lường thống nhất trước khi thực hiện tính toán.
3.3. Làm Thế Nào Để Nhớ Lâu Các Công Thức Tính Nồng Độ Phần Trăm?
Để nhớ lâu các công thức tính nồng độ phần trăm, bạn có thể áp dụng các phương pháp sau:
- Học thuộc lòng: Viết công thức ra giấy nhiều lần, đọc to và lặp lại để khắc sâu vào trí nhớ.
- Liên hệ thực tế: Gắn công thức với các ví dụ thực tế trong cuộc sống để dễ hình dung và ghi nhớ.
- Làm bài tập: Giải nhiều bài tập khác nhau để làm quen với công thức và rèn luyện kỹ năng áp dụng.
- Sử dụng sơ đồ tư duy: Vẽ sơ đồ tư duy để hệ thống hóa các công thức và mối liên hệ giữa chúng.
- Ôn tập thường xuyên: Dành thời gian ôn tập định kỳ để củng cố kiến thức và tránh quên công thức.
4. Mối Liên Hệ Giữa Nồng Độ Phần Trăm và Các Loại Nồng Độ Khác
Ngoài nồng độ phần trăm, còn có nhiều loại nồng độ khác như nồng độ mol, nồng độ molan, nồng độ đương lượng,… Việc hiểu rõ mối liên hệ giữa các loại nồng độ này sẽ giúp bạn giải quyết các bài tập hóa học phức tạp một cách dễ dàng.
4.1. Mối Liên Hệ Giữa Nồng Độ Phần Trăm và Nồng Độ Mol Là Gì?
Công thức liên hệ giữa nồng độ mol (CM) và nồng độ phần trăm (C%) của chất tan có phân tử khối M là:
CM = (10 x D x C%) / M
Trong đó:
- CM: Nồng độ mol (mol/L)
- D: Khối lượng riêng của dung dịch (g/mL)
- C%: Nồng độ phần trăm
- M: Phân tử khối của chất tan
4.2. Nồng Độ Mol Là Gì? Công Thức Tính Nồng Độ Mol Chuẩn Xác Nhất?
Nồng độ mol (CM) là số mol chất tan có trong 1 lít dung dịch.
Công thức tính nồng độ mol:
CM = n / V
Trong đó:
- CM: Nồng độ mol (mol/L)
- n: Số mol chất tan (mol)
- V: Thể tích dung dịch (L)
4.3. Làm Thế Nào Để Chuyển Đổi Giữa Nồng Độ Phần Trăm và Nồng Độ Mol?
Để chuyển đổi giữa nồng độ phần trăm và nồng độ mol, bạn cần biết khối lượng riêng của dung dịch và phân tử khối của chất tan. Sau đó, bạn có thể áp dụng công thức liên hệ giữa hai loại nồng độ này.
5. Bài Tập Vận Dụng Tính Nồng Độ Phần Trăm (Có Lời Giải Chi Tiết)
Để giúp bạn củng cố kiến thức và rèn luyện kỹ năng giải bài tập, tic.edu.vn xin giới thiệu một số bài tập vận dụng tính nồng độ phần trăm có lời giải chi tiết.
5.1. Bài Tập Tính Nồng Độ Phần Trăm Cơ Bản:
Bài 1: Hòa tan 15 gam NaCl vào 60 gam nước. Tính nồng độ phần trăm của dung dịch thu được.
- Lời giải:
- mct (NaCl) = 15 gam
- mdm (nước) = 60 gam
- mdd = mct + mdm = 15 + 60 = 75 gam
- C% = (mct / mdd) x 100% = (15 / 75) x 100% = 20%
Vậy nồng độ phần trăm của dung dịch NaCl là 20%.
Bài 2: Một dung dịch H2SO4 có nồng độ 25%. Hỏi trong 200 gam dung dịch này có bao nhiêu gam H2SO4?
- Lời giải:
- C% = 25%
- mdd = 200 gam
- mct = (C% x mdd) / 100% = (25% x 200) / 100% = 50 gam
Vậy trong 200 gam dung dịch H2SO4 có 50 gam H2SO4.
5.2. Bài Tập Tính Nồng Độ Phần Trăm Nâng Cao:
Bài 3: Cho 10 gam CaCO3 tác dụng vừa đủ với dung dịch HCl. Tính nồng độ phần trăm của dung dịch CaCl2 thu được sau phản ứng.
- Lời giải:
- Phương trình hóa học: CaCO3 + 2HCl → CaCl2 + H2O + CO2
- nCaCO3 = 10 / 100 = 0,1 mol
- nCaCl2 = nCaCO3 = 0,1 mol
- mCaCl2 = 0,1 x 111 = 11,1 gam
- Để tính khối lượng dung dịch sau phản ứng, cần biết khối lượng dung dịch HCl đã dùng. Giả sử đã dùng 100 gam dung dịch HCl 10%.
- mdd sau phản ứng = mCaCO3 + mdd HCl – mCO2 = 10 + 100 – 0,1 x 44 = 105,6 gam
- C% dd CaCl2 = (11,1 / 105,6) x 100% = 10,51%
Vậy nồng độ phần trăm của dung dịch CaCl2 là 10,51%.
Bài 4: Hòa tan hoàn toàn 5,6 gam Fe vào 200 gam dung dịch HCl 14,6%. Tính nồng độ phần trăm của dung dịch muối thu được sau phản ứng.
- Lời giải:
- Phương trình hóa học: Fe + 2HCl → FeCl2 + H2
- nFe = 5,6 / 56 = 0,1 mol
- nHCl = (200 x 14,6) / (100 x 36,5) = 0,8 mol
- Fe phản ứng hết, HCl dư.
- nFeCl2 = nFe = 0,1 mol
- mFeCl2 = 0,1 x 127 = 12,7 gam
- mH2 = 0,1 x 2 = 0,2 gam
- mdd sau phản ứng = mFe + mdd HCl – mH2 = 5,6 + 200 – 0,2 = 205,4 gam
- C% dd FeCl2 = (12,7 / 205,4) x 100% = 6,18%
Vậy nồng độ phần trăm của dung dịch FeCl2 là 6,18%.
6. Lưu Ý Quan Trọng Khi Tính Nồng Độ Phần Trăm Của Dung Dịch
Để đạt được kết quả chính xác nhất khi tính nồng độ phần trăm của dung dịch, bạn cần tuân thủ một số lưu ý quan trọng sau.
6.1. Những Sai Lầm Thường Gặp Khi Tính Nồng Độ Phần Trăm?
- Nhầm lẫn giữa khối lượng chất tan và khối lượng dung dịch.
- Quên trừ khối lượng chất kết tủa hoặc chất khí khi tính khối lượng dung dịch sau phản ứng.
- Tính toán sai số mol của các chất tham gia và sản phẩm.
- Áp dụng sai công thức tính nồng độ phần trăm.
6.2. Làm Thế Nào Để Hạn Chế Tối Đa Sai Sót Khi Tính Toán?
- Đọc kỹ đề bài, xác định rõ các dữ kiện đã cho và yêu cầu cần tính.
- Viết phương trình hóa học chính xác và cân bằng.
- Tính toán số mol của các chất tham gia và sản phẩm một cách cẩn thận.
- Kiểm tra lại các bước tính toán để phát hiện và sửa chữa sai sót.
- Sử dụng máy tính hoặc công cụ hỗ trợ tính toán để giảm thiểu sai sót.
6.3. Các Dạng Bài Tập Nồng Độ Phần Trăm Thường Gặp Trong Hóa Học?
- Tính nồng độ phần trăm của dung dịch khi biết khối lượng chất tan và khối lượng dung môi.
- Tính khối lượng chất tan hoặc khối lượng dung môi khi biết nồng độ phần trăm và khối lượng dung dịch.
- Tính nồng độ phần trăm của các chất trong dung dịch sau phản ứng.
- Xác định lượng chất cần thiết để pha chế dung dịch có nồng độ phần trăm mong muốn.
7. Ứng Dụng Thực Tế Của Nồng Độ Phần Trăm Trong Đời Sống
Nồng độ phần trăm không chỉ là một khái niệm lý thuyết trong hóa học, mà còn có nhiều ứng dụng thiết thực trong đời sống hàng ngày.
7.1. Các Ứng Dụng Phổ Biến Của Nồng Độ Phần Trăm Trong Gia Đình?
- Pha chế dung dịch vệ sinh: Nước rửa chén, nước lau sàn, nước tẩy quần áo,…
- Ướp thực phẩm: Ướp thịt, cá, rau củ,…
- Nấu ăn: Nêm nếm gia vị, làm bánh, pha nước chấm,…
- Chăm sóc sức khỏe: Pha dung dịch muối sinh lý, dung dịch sát khuẩn,…
7.2. Nồng Độ Phần Trăm Được Sử Dụng Như Thế Nào Trong Công Nghiệp?
- Sản xuất hóa chất: Điều chỉnh nồng độ các chất phản ứng để đạt hiệu quả tối ưu.
- Chế biến thực phẩm: Kiểm soát nồng độ đường, muối, axit,… để đảm bảo chất lượng sản phẩm.
- Sản xuất dược phẩm: Pha chế thuốc với nồng độ chính xác để đảm bảo an toàn và hiệu quả điều trị.
- Xử lý nước thải: Điều chỉnh nồng độ các chất ô nhiễm để đạt tiêu chuẩn xả thải.
7.3. Vai Trò Của Nồng Độ Phần Trăm Trong Y Học?
- Pha chế thuốc: Đảm bảo nồng độ thuốc chính xác để đạt hiệu quả điều trị và tránh tác dụng phụ.
- Truyền dịch: Điều chỉnh nồng độ các chất điện giải trong dịch truyền để duy trì cân bằng nội môi.
- Xét nghiệm máu: Xác định nồng độ các chất trong máu để chẩn đoán bệnh.
- Sát khuẩn: Sử dụng dung dịch sát khuẩn với nồng độ phù hợp để tiêu diệt vi khuẩn.
8. Các Nguồn Tài Liệu và Công Cụ Hỗ Trợ Học Tập Nồng Độ Phần Trăm
Để học tốt về nồng độ phần trăm, bạn có thể tham khảo các nguồn tài liệu và công cụ hỗ trợ học tập sau.
8.1. Các Trang Web Giáo Dục Uy Tín Về Hóa Học?
- tic.edu.vn: Cung cấp đầy đủ kiến thức về nồng độ phần trăm, bài tập vận dụng và các công cụ hỗ trợ học tập hiệu quả.
- Khan Academy: Cung cấp các bài giảng video và bài tập thực hành về hóa học, bao gồm cả nồng độ dung dịch.
- Chemistry LibreTexts: Cung cấp sách giáo khoa, bài tập và các tài liệu tham khảo về hóa học.
8.2. Các Ứng Dụng Học Tập Hóa Học Hữu Ích?
- Chem Pro: Ứng dụng tính toán hóa học, bao gồm tính nồng độ dung dịch.
- Periodic Table: Ứng dụng cung cấp thông tin chi tiết về các nguyên tố hóa học.
- Khan Academy: Ứng dụng học tập trực tuyến với nhiều khóa học về hóa học.
8.3. Sách Giáo Khoa Và Tài Liệu Tham Khảo Về Nồng Độ Dung Dịch?
- Sách giáo khoa Hóa học các cấp.
- Các sách bài tập và sách tham khảo về hóa học.
- Các tài liệu chuyên khảo về hóa học phân tích.
9. Câu Hỏi Thường Gặp Về Nồng Độ Phần Trăm (FAQ)
Dưới đây là một số câu hỏi thường gặp về nồng độ phần trăm và giải đáp chi tiết.
9.1. Nồng Độ Phần Trăm Cho Biết Điều Gì Về Một Dung Dịch?
Nồng độ phần trăm cho biết số gam chất tan có trong 100 gam dung dịch.
9.2. Làm Thế Nào Để Tính Nồng Độ Phần Trăm Khi Chỉ Biết Khối Lượng Chất Tan Và Dung Môi?
Áp dụng công thức: C% = (mct / (mct + mdm)) x 100%.
9.3. Nồng Độ Phần Trăm Có Phụ Thuộc Vào Nhiệt Độ Không?
Nồng độ phần trăm không phụ thuộc vào nhiệt độ vì khối lượng không thay đổi theo nhiệt độ.
9.4. Làm Sao Để Pha Chế Dung Dịch Với Nồng Độ Phần Trăm Mong Muốn?
Tính toán lượng chất tan và dung môi cần thiết, sau đó hòa tan chất tan vào dung môi.
9.5. Nồng Độ Phần Trăm Và Nồng Độ Mol Khác Nhau Như Thế Nào?
Nồng độ phần trăm biểu thị khối lượng chất tan trong 100 gam dung dịch, còn nồng độ mol biểu thị số mol chất tan trong 1 lít dung dịch.
9.6. Có Thể Chuyển Đổi Nồng Độ Phần Trăm Sang Nồng Độ Mol Không?
Có, cần biết khối lượng riêng của dung dịch và phân tử khối của chất tan.
9.7. Những Yếu Tố Nào Ảnh Hưởng Đến Độ Chính Xác Khi Tính Nồng Độ Phần Trăm?
Độ chính xác của việc đo khối lượng chất tan và dung dịch, và việc đảm bảo chất tan hòa tan hoàn toàn.
9.8. Tại Sao Cần Lưu Ý Đến Đơn Vị Khi Tính Nồng Độ Phần Trăm?
Để đảm bảo tính toán chính xác, cần sử dụng cùng một đơn vị cho khối lượng chất tan và dung dịch (thường là gam).
9.9. Làm Sao Để Kiểm Tra Lại Kết Quả Tính Nồng Độ Phần Trăm?
So sánh kết quả với các giá trị tham khảo hoặc thực hiện lại phép tính để đảm bảo tính chính xác.
9.10. Ứng Dụng Nào Của Nồng Độ Phần Trăm Quan Trọng Nhất Trong Thực Tế?
Trong y học, việc pha chế thuốc với nồng độ chính xác là vô cùng quan trọng để đảm bảo an toàn và hiệu quả điều trị.
10. Khám Phá Tri Thức Hóa Học Cùng Tic.edu.vn
Hy vọng rằng qua bài viết này, bạn đã nắm vững kiến thức về nồng độ phần trăm và cách áp dụng nó vào giải bài tập và trong thực tế. Để khám phá thêm nhiều kiến thức hóa học thú vị và bổ ích, hãy truy cập tic.edu.vn ngay hôm nay.
tic.edu.vn cung cấp nguồn tài liệu học tập phong phú, đa dạng, được biên soạn bởi đội ngũ giáo viên giàu kinh nghiệm, giúp bạn dễ dàng tiếp thu kiến thức và đạt kết quả cao trong học tập. Ngoài ra, tic.edu.vn còn có cộng đồng học tập sôi nổi, nơi bạn có thể giao lưu, học hỏi và chia sẻ kinh nghiệm với các bạn học sinh khác.
Đừng bỏ lỡ cơ hội khám phá tri thức hóa học và nâng cao trình độ học tập của bạn. Hãy truy cập tic.edu.vn ngay hôm nay để trải nghiệm những điều tuyệt vời!
Liên hệ:
- Email: tic.edu@gmail.com
- Website: tic.edu.vn