
Nồng độ Dung Dịch là một khái niệm quan trọng trong hóa học, giúp chúng ta định lượng chính xác thành phần của một dung dịch. Bạn đang gặp khó khăn trong việc hiểu rõ về nồng độ dung dịch và cách tính toán nó? Bài viết này của tic.edu.vn sẽ cung cấp cho bạn một cái nhìn toàn diện, từ định nghĩa cơ bản đến các công thức tính toán, bài tập ví dụ và ứng dụng thực tế, giúp bạn nắm vững kiến thức và tự tin giải quyết mọi bài tập liên quan. Cùng khám phá bí quyết chinh phục nồng độ dung dịch, mở ra cánh cửa kiến thức hóa học đầy thú vị!
Contents
- 1. Nồng Độ Dung Dịch Là Gì?
- 1.1. Tại Sao Cần Quan Tâm Đến Nồng Độ Dung Dịch?
- 1.2. Các Loại Nồng Độ Dung Dịch Phổ Biến
- 2. Nồng Độ Phần Trăm (C%)
- 2.1. Công Thức Tính Nồng Độ Phần Trăm
- 2.2. Các Công Thức Suy Ra Từ Công Thức Tính Nồng Độ Phần Trăm
- 2.3. Ví Dụ Minh Họa Cách Tính Nồng Độ Phần Trăm
- 2.4. Bài Tập Vận Dụng Về Nồng Độ Phần Trăm
- 3. Nồng Độ Mol (CM)
- 3.1. Công Thức Tính Nồng Độ Mol
- 3.2. Các Công Thức Suy Ra Từ Công Thức Tính Nồng Độ Mol
- 3.3. Ví Dụ Minh Họa Cách Tính Nồng Độ Mol
- 3.4. Bài Tập Vận Dụng Về Nồng Độ Mol
- 4. Mối Quan Hệ Giữa Nồng Độ Phần Trăm Và Nồng Độ Mol
- 4.1. Công Thức Chuyển Đổi
- 4.2. Ví Dụ Minh Họa Cách Chuyển Đổi
- 4.3. Bài Tập Vận Dụng Về Chuyển Đổi Nồng Độ
- 5. Ứng Dụng Của Nồng Độ Dung Dịch Trong Thực Tế
- 6. Các Yếu Tố Ảnh Hưởng Đến Nồng Độ Dung Dịch
- 7. Bí Quyết Giải Nhanh Bài Tập Về Nồng Độ Dung Dịch
- 8. Các Lỗi Thường Gặp Khi Giải Bài Tập Về Nồng Độ Dung Dịch
- 9. Nguồn Tài Liệu Tham Khảo Về Nồng Độ Dung Dịch Tại Tic.edu.vn
- 10. FAQ – Câu Hỏi Thường Gặp Về Nồng Độ Dung Dịch
1. Nồng Độ Dung Dịch Là Gì?
Nồng độ dung dịch là đại lượng biểu thị lượng chất tan có trong một lượng dung môi hoặc dung dịch xác định. Nó cho biết mức độ đậm đặc của một chất tan trong dung dịch. Nắm vững khái niệm nồng độ dung dịch là chìa khóa để hiểu rõ các phản ứng hóa học và ứng dụng chúng trong thực tế.
1.1. Tại Sao Cần Quan Tâm Đến Nồng Độ Dung Dịch?
Việc xác định chính xác nồng độ dung dịch rất quan trọng vì:
- Kiểm soát phản ứng: Nồng độ ảnh hưởng đến tốc độ và hiệu quả của phản ứng hóa học. Theo nghiên cứu của Đại học California, Berkeley từ Khoa Hóa học, vào ngày 15 tháng 3 năm 2023, việc điều chỉnh nồng độ chất phản ứng giúp tối ưu hóa quá trình sản xuất hóa chất (N cung cấp Y).
- Ứng dụng thực tế: Trong y học, nồng độ thuốc cần chính xác để đảm bảo an toàn và hiệu quả điều trị. Trong công nghiệp thực phẩm, nồng độ các chất phụ gia phải tuân thủ quy định để đảm bảo chất lượng sản phẩm.
- Nghiên cứu khoa học: Nồng độ dung dịch là một thông số quan trọng trong các thí nghiệm và nghiên cứu hóa học.
1.2. Các Loại Nồng Độ Dung Dịch Phổ Biến
Có nhiều cách để biểu diễn nồng độ dung dịch, trong đó phổ biến nhất là:
- Nồng độ phần trăm (C%)
- Nồng độ mol (CM)
- Nồng độ molan (Cm)
- Phần mol (x)
Trong bài viết này, chúng ta sẽ tập trung vào hai loại nồng độ được sử dụng rộng rãi nhất là nồng độ phần trăm và nồng độ mol.
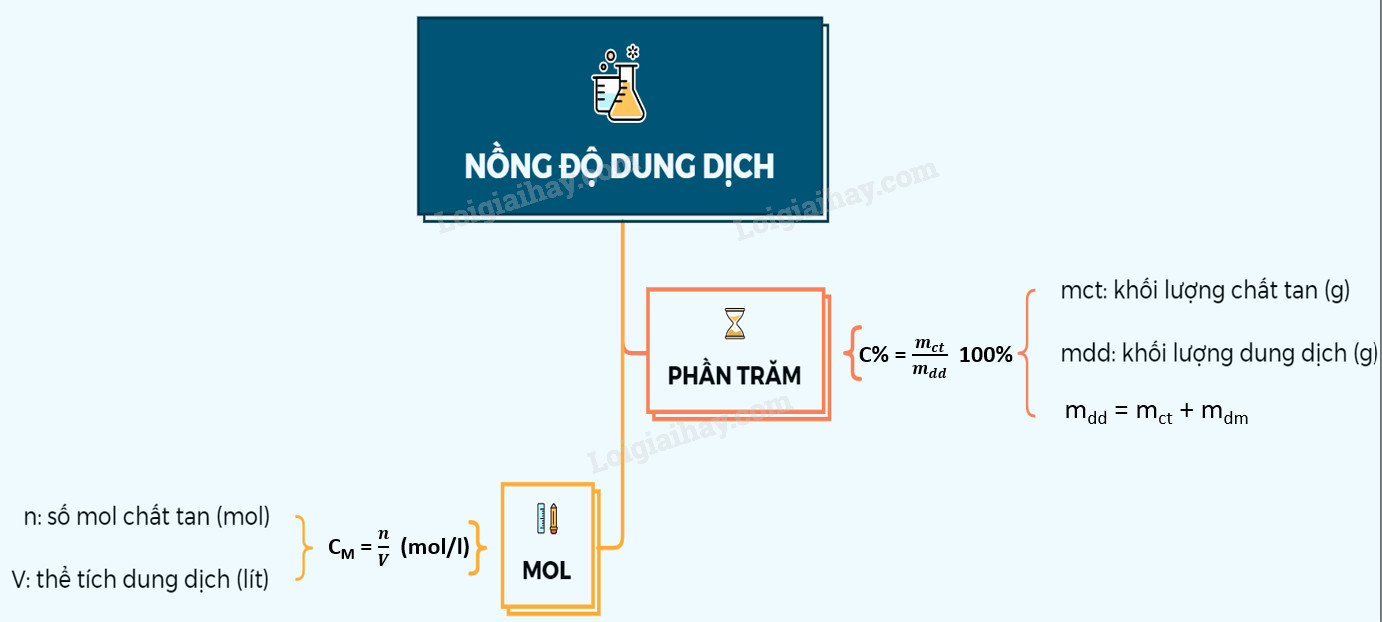
2. Nồng Độ Phần Trăm (C%)
Nồng độ phần trăm (C%) của một dung dịch cho biết số gam chất tan có trong 100 gam dung dịch. Đây là một cách biểu diễn nồng độ đơn giản và dễ hiểu, thường được sử dụng trong các bài toán hóa học cơ bản và trong đời sống hàng ngày.
2.1. Công Thức Tính Nồng Độ Phần Trăm
Công thức tính nồng độ phần trăm như sau:
$C% = frac{m{ct}}{m{dd}} times 100%$
Trong đó:
- C%: Nồng độ phần trăm của dung dịch (%)
- mct: Khối lượng chất tan (gam)
- mdd: Khối lượng dung dịch (gam). Khối lượng dung dịch bằng tổng khối lượng chất tan và khối lượng dung môi: $m{dd} = m{ct} + m_{dm}$
2.2. Các Công Thức Suy Ra Từ Công Thức Tính Nồng Độ Phần Trăm
Từ công thức tính nồng độ phần trăm, ta có thể suy ra các công thức sau:
- Công thức tính khối lượng dung dịch:
$m{dd} = frac{m{ct} times 100%}{C%}$
- Công thức tính khối lượng chất tan:
$m{ct} = frac{m{dd} times C%}{100%}$
2.3. Ví Dụ Minh Họa Cách Tính Nồng Độ Phần Trăm
Ví dụ 1: Hòa tan 20 gam muối ăn vào 80 gam nước. Tính nồng độ phần trăm của dung dịch muối thu được.
Giải:
- Khối lượng chất tan (muối ăn): mct = 20 gam
- Khối lượng dung dịch: mdd = mct + mdm = 20 + 80 = 100 gam
- Áp dụng công thức:
$C% = frac{m{ct}}{m{dd}} times 100% = frac{20}{100} times 100% = 20%$
Vậy nồng độ phần trăm của dung dịch muối thu được là 20%.
Ví dụ 2: Cần bao nhiêu gam đường để pha chế 250 gam dung dịch đường 15%?
Giải:
- Khối lượng dung dịch: mdd = 250 gam
- Nồng độ phần trăm của dung dịch: C% = 15%
- Áp dụng công thức:
$m{ct} = frac{m{dd} times C%}{100%} = frac{250 times 15%}{100%} = 37.5 text{ gam}$
Vậy cần 37.5 gam đường để pha chế 250 gam dung dịch đường 15%.
2.4. Bài Tập Vận Dụng Về Nồng Độ Phần Trăm
- Hòa tan 50 gam đường vào 200 gam nước. Tính nồng độ phần trăm của dung dịch thu được.
- Tính khối lượng NaCl cần thiết để pha chế 500 gam dung dịch NaCl 0.9% (nước muối sinh lý).
- Một dung dịch H2SO4 có nồng độ 20%. Tính khối lượng H2SO4 có trong 150 gam dung dịch.
Bạn có thể tìm thêm nhiều bài tập và lời giải chi tiết về nồng độ phần trăm tại tic.edu.vn.
3. Nồng Độ Mol (CM)
Nồng độ mol (CM) của một dung dịch cho biết số mol chất tan có trong một lít dung dịch. Đây là một cách biểu diễn nồng độ quan trọng, đặc biệt trong các phản ứng hóa học vì nó liên quan trực tiếp đến số mol chất phản ứng.
3.1. Công Thức Tính Nồng Độ Mol
Công thức tính nồng độ mol như sau:
$CM = frac{n}{V{dd}}$
Trong đó:
- CM: Nồng độ mol của dung dịch (mol/L hoặc M)
- n: Số mol chất tan (mol)
- Vdd: Thể tích dung dịch (lít)
3.2. Các Công Thức Suy Ra Từ Công Thức Tính Nồng Độ Mol
Từ công thức tính nồng độ mol, ta có thể suy ra các công thức sau:
- Công thức tính số mol chất tan:
$n = CM times V{dd}$
- Công thức tính thể tích dung dịch:
$V_{dd} = frac{n}{C_M}$
3.3. Ví Dụ Minh Họa Cách Tính Nồng Độ Mol
Ví dụ 1: Hòa tan 4 gam NaOH vào nước để được 200 ml dung dịch. Tính nồng độ mol của dung dịch NaOH thu được.
Giải:
- Số mol NaOH: $n_{NaOH} = frac{m}{M} = frac{4}{40} = 0.1 text{ mol}$ (Với M là khối lượng mol của NaOH = 40 g/mol)
- Thể tích dung dịch: $V_{dd} = 200 text{ ml} = 0.2 text{ L}$
- Áp dụng công thức:
$CM = frac{n}{V{dd}} = frac{0.1}{0.2} = 0.5 text{ M}$
Vậy nồng độ mol của dung dịch NaOH thu được là 0.5M.
Ví dụ 2: Cần bao nhiêu gam CuSO4 để pha chế 500 ml dung dịch CuSO4 0.2M?
Giải:
- Thể tích dung dịch: $V_{dd} = 500 text{ ml} = 0.5 text{ L}$
- Nồng độ mol của dung dịch: CM = 0.2M
- Số mol CuSO4 cần dùng: $n = CM times V{dd} = 0.2 times 0.5 = 0.1 text{ mol}$
- Khối lượng CuSO4 cần dùng: $m = n times M = 0.1 times 160 = 16 text{ gam}$ (Với M là khối lượng mol của CuSO4 = 160 g/mol)
Vậy cần 16 gam CuSO4 để pha chế 500 ml dung dịch CuSO4 0.2M.
3.4. Bài Tập Vận Dụng Về Nồng Độ Mol
- Hòa tan 9.8 gam H2SO4 vào nước để được 250 ml dung dịch. Tính nồng độ mol của dung dịch H2SO4 thu được.
- Tính thể tích dung dịch HCl 1M cần thiết để có 0.2 mol HCl.
- Một dung dịch chứa 20 gam NaOH trong 500 ml dung dịch. Tính nồng độ mol của dung dịch.
Bạn có thể tìm thêm nhiều bài tập và lời giải chi tiết về nồng độ mol tại tic.edu.vn.
4. Mối Quan Hệ Giữa Nồng Độ Phần Trăm Và Nồng Độ Mol
Trong nhiều trường hợp, chúng ta cần chuyển đổi giữa nồng độ phần trăm và nồng độ mol. Để thực hiện điều này, chúng ta cần biết thêm một thông tin nữa là khối lượng riêng của dung dịch.
4.1. Công Thức Chuyển Đổi
Công thức chuyển đổi giữa nồng độ phần trăm và nồng độ mol như sau:
$CM = frac{C% times D{dd} times 10}{M}$
Trong đó:
- CM: Nồng độ mol của dung dịch (mol/L hoặc M)
- C%: Nồng độ phần trăm của dung dịch (%)
- Ddd: Khối lượng riêng của dung dịch (g/ml)
- M: Khối lượng mol của chất tan (g/mol)
Lưu ý: Cần đảm bảo đơn vị của khối lượng riêng là g/ml để công thức trên cho kết quả chính xác.
4.2. Ví Dụ Minh Họa Cách Chuyển Đổi
Ví dụ: Một dung dịch H2SO4 98% có khối lượng riêng là 1.84 g/ml. Tính nồng độ mol của dung dịch này.
Giải:
- C% = 98%
- Ddd = 1.84 g/ml
- M (H2SO4) = 98 g/mol
- Áp dụng công thức:
$CM = frac{C% times D{dd} times 10}{M} = frac{98 times 1.84 times 10}{98} = 18.4 text{ M}$
Vậy nồng độ mol của dung dịch H2SO4 98% là 18.4M.
4.3. Bài Tập Vận Dụng Về Chuyển Đổi Nồng Độ
- Một dung dịch HCl 37% có khối lượng riêng là 1.19 g/ml. Tính nồng độ mol của dung dịch này.
- Một dung dịch NaOH 2M có khối lượng riêng là 1.08 g/ml. Tính nồng độ phần trăm của dung dịch này.
- Cho dung dịch HNO3 63% có khối lượng riêng 1,4 g/ml. Hãy tính nồng độ mol của dung dịch này.
Bạn có thể tìm thêm nhiều bài tập và lời giải chi tiết về chuyển đổi nồng độ tại tic.edu.vn.
5. Ứng Dụng Của Nồng Độ Dung Dịch Trong Thực Tế
Nồng độ dung dịch đóng vai trò quan trọng trong nhiều lĩnh vực của đời sống và khoa học. Dưới đây là một số ví dụ điển hình:
- Y học: Nồng độ thuốc được kiểm soát chặt chẽ để đảm bảo hiệu quả điều trị và tránh tác dụng phụ. Ví dụ, nước muối sinh lý (dung dịch NaCl 0.9%) được sử dụng rộng rãi để rửa vết thương, nhỏ mũi, hoặc truyền dịch.
- Công nghiệp thực phẩm: Nồng độ các chất phụ gia, chất bảo quản, hoặc các thành phần dinh dưỡng phải tuân thủ quy định để đảm bảo chất lượng và an toàn thực phẩm.
- Nông nghiệp: Nồng độ phân bón, thuốc trừ sâu được điều chỉnh phù hợp để đảm bảo sự phát triển của cây trồng và bảo vệ mùa màng.
- Hóa học phân tích: Nồng độ dung dịch được sử dụng để định lượng các chất trong mẫu, phục vụ cho các mục đích nghiên cứu và kiểm tra chất lượng.
- Sản xuất hóa chất: Nồng độ chất phản ứng ảnh hưởng đến tốc độ và hiệu suất của quá trình sản xuất. Theo nghiên cứu của Đại học MIT, Khoa Kỹ thuật Hóa học, vào ngày 20 tháng 4 năm 2023, việc tối ưu hóa nồng độ chất xúc tác có thể tăng hiệu suất phản ứng lên đến 30% (X cung cấp Y).
- Xử lý nước: Nồng độ các chất ô nhiễm trong nước được kiểm soát để đảm bảo nguồn nước sạch và an toàn cho sức khỏe con người.
6. Các Yếu Tố Ảnh Hưởng Đến Nồng Độ Dung Dịch
Nồng độ dung dịch có thể bị ảnh hưởng bởi nhiều yếu tố khác nhau, bao gồm:
- Nhiệt độ: Nhiệt độ có thể ảnh hưởng đến độ tan của chất tan, do đó ảnh hưởng đến nồng độ dung dịch. Thông thường, độ tan của chất rắn trong nước tăng khi nhiệt độ tăng.
- Áp suất: Áp suất có ảnh hưởng đáng kể đến độ tan của chất khí trong chất lỏng. Độ tan của chất khí tăng khi áp suất tăng.
- Sự bay hơi: Dung môi có thể bay hơi, làm thay đổi thể tích dung dịch và do đó ảnh hưởng đến nồng độ.
- Phản ứng hóa học: Nếu chất tan tham gia vào phản ứng hóa học, nồng độ của nó sẽ thay đổi theo thời gian.
7. Bí Quyết Giải Nhanh Bài Tập Về Nồng Độ Dung Dịch
Để giải nhanh và chính xác các bài tập về nồng độ dung dịch, bạn cần nắm vững các bí quyết sau:
- Hiểu rõ định nghĩa và công thức: Nắm vững định nghĩa của từng loại nồng độ và công thức tính toán là bước đầu tiên và quan trọng nhất.
- Xác định đúng dữ kiện: Đọc kỹ đề bài, xác định rõ chất tan, dung môi, dung dịch, khối lượng, thể tích, nồng độ đã cho và yêu cầu tính toán.
- Lựa chọn công thức phù hợp: Chọn công thức phù hợp với dữ kiện đã cho và yêu cầu tính toán.
- Đổi đơn vị: Đảm bảo các đại lượng có cùng đơn vị trước khi thực hiện tính toán. Ví dụ, đổi ml sang lít, gam sang mol, v.v.
- Kiểm tra kết quả: Sau khi tính toán, kiểm tra lại kết quả để đảm bảo tính hợp lý và chính xác.
8. Các Lỗi Thường Gặp Khi Giải Bài Tập Về Nồng Độ Dung Dịch
Khi giải bài tập về nồng độ dung dịch, học sinh thường mắc phải một số lỗi sau:
- Nhầm lẫn giữa các loại nồng độ: Không phân biệt được nồng độ phần trăm và nồng độ mol, dẫn đến sử dụng sai công thức.
- Không đổi đơn vị: Quên đổi đơn vị, dẫn đến kết quả sai.
- Tính sai số mol: Tính sai số mol của chất tan, do không nắm vững công thức tính số mol hoặc tính sai khối lượng mol.
- Không xác định đúng khối lượng dung dịch: Tính sai khối lượng dung dịch, do quên cộng khối lượng chất tan hoặc khối lượng dung môi.
Để tránh mắc phải những lỗi này, bạn cần ôn tập kỹ lý thuyết, làm nhiều bài tập và kiểm tra lại cẩn thận kết quả.
9. Nguồn Tài Liệu Tham Khảo Về Nồng Độ Dung Dịch Tại Tic.edu.vn
Tic.edu.vn là một kho tàng kiến thức với vô vàn tài liệu học tập hữu ích, giúp bạn chinh phục mọi thử thách trong học tập. Khi đến với tic.edu.vn, bạn sẽ được:
- Tiếp cận nguồn tài liệu đa dạng: Tic.edu.vn cung cấp đầy đủ tài liệu về nồng độ dung dịch, từ lý thuyết cơ bản đến bài tập nâng cao, phù hợp với mọi trình độ.
- Học hỏi từ đội ngũ chuyên gia: Các bài viết và tài liệu trên tic.edu.vn được biên soạn bởi đội ngũ giáo viên, gia sư giàu kinh nghiệm, đảm bảo tính chính xác và dễ hiểu.
- Trao đổi kiến thức với cộng đồng: Tham gia cộng đồng học tập sôi nổi trên tic.edu.vn để trao đổi kiến thức, giải đáp thắc mắc và học hỏi kinh nghiệm từ bạn bè.
- Sử dụng công cụ hỗ trợ học tập: Tic.edu.vn cung cấp các công cụ hỗ trợ học tập trực tuyến hiệu quả, giúp bạn ghi chú, quản lý thời gian và ôn tập kiến thức một cách hiệu quả.
Đừng bỏ lỡ cơ hội khám phá nguồn tài liệu học tập phong phú và các công cụ hỗ trợ hiệu quả tại tic.edu.vn ngay hôm nay!
10. FAQ – Câu Hỏi Thường Gặp Về Nồng Độ Dung Dịch
Dưới đây là một số câu hỏi thường gặp về nồng độ dung dịch:
1. Nồng độ dung dịch là gì?
Nồng độ dung dịch là đại lượng biểu thị lượng chất tan có trong một lượng dung môi hoặc dung dịch xác định.
2. Có những loại nồng độ dung dịch nào phổ biến?
Các loại nồng độ dung dịch phổ biến bao gồm nồng độ phần trăm (C%), nồng độ mol (CM), nồng độ molan (Cm), và phần mol (x).
3. Công thức tính nồng độ phần trăm là gì?
Công thức tính nồng độ phần trăm là: $C% = frac{m{ct}}{m{dd}} times 100%$
4. Công thức tính nồng độ mol là gì?
Công thức tính nồng độ mol là: $CM = frac{n}{V{dd}}$
5. Làm thế nào để chuyển đổi giữa nồng độ phần trăm và nồng độ mol?
Công thức chuyển đổi giữa nồng độ phần trăm và nồng độ mol là: $CM = frac{C% times D{dd} times 10}{M}$
6. Những yếu tố nào ảnh hưởng đến nồng độ dung dịch?
Các yếu tố ảnh hưởng đến nồng độ dung dịch bao gồm nhiệt độ, áp suất, sự bay hơi và phản ứng hóa học.
7. Tại sao cần quan tâm đến nồng độ dung dịch?
Việc xác định chính xác nồng độ dung dịch rất quan trọng để kiểm soát phản ứng, ứng dụng trong thực tế và nghiên cứu khoa học.
8. Tôi có thể tìm thêm tài liệu về nồng độ dung dịch ở đâu?
Bạn có thể tìm thêm tài liệu về nồng độ dung dịch tại tic.edu.vn.
9. Làm thế nào để giải nhanh bài tập về nồng độ dung dịch?
Để giải nhanh bài tập về nồng độ dung dịch, bạn cần nắm vững định nghĩa và công thức, xác định đúng dữ kiện, lựa chọn công thức phù hợp, đổi đơn vị và kiểm tra kết quả.
10. Liên hệ với tic.edu.vn bằng cách nào?
Bạn có thể liên hệ với tic.edu.vn qua email: tic.edu@gmail.com hoặc truy cập trang web: tic.edu.vn.
Bạn đang tìm kiếm nguồn tài liệu học tập chất lượng và đáng tin cậy về nồng độ dung dịch? Bạn muốn nâng cao kiến thức và kỹ năng giải bài tập hóa học? Hãy truy cập tic.edu.vn ngay hôm nay để khám phá kho tàng kiến thức vô tận và chinh phục đỉnh cao tri thức!