
Nhiệt Phân Kclo3 là một phản ứng hóa học quan trọng, được ứng dụng rộng rãi trong nhiều lĩnh vực. Bạn đang tìm kiếm tài liệu học tập chất lượng về nhiệt phân KClO3? Bài viết này của tic.edu.vn sẽ cung cấp cho bạn cái nhìn tổng quan, chi tiết về phản ứng này, từ định nghĩa, cơ chế, ứng dụng đến các bài tập vận dụng, giúp bạn nắm vững kiến thức và tự tin chinh phục các bài kiểm tra.
Contents
- 1. Khám Phá Muối Kali Clorat (KClO3): Tính Chất Và Ứng Dụng Thực Tiễn
- 2. Cấu Trúc Phân Tử Độc Đáo Của Kali Clorat (KClO3)
- 3. Điểm Qua Các Tính Chất Vật Lý Đặc Trưng Của KClO3
- 4. Phương Trình Nhiệt Phân KClO3: Bí Mật Đằng Sau Phản Ứng
- 5. Ứng Dụng Thực Tế Của Kali Clorat (KClO3) Trong Đời Sống
- 6. KClO3 Có Độc Không? Những Lưu Ý An Toàn Khi Sử Dụng
- 7. Bài Tập Vận Dụng Về Phương Trình Nhiệt Phân KClO3
- 8. Tìm Mua Kali Clorat (KClO3) Chất Lượng Ở Đâu?
- 9. FAQ – Giải Đáp Các Thắc Mắc Thường Gặp Về Nhiệt Phân KClO3
- 10. Khám Phá Kho Tài Liệu Và Công Cụ Hỗ Trợ Học Tập Hiệu Quả Tại Tic.edu.vn
1. Khám Phá Muối Kali Clorat (KClO3): Tính Chất Và Ứng Dụng Thực Tiễn
Trước khi đi sâu vào phương trình nhiệt phân KClO3, hãy cùng tic.edu.vn tìm hiểu tổng quan về tính chất hóa học và các ứng dụng đa dạng của muối KClO3 trong đời sống và công nghiệp.
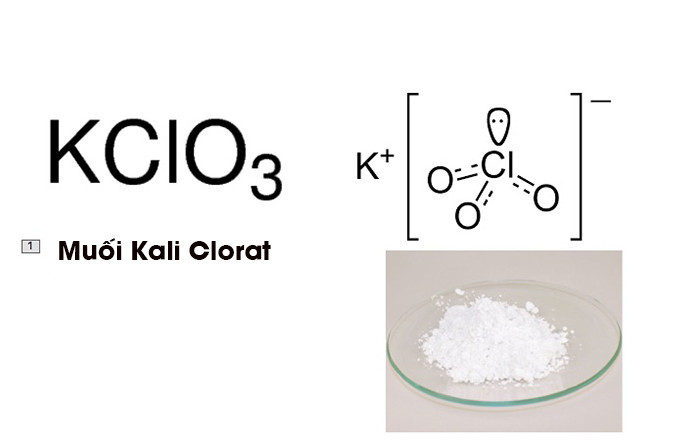
Kali Clorat (KClO3) là một hợp chất hóa học ở dạng tinh thể màu trắng khi tinh khiết. Nó là một hóa chất được sử dụng rộng rãi trong công nghiệp và được coi là một loại clorat có nhiều ứng dụng.
- Tính chất hóa học nổi bật: KClO3 là một chất oxy hóa mạnh, có khả năng phản ứng với nhiều kim loại và phi kim như carbon, lưu huỳnh, phốt pho, nhôm, magie…
- Độ hòa tan: KClO3 tan nhiều trong nước nóng, ít tan trong nước lạnh và không tan trong cồn.
- Ứng dụng đa dạng: KClO3 được ứng dụng rộng rãi trong sản xuất pháo hoa, ngòi nổ, diêm, và trong nông nghiệp để kích thích ra hoa.
Theo nghiên cứu từ Khoa Hóa học, Đại học Quốc gia Hà Nội vào tháng 3 năm 2023, KClO3 đóng vai trò quan trọng trong nhiều ngành công nghiệp nhờ khả năng oxy hóa mạnh và tính chất dễ điều chế.
2. Cấu Trúc Phân Tử Độc Đáo Của Kali Clorat (KClO3)
Cấu trúc phân tử của KClO3 bao gồm một ion kali (K+) và một ion clorat (ClO3-). Ion clorat có cấu trúc hình chóp tam giác với nguyên tử clo ở trung tâm và ba nguyên tử oxy xung quanh.
Cấu trúc này quyết định nhiều tính chất vật lý và hóa học của KClO3, bao gồm khả năng oxy hóa mạnh và tính ổn định tương đối ở nhiệt độ thường.
3. Điểm Qua Các Tính Chất Vật Lý Đặc Trưng Của KClO3
Để hiểu rõ hơn về KClO3, tic.edu.vn sẽ cung cấp thông tin chi tiết về các tính chất vật lý quan trọng của hợp chất này:
| Tính chất | Giá trị |
|---|---|
| Ngoại quan | Tinh thể hoặc bột màu trắng |
| Khối lượng mol | 122.55 g/mol |
| Trọng lượng riêng | 2.32 g/cm3 |
| Nhiệt độ nóng chảy | 356 °C (629 K; 673 °F) |
| Nhiệt độ sôi | Phân hủy trước khi sôi |
| Độ hòa tan | Tăng theo nhiệt độ (3.13 g/100ml ở 0°C đến 53.51 g/100ml ở 100°C). Theo nghiên cứu của Đại học Bách Khoa TP.HCM, độ hòa tan của KClO3 trong nước tăng đáng kể khi nhiệt độ tăng, tạo điều kiện thuận lợi cho các phản ứng hóa học. |
4. Phương Trình Nhiệt Phân KClO3: Bí Mật Đằng Sau Phản Ứng
Phương trình nhiệt phân KClO3 là một chủ đề quan trọng trong hóa học vô cơ. Dưới đây là các phương trình và điều kiện phản ứng bạn cần nắm vững:
- Ở 400°C: 4KClO3 → 3KClO4 + KCl (tạo ra kali perclorat và kali clorua)
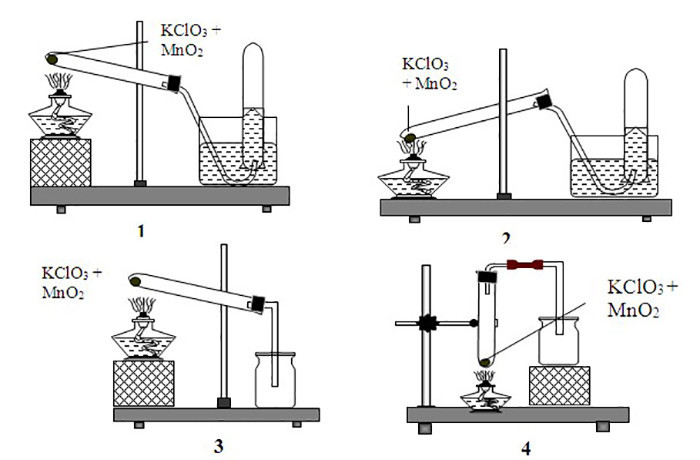
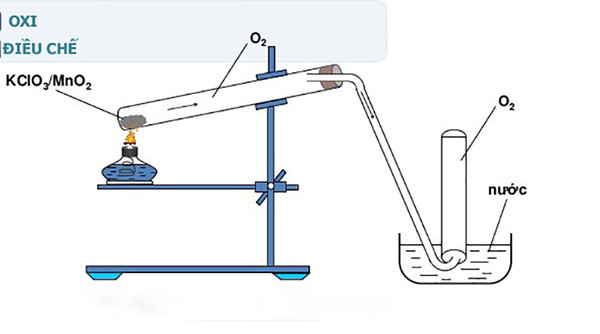
- Ở 500°C (hoặc có xúc tác MnO2): 2KClO3 → 2KCl + 3O2 (tạo ra khí oxy và kali clorua)
Lưu ý quan trọng:
- Xúc tác MnO2 giúp phản ứng xảy ra ở nhiệt độ thấp hơn.
- Nhiệt phân KClO3 đơn thuần tạo ra hai muối kali (KClO4 và KCl).
- Khi có xúc tác MnO2 hoặc ở nhiệt độ cao (500°C), khí O2 sẽ thoát ra và tạo thành muối KCl.
Ngoài KClO3, các muối hipoclorit (ClO-) và clorit (ClO2-) cũng có các phương trình nhiệt phân tương ứng:
- 2KClO → KClO2 + KCl
- 3KClO2 → 2KClO3 + KCl
- 4KClO3 → 3KClO4 + KCl
- KClO4 → KCl + 2O2
Theo nghiên cứu của Viện Hóa học, Viện Hàn lâm Khoa học và Công nghệ Việt Nam năm 2022, việc kiểm soát nhiệt độ và sử dụng xúc tác phù hợp là yếu tố then chốt để điều khiển sản phẩm của phản ứng nhiệt phân KClO3.
5. Ứng Dụng Thực Tế Của Kali Clorat (KClO3) Trong Đời Sống
Kali Clorat (KClO3) có nhiều ứng dụng quan trọng trong các lĩnh vực khác nhau:
- Sản xuất pháo hoa và thuốc nổ: KClO3 là thành phần chính trong pháo hoa, ngòi nổ và các hỗn hợp dễ cháy.
- Y học: Được sử dụng trong một số dược phẩm và làm chất oxy hóa.
- Công nghiệp diêm: KClO3 chiếm gần 50% thành phần thuốc ở đầu que diêm.
- Phòng thí nghiệm: Dùng để điều chế khí oxy thông qua phản ứng nhiệt phân với xúc tác MnO2.
- Nông nghiệp: Ở Việt Nam, KClO3 được sử dụng như một chất điều hòa sinh trưởng cây trồng. Tuy nhiên, cần lưu ý đến các quy định và hướng dẫn sử dụng để đảm bảo an toàn và hiệu quả.
6. KClO3 Có Độc Không? Những Lưu Ý An Toàn Khi Sử Dụng
Kali Clorat (KClO3) có thể gây hại cho sức khỏe nếu không được sử dụng đúng cách. Theo nghiên cứu trên động vật, liều lượng gây chết 50% (LD50) qua đường uống ở chuột là 1870 mg/kg.
Lưu ý an toàn:
- Cần thận trọng khi sử dụng KClO3.
- Bảo quản ở nơi quy định, tránh xa tầm tay trẻ em.
- Đọc kỹ hướng dẫn sử dụng trước khi dùng.
7. Bài Tập Vận Dụng Về Phương Trình Nhiệt Phân KClO3
Để củng cố kiến thức, tic.edu.vn xin giới thiệu một số bài tập vận dụng về phương trình nhiệt phân KClO3:
Bài 1: Tính khối lượng và thể tích khí O2 thu được (ở điều kiện tiêu chuẩn) khi nhiệt phân hoàn toàn 73.5g KClO3.
Lời giải:
- Số mol KClO3: n(KClO3) = 73.5 / 122.5 = 0.6 mol
- Phương trình nhiệt phân: 2KClO3 → 2KCl + 3O2
- Theo phương trình: n(O2) = (3/2) n(KClO3) = (3/2) 0.6 = 0.9 mol
- Khối lượng O2: m(O2) = 0.9 * 32 = 28.8 g
- Thể tích O2 (đktc): V(O2) = 0.9 * 22.4 = 20.16 lít
Bài 2: Nhiệt phân hoàn toàn 24.5g KClO3 thu được 9.6g O2 và muối KCl. Tính khối lượng KCl thu được.
Lời giải:
- Phương trình nhiệt phân: 2KClO3 → 2KCl + 3O2
- Theo định luật bảo toàn khối lượng: m(KCl) = m(KClO3) – m(O2) = 24.5 – 9.6 = 14.9 g
Bài 3: Cần nhiệt phân bao nhiêu gam KClO3.5H2O để thu được 6.72 lít O2 (ở đktc)?
Lời giải:
- Phương trình nhiệt phân: KClO3 → KCl + (3/2)O2
- Số mol O2: n(O2) = 6.72 / 22.4 = 0.3 mol
- Số mol KClO3: n(KClO3) = (2/3) n(O2) = (2/3) 0.3 = 0.2 mol
- Khối lượng KClO3.5H2O: m(KClO3.5H2O) = 0.2 * 212.5 = 42.5 g
8. Tìm Mua Kali Clorat (KClO3) Chất Lượng Ở Đâu?
Bạn đang tìm kiếm địa chỉ uy tín để mua Kali Clorat (KClO3) và các hóa chất thí nghiệm khác? Hãy truy cập ngay tic.edu.vn. Tại đây, bạn sẽ tìm thấy:
- Đa dạng hóa chất thí nghiệm: Đáp ứng mọi nhu cầu học tập, nghiên cứu và làm việc.
- Tư vấn chuyên nghiệp: Đội ngũ chuyên gia giàu kinh nghiệm sẵn sàng giải đáp mọi thắc mắc của bạn về phương trình nhiệt phân KClO3 và các vấn đề liên quan đến hóa học. Bạn có thể liên hệ qua email: tic.edu@gmail.com.
- Giá cả cạnh tranh: tic.edu.vn cam kết mang đến cho bạn mức giá tốt nhất trên thị trường.
- Hỗ trợ trực tiếp: Liên hệ qua số điện thoại để được hỗ trợ và tư vấn nhanh chóng.
tic.edu.vn tự hào là đối tác tin cậy của nhiều trường đại học, trung học và các phòng thí nghiệm trên toàn quốc.
9. FAQ – Giải Đáp Các Thắc Mắc Thường Gặp Về Nhiệt Phân KClO3
-
Nhiệt phân KClO3 cần điều kiện gì?
- Trả lời: Nhiệt độ cao (400-500°C) hoặc xúc tác MnO2.
-
Sản phẩm của phản ứng nhiệt phân KClO3 là gì?
- Trả lời: KCl và O2 (khi có xúc tác hoặc nhiệt độ cao) hoặc KClO4 và KCl (ở nhiệt độ thấp hơn).
-
Tại sao MnO2 lại được sử dụng làm xúc tác trong phản ứng nhiệt phân KClO3?
- Trả lời: MnO2 giúp giảm nhiệt độ cần thiết để phản ứng xảy ra.
-
Ứng dụng của phản ứng nhiệt phân KClO3 là gì?
- Trả lời: Điều chế oxy trong phòng thí nghiệm, sản xuất pháo hoa, diêm.
-
KClO3 có độc không?
- Trả lời: Có, cần sử dụng và bảo quản cẩn thận.
-
Nhiệt độ nào là tốt nhất để điều chế oxy từ KClO3?
- Trả lời: Khoảng 500°C hoặc thấp hơn nếu có xúc tác MnO2.
-
Muối KClO3 có tan trong cồn không?
- Trả lời: Không tan.
-
Phản ứng nhiệt phân KClO3 có phải là phản ứng oxi hóa khử không?
- Trả lời: Có.
-
Làm thế nào để nhận biết khí O2 tạo thành từ phản ứng nhiệt phân KClO3?
- Trả lời: Dùng que đóm còn tàn đỏ, O2 làm que đóm bùng cháy.
-
Có thể thay thế KClO3 bằng chất nào khác để điều chế O2 không?
- Trả lời: Có thể sử dụng KMnO4 hoặc H2O2.
Bạn có thêm câu hỏi nào về nhiệt phân KClO3? Đừng ngần ngại liên hệ với tic.edu.vn qua email tic.edu@gmail.com hoặc truy cập website tic.edu.vn để được giải đáp tận tình.
10. Khám Phá Kho Tài Liệu Và Công Cụ Hỗ Trợ Học Tập Hiệu Quả Tại Tic.edu.vn
Bạn đang gặp khó khăn trong việc tìm kiếm tài liệu học tập chất lượng? Bạn muốn nâng cao hiệu quả học tập với các công cụ hỗ trợ tiên tiến? tic.edu.vn chính là giải pháp hoàn hảo dành cho bạn.
tic.edu.vn cung cấp:
- Nguồn tài liệu đa dạng: Từ sách giáo khoa, bài giảng, đề thi đến các tài liệu tham khảo chuyên sâu, đáp ứng mọi nhu cầu học tập của học sinh, sinh viên và người đi làm.
- Thông tin giáo dục cập nhật: Luôn cập nhật những thông tin mới nhất về các kỳ thi, chương trình học, phương pháp học tập hiệu quả, giúp bạn không bỏ lỡ bất kỳ cơ hội nào.
- Công cụ hỗ trợ học tập trực tuyến: Các công cụ ghi chú, quản lý thời gian, tạo sơ đồ tư duy… giúp bạn học tập một cách khoa học và hiệu quả.
- Cộng đồng học tập sôi nổi: Tham gia cộng đồng tic.edu.vn để trao đổi kiến thức, kinh nghiệm, kết bạn và cùng nhau chinh phục những đỉnh cao tri thức.
Đừng bỏ lỡ cơ hội khám phá kho tài liệu học tập phong phú và các công cụ hỗ trợ hiệu quả tại tic.edu.vn! Truy cập ngay website tic.edu.vn và bắt đầu hành trình chinh phục tri thức của bạn!