Phản ứng NH3 + HCl tạo ra NH4Cl là một minh chứng hùng hồn cho thấy khói trắng có thể xuất hiện mà không cần đến lửa, một điều thú vị được khám phá tại tic.edu.vn. Hiện tượng này không chỉ là một phản ứng hóa học đơn thuần, mà còn là một ví dụ điển hình về sự khác biệt giữa quan niệm thông thường và kiến thức khoa học, mở ra một thế giới tri thức rộng lớn và đầy bất ngờ cho những ai đam mê khám phá.
1. Ý Định Tìm Kiếm Của Người Dùng Về Phản Ứng NH3 + HCl
Người dùng tìm kiếm thông tin về phản ứng NH3 + HCl với nhiều mục đích khác nhau, bao gồm:
- Tìm hiểu về bản chất phản ứng: Muốn biết phản ứng NH3 + HCl là gì, diễn ra như thế nào, sản phẩm tạo thành là gì.
- Giải thích hiện tượng khói trắng: Tìm hiểu tại sao phản ứng này lại tạo ra khói trắng mà không cần đến lửa.
- Ứng dụng của phản ứng: Khám phá các ứng dụng thực tế của phản ứng NH3 + HCl trong đời sống và công nghiệp.
- Tìm kiếm thí nghiệm minh họa: Muốn xem video hoặc hình ảnh thí nghiệm để hiểu rõ hơn về phản ứng.
- Kiểm tra kiến thức hóa học: Sử dụng phản ứng này như một ví dụ để ôn tập và củng cố kiến thức về hóa học vô cơ.
2. Phản Ứng NH3 + HCl Là Gì?
Phản ứng giữa amoniac (NH3) và axit clohidric (HCl) là một phản ứng hóa học, trong đó hai chất khí này kết hợp với nhau để tạo thành amoni clorua (NH4Cl) ở dạng rắn. Phản ứng này diễn ra rất nhanh chóng và tỏa nhiệt, tạo thành một làn khói trắng đặc trưng.
NH3(k) + HCl(k) → NH4Cl(r)
3. Tại Sao Phản Ứng NH3 + HCl Tạo Ra Khói Trắng?
Hiện tượng khói trắng trong phản ứng NH3 + HCl là do sự hình thành các hạt amoni clorua (NH4Cl) rất nhỏ. Khi hai chất khí NH3 và HCl trộn lẫn, chúng phản ứng với nhau tạo thành NH4Cl. Do NH4Cl là chất rắn ở nhiệt độ phòng, nó sẽ ngưng tụ thành các hạt tinh thể nhỏ li ti và lơ lửng trong không khí, tạo thành làn khói trắng mà chúng ta quan sát được.
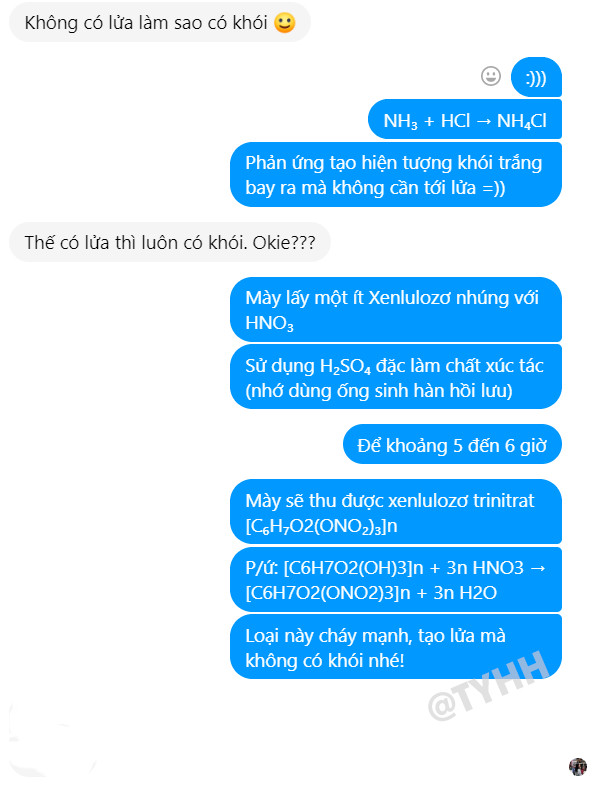 Dân chuyên Văn cũng phải cứng họng trước màn chứng minh đầy thuyết phục này. (Nguồn: Tôi yêu hóa học)
Dân chuyên Văn cũng phải cứng họng trước màn chứng minh đầy thuyết phục này. (Nguồn: Tôi yêu hóa học)
4. So Sánh Khói Trắng Từ NH3 + HCl Với Khói Do Cháy
Khói trắng từ phản ứng NH3 + HCl khác biệt so với khói do cháy ở những điểm sau:
| Đặc điểm | Khói từ NH3 + HCl | Khói do cháy |
|---|---|---|
| Thành phần | Các hạt tinh thể NH4Cl nhỏ li ti | Hỗn hợp các hạt rắn, lỏng và khí (tro, muội than,…) |
| Nguồn gốc | Phản ứng hóa học giữa hai chất khí | Quá trình đốt cháy vật liệu |
| Nhiệt độ | Thường không nóng (do phản ứng tỏa nhiệt nhưng không đáng kể) | Rất nóng |
| Mùi | Mùi khai đặc trưng của amoniac (nếu NH3 dư) | Mùi khét, tùy thuộc vào vật liệu cháy |
| Tính chất vật lý | Các hạt rắn lơ lửng trong không khí | Các hạt rắn, lỏng và khí lơ lửng trong không khí |
5. Ứng Dụng Của Phản Ứng NH3 + HCl Trong Đời Sống Và Công Nghiệp
Mặc dù không phổ biến như các phản ứng hóa học khác, phản ứng NH3 + HCl vẫn có một số ứng dụng nhất định:
- Trong phòng thí nghiệm: Được sử dụng để điều chế NH4Cl, một hóa chất quan trọng trong nhiều thí nghiệm hóa học.
- Trong công nghiệp: NH4Cl được sử dụng làm phân bón, chất điện giải trong pin khô, và trong một số quy trình sản xuất khác.
- Trong giáo dục: Phản ứng này được sử dụng để minh họa các khái niệm về phản ứng hóa học, sự hình thành chất rắn từ chất khí, và hiện tượng khói.
6. Thí Nghiệm Minh Họa Phản Ứng NH3 + HCl
Để thực hiện thí nghiệm này, bạn cần chuẩn bị:
- Dung dịch amoniac đặc (NH3)
- Dung dịch axit clohidric đặc (HCl)
- Hai ống nghiệm
- Kẹp ống nghiệm
Tiến hành:
- Nhỏ vài giọt dung dịch NH3 vào một ống nghiệm.
- Nhỏ vài giọt dung dịch HCl vào ống nghiệm còn lại.
- Đặt hai ống nghiệm gần nhau sao cho miệng ống hướng vào nhau, nhưng không chạm vào nhau.
- Quan sát hiện tượng xảy ra. Bạn sẽ thấy một làn khói trắng xuất hiện ở giữa hai ống nghiệm.
Giải thích: Khói trắng là do phản ứng giữa khí NH3 thoát ra từ dung dịch NH3 và khí HCl thoát ra từ dung dịch HCl, tạo thành các hạt NH4Cl rắn.
7. Những Lưu Ý Khi Thực Hiện Thí Nghiệm NH3 + HCl
- Sử dụng dung dịch NH3 và HCl đặc một cách cẩn thận, tránh để chúng tiếp xúc với da và mắt.
- Thực hiện thí nghiệm trong phòng thông gió tốt để tránh hít phải khí NH3 và HCl.
- Không nên thực hiện thí nghiệm với lượng lớn hóa chất, vì phản ứng có thể tỏa nhiệt và gây nguy hiểm.
8. Kiến Thức Hóa Học Liên Quan Đến Phản Ứng NH3 + HCl
Phản ứng NH3 + HCl là một ví dụ về phản ứng trung hòa giữa một bazơ (NH3) và một axit (HCl). Trong phản ứng này, NH3 nhận một proton (H+) từ HCl để tạo thành ion amoni (NH4+), và HCl mất một proton để trở thành ion clorua (Cl-). Hai ion này sau đó kết hợp với nhau để tạo thành muối amoni clorua (NH4Cl).
9. Phản Ứng NH3 + HCl Trong Chương Trình Hóa Học Phổ Thông
Phản ứng NH3 + HCl thường được giới thiệu trong chương trình hóa học phổ thông để minh họa các khái niệm về:
- Phản ứng hóa học
- Chất khí và chất rắn
- Phản ứng trung hòa
- Sự hình thành khói
10. Mở Rộng Kiến Thức Về Các Phản Ứng Tạo Khói Không Cần Lửa
Ngoài phản ứng NH3 + HCl, còn có một số phản ứng khác cũng tạo ra khói mà không cần đến lửa, ví dụ:
- Phản ứng giữa axit nitric đặc (HNO3) và đồng (Cu): Tạo ra khí nitơ đioxit (NO2) màu nâu đỏ, có vẻ ngoài giống như khói.
- Phản ứng giữa natri hidroxit (NaOH) và axit sunfuric đặc (H2SO4): Tạo ra hơi nước và các hạt natri sunfat (Na2SO4) nhỏ li ti, tạo thành làn khói trắng.
11. Sự Thật Thú Vị Về Amoni Clorua (NH4Cl)
- Amoni clorua còn được gọi là “muối lạnh” vì khi tan trong nước, nó hấp thụ nhiệt và làm lạnh dung dịch.
- NH4Cl được sử dụng trong y học như một chất long đờm và lợi tiểu.
- Trong công nghiệp thực phẩm, NH4Cl được sử dụng như một chất phụ gia để tạo hương vị cho một số loại bánh kẹo.
- NH4Cl có thể thăng hoa (chuyển trực tiếp từ trạng thái rắn sang trạng thái khí) khi đun nóng.
12. Tại Sao Thành Ngữ “Không Có Lửa Làm Sao Có Khói” Đôi Khi Không Đúng?
Câu thành ngữ “Không có lửa làm sao có khói” thường được hiểu theo nghĩa đen là khói chỉ có thể xuất hiện khi có lửa. Tuy nhiên, phản ứng NH3 + HCl và một số phản ứng khác đã chứng minh rằng điều này không phải lúc nào cũng đúng. Khói có thể được tạo ra từ các phản ứng hóa học mà không cần đến quá trình đốt cháy.
13. Ý Nghĩa Sâu Xa Của Hiện Tượng Khói Trắng Từ NH3 + HCl
Hiện tượng khói trắng từ phản ứng NH3 + HCl không chỉ là một hiện tượng hóa học thú vị, mà còn mang ý nghĩa sâu xa hơn:
- Sự khác biệt giữa quan niệm thông thường và kiến thức khoa học: Đôi khi, những gì chúng ta tin là đúng dựa trên kinh nghiệm và quan sát thông thường có thể không hoàn toàn chính xác theo góc độ khoa học.
- Tầm quan trọng của việc học hỏi và khám phá: Để hiểu rõ thế giới xung quanh, chúng ta cần không ngừng học hỏi, khám phá và đặt câu hỏi về mọi thứ.
- Vẻ đẹp của hóa học: Hóa học không chỉ là những công thức và phương trình khô khan, mà còn là một thế giới đầy màu sắc và bất ngờ, nơi những điều kỳ diệu có thể xảy ra.
14. Khám Phá Kho Tàng Kiến Thức Hóa Học Tại Tic.edu.vn
Nếu bạn đam mê khám phá thế giới hóa học và muốn tìm hiểu thêm về các phản ứng thú vị như NH3 + HCl, hãy truy cập tic.edu.vn ngay hôm nay. Tại đây, bạn sẽ tìm thấy:
- Tài liệu học tập đa dạng: Từ sách giáo khoa, bài giảng, đến các bài tập và đề thi thử, tic.edu.vn cung cấp đầy đủ tài liệu cho mọi trình độ và nhu cầu học tập.
- Thông tin giáo dục mới nhất: Cập nhật liên tục về các xu hướng giáo dục, phương pháp học tập tiên tiến, và các nguồn tài liệu mới.
- Công cụ hỗ trợ học tập hiệu quả: Các công cụ ghi chú, quản lý thời gian, và các ứng dụng học tập trực tuyến giúp bạn nâng cao năng suất và đạt kết quả tốt hơn.
- Cộng đồng học tập sôi nổi: Tham gia vào các diễn đàn, nhóm học tập, và các sự kiện trực tuyến để trao đổi kiến thức, kinh nghiệm và kết nối với những người cùng đam mê.
15. Tại Sao Nên Chọn Tic.edu.vn?
- Nguồn tài liệu đáng tin cậy: Tất cả tài liệu trên tic.edu.vn đều được kiểm duyệt kỹ lưỡng bởi đội ngũ chuyên gia giáo dục giàu kinh nghiệm.
- Giao diện thân thiện, dễ sử dụng: Thiết kế trực quan, dễ dàng tìm kiếm và truy cập thông tin.
- Hỗ trợ tận tình: Đội ngũ hỗ trợ luôn sẵn sàng giải đáp mọi thắc mắc và giúp đỡ bạn trong quá trình học tập.
- Hoàn toàn miễn phí: Tic.edu.vn cung cấp tài liệu và công cụ học tập hoàn toàn miễn phí cho tất cả mọi người.
16. Lời Kêu Gọi Hành Động (CTA)
Bạn muốn khám phá những bí ẩn của hóa học và chinh phục mọi thử thách trong học tập? Hãy truy cập tic.edu.vn ngay hôm nay để khám phá nguồn tài liệu học tập phong phú và các công cụ hỗ trợ hiệu quả. Đừng bỏ lỡ cơ hội nâng cao kiến thức và phát triển bản thân cùng tic.edu.vn!
17. Liên Hệ
- Email: tic.edu@gmail.com
- Trang web: tic.edu.vn
18. Câu Hỏi Thường Gặp (FAQ)
Câu hỏi 1: Phản ứng NH3 + HCl có nguy hiểm không?
Trả lời: Phản ứng này không quá nguy hiểm nếu được thực hiện với lượng nhỏ hóa chất và trong điều kiện thông gió tốt. Tuy nhiên, cần tránh hít phải khí NH3 và HCl, và tránh để chúng tiếp xúc với da và mắt.
Câu hỏi 2: Tôi có thể tìm thấy thí nghiệm NH3 + HCl trên tic.edu.vn không?
Trả lời: Có, bạn có thể tìm thấy hướng dẫn chi tiết và video minh họa thí nghiệm NH3 + HCl trên tic.edu.vn.
Câu hỏi 3: NH4Cl có độc hại không?
Trả lời: NH4Cl không quá độc hại, nhưng có thể gây kích ứng da và mắt nếu tiếp xúc trực tiếp.
Câu hỏi 4: Phản ứng NH3 + HCl có ứng dụng gì trong thực tế?
Trả lời: NH4Cl được sử dụng làm phân bón, chất điện giải trong pin khô, và trong một số quy trình sản xuất khác.
Câu hỏi 5: Tại sao phản ứng NH3 + HCl lại tạo ra khói trắng mà không cần lửa?
Trả lời: Khói trắng là do sự hình thành các hạt NH4Cl rất nhỏ khi hai chất khí NH3 và HCl phản ứng với nhau.
Câu hỏi 6: Tôi có thể tìm thấy thêm thông tin về các phản ứng hóa học khác trên tic.edu.vn không?
Trả lời: Có, tic.edu.vn cung cấp rất nhiều tài liệu về các phản ứng hóa học khác nhau, từ cơ bản đến nâng cao.
Câu hỏi 7: Làm thế nào để tham gia cộng đồng học tập trên tic.edu.vn?
Trả lời: Bạn có thể tham gia vào các diễn đàn, nhóm học tập, và các sự kiện trực tuyến trên tic.edu.vn để trao đổi kiến thức và kinh nghiệm với những người cùng đam mê.
Câu hỏi 8: Tic.edu.vn có cung cấp tài liệu cho các môn học khác không?
Trả lời: Có, tic.edu.vn cung cấp tài liệu cho hầu hết các môn học trong chương trình phổ thông và đại học.
Câu hỏi 9: Tôi có thể đóng góp tài liệu cho tic.edu.vn không?
Trả lời: Có, tic.edu.vn luôn hoan nghênh sự đóng góp của cộng đồng. Bạn có thể liên hệ với đội ngũ quản trị để biết thêm chi tiết.
Câu hỏi 10: Tic.edu.vn có phiên bản dành cho điện thoại di động không?
Trả lời: Có, tic.edu.vn có giao diện tương thích với điện thoại di động, giúp bạn dễ dàng truy cập và học tập mọi lúc mọi nơi.