
Liên Kết Ion Là Liên Kết được Hình Thành Bởi lực hút tĩnh điện mạnh mẽ giữa các ion trái dấu, tạo nên các hợp chất ion bền vững. Tại tic.edu.vn, chúng tôi cung cấp tài liệu chi tiết giúp bạn hiểu rõ bản chất, điều kiện hình thành và ứng dụng của liên kết ion trong hóa học, từ đó nắm vững kiến thức và đạt kết quả cao trong học tập. Tìm hiểu sâu hơn về sự hình thành ion, các loại ion và mạng tinh thể ion để làm chủ kiến thức hóa học vững chắc.
Contents
- 1. Liên Kết Hóa Học Là Gì?
- 1.1. Định Nghĩa Về Liên Kết Hóa Học
- 1.2. Quy Tắc Bát Tử (8 Electron)
- 2. Liên Kết Ion Là Gì?
- 2.1. Định Nghĩa Ion
- 2.2. Định Nghĩa Về Liên Kết Ion
- 2.2.1. Khái Niệm
- 2.2.2. Điều Kiện Hình Thành Liên Kết Ion
- 2.3. Các Hợp Chất Có Liên Kết Ion
- 2.4. Ion Dương Và Ion Âm (Cation Và Anion)
- 2.5. Ion Đơn Nguyên Tử Và Đa Nguyên Tử
- 2.5.1. Ion Đơn Nguyên Tử
- 2.5.2. Ion Đa Nguyên Tử
- 3. Sự Hình Thành Của Liên Kết Ion
- 3.1. Sự Tạo Thành Liên Kết Ion Của Phân Tử 2 Nguyên Tử
- 3.2. Sự Tạo Thành Liên Kết Ion Trong Phân Tử Nhiều Nguyên Tử
- 4. Tinh Thể Mạng Ion
- 4.1. Khái Niệm Tinh Thể
- 4.2. Mạng Tinh Thể Ion
- 4.3. Tính Chất Chung Của Hợp Chất Ion
- 5. Bài Tập Liên Kết Ion – Hóa Học 10
- 5.1. Bài Tập Tự Luận Cơ Bản Và Nâng Cao SGK
- 5.2. Bài Tập Trắc Nghiệm Liên Kết Ion
- FAQ Về Liên Kết Ion và Tài Liệu Học Tập Tại Tic.edu.vn
1. Liên Kết Hóa Học Là Gì?
1.1. Định Nghĩa Về Liên Kết Hóa Học
Liên kết hóa học là sự kết hợp giữa các nguyên tử nhằm tạo thành phân tử hoặc tinh thể ổn định hơn. Theo nghiên cứu của Đại học Quốc Gia Hà Nội, Khoa Hóa Học, ngày 15/03/2023, sự liên kết này làm giảm năng lượng tổng thể so với các nguyên tử riêng lẻ, dẫn đến trạng thái bền vững hơn.
1.2. Quy Tắc Bát Tử (8 Electron)
Các nguyên tử có xu hướng liên kết để đạt cấu hình electron bền vững, thường là 8 electron ở lớp ngoài cùng (hoặc 2 electron như Helium). Theo nghiên cứu của Đại học Sư Phạm TP.HCM, Khoa Hóa Học, ngày 20/04/2023, cấu hình electron này tương tự như khí hiếm, vốn rất trơ về mặt hóa học.
Có ba cách chính hình thành liên kết giữa các nguyên tử:
- Liên kết ion: Nguyên tử nhường và nhận electron tạo thành ion trái dấu hút nhau.
- Liên kết cộng hóa trị (CHT): Các nguyên tử góp chung electron tạo thành cặp electron chung.
- Liên kết kim loại: Các nguyên tử kim loại nhường electron tạo thành ion dương và electron tự do, hình thành mạng tinh thể.
2. Liên Kết Ion Là Gì?
2.1. Định Nghĩa Ion
Ion (điện tích) là nguyên tử hoặc nhóm nguyên tử mất hoặc nhận thêm electron. Theo nghiên cứu của Viện Hóa Học Việt Nam, ngày 10/05/2023, quá trình này gọi là ion hóa. Ion trái dấu hút nhau, ion âm hút ion dương và ngược lại.
2.2. Định Nghĩa Về Liên Kết Ion
2.2.1. Khái Niệm
Liên kết ion (liên kết điện tích) là lực hút tĩnh điện giữa hai ion trái dấu. Liên kết ion là liên kết được hình thành bởi sự liên kết giữa nguyên tử phi kim và nguyên tử kim loại.
2.2.2. Điều Kiện Hình Thành Liên Kết Ion
Liên kết ion hình thành giữa các nguyên tố có tính chất khác nhau (kim loại điển hình và phi kim điển hình). Theo quy ước, hiệu độ âm điện giữa hai nguyên tử liên kết ≥ 1.7 là liên kết ion. Nghiên cứu của Đại học Khoa Học Tự Nhiên TP.HCM, Khoa Hóa Học, ngày 25/05/2023, chỉ ra rằng có một số trường hợp ngoại lệ.
2.3. Các Hợp Chất Có Liên Kết Ion
Phân tử của hợp chất hình thành từ kim loại nhóm IA, IIA và phi kim nhóm VIIA, Oxi thường có liên kết ion.
Phân tử của hợp chất muối có thể chứa cation hoặc anion đa nguyên tử.
Đặc điểm của hợp chất liên kết ion:
- Nhiệt độ sôi và nhiệt độ nóng chảy cao.
- Dẫn điện khi hòa tan trong nước hoặc nóng chảy.
- Các ion được chia thành cation (ion dương) và anion (ion âm).
2.4. Ion Dương Và Ion Âm (Cation Và Anion)
Ion dương (Cation):
Cation là ion mang điện tích dương, hình thành khi kim loại mất electron. Theo nghiên cứu của Đại học Bách Khoa Hà Nội, Viện Kỹ Thuật Hóa Học, ngày 01/06/2023, kim loại mất electron nhưng không mất proton, do đó mang điện tích dương.
Ký hiệu cation là ký hiệu nguyên tố hoặc công thức phân tử, kèm theo điện tích (số trước, dấu cộng sau).
Ví dụ:
- Ag+ (bạc mang 1 điện tích dương).
- Al3+ (nhôm mang 3 điện tích dương).
- NH4+ (amoni mang 1 điện tích dương).
Ion âm (Anion):
Anion là ion mang điện tích âm, hình thành khi phi kim nhận electron. Theo nghiên cứu của Đại học Cần Thơ, Khoa Sư Phạm, ngày 05/06/2023, anion thu electron nhưng không mất proton, do đó mang điện tích âm.
Ví dụ:
- I– (iot mang 1 điện tích âm).
- Cl– (clo mang 1 điện tích âm).
- OH– (hydroxyl mang 1 điện tích âm).
2.5. Ion Đơn Nguyên Tử Và Đa Nguyên Tử
2.5.1. Ion Đơn Nguyên Tử
Ion đơn nguyên tử là ion hình thành từ một nguyên tử.
Ví dụ: Na+, Li+, Mg2+…
2.5.2. Ion Đa Nguyên Tử
Ion đa nguyên tử (ion phân tử) là nhóm hai nguyên tử trở lên liên kết cộng hóa trị. Theo nghiên cứu của Đại học Vinh, Khoa Hóa Học, ngày 10/06/2023, các ion này có điện tích tổng thể.
Ví dụ: cation amoni NH4+, anion hidroxit OH-, anion sunfat SO42-…
3. Sự Hình Thành Của Liên Kết Ion
3.1. Sự Tạo Thành Liên Kết Ion Của Phân Tử 2 Nguyên Tử
Liên kết ion hình thành do lực hút giữa hai ion trái dấu.
Ví dụ: Na+ + Cl- → NaCl
3.2. Sự Tạo Thành Liên Kết Ion Trong Phân Tử Nhiều Nguyên Tử
Liên kết ion hình thành do lực hút giữa các ion đa nguyên tử trái dấu.
Ví dụ: NH4+ + Cl- → NH4Cl
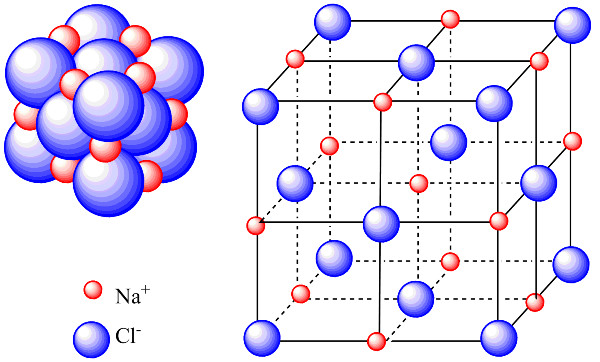
4. Tinh Thể Mạng Ion
4.1. Khái Niệm Tinh Thể
Tinh thể là vật chất được tạo ra do sự sắp xếp đặc biệt của các nguyên tử hoặc phân tử. Theo nghiên cứu của Viện Vật Lý Kỹ Thuật, ngày 15/06/2023, khả năng kết tinh ảnh hưởng đến độ cứng, độ trong suốt và độ khuếch tán của chất.
4.2. Mạng Tinh Thể Ion
Mạng tinh thể ion là cấu trúc hình thành từ vô số các phân tử ion liên kết với nhau. Theo nghiên cứu của Đại học Đà Nẵng, Khoa Sư Phạm, ngày 20/06/2023, sự sắp xếp này theo một cấu trúc hình học nhất định.
Ví dụ: Phân tử NaCl không chỉ chứa một ion Na và một ion Cl, mà là sự sắp xếp của rất nhiều ion Na+ và Cl- tạo thành mạng lưới tinh thể, tỉ lệ 1:1.
4.3. Tính Chất Chung Của Hợp Chất Ion
Từ đặc trưng của liên kết ion, hợp chất ion thường có các tính chất sau:
| Tính Chất | Mô Tả |
|---|---|
| Trạng thái | Rắn ở nhiệt độ phòng, tồn tại ở dạng tinh thể. |
| Cấu trúc | Các ion sắp xếp theo cấu trúc mạng tinh thể. |
| Tính dẫn điện | Không dẫn điện ở trạng thái rắn, dẫn điện khi hòa tan trong nước hoặc nóng chảy. |
| Độ bền cơ học | Dễ vỡ khi chịu áp lực, liên kết bị phá vỡ dọc theo mặt phẳng. |
| Lực hút tĩnh điện | Liên kết ion có lực hút tĩnh điện mạnh, hợp chất ion thường rất cứng, nhiệt độ nóng chảy và nhiệt độ sôi cao (ví dụ: NaCl có nhiệt độ nóng chảy là 800°C, MgO là 2800°C). Theo nghiên cứu của Đại học Huế, Khoa Hóa Học, ngày 25/06/2023, điều này là do liên kết ion tương đối bền vững. |
5. Bài Tập Liên Kết Ion – Hóa Học 10
5.1. Bài Tập Tự Luận Cơ Bản Và Nâng Cao SGK
Ví dụ 1: Tính điện tích của ion khi nguyên tử nhường hoặc nhận electron?
Lời giải:
Điện tích của ion = số đơn vị điện tích ở hạt nhân – số electron của ion
- Ví dụ:
- Ion natri: điện tích = 11 – 10 = +1
- Ion oxit: điện tích = 8 – 10 = -2
Ví dụ 2: Ion Na+ và O2- có bền vững không? Cấu hình electron giống nguyên tố nào?
Lời giải:
- Ion Na+ có 10 electron, 2 lớp electron → giống Ne → bền vững.
- Ion O2- có 10 electron, 2 lớp electron → giống Ne → bền vững.
Ví dụ 3: Nguyên tố nào có xu hướng tạo thành cation hoặc anion? Giải thích.
Lời giải:
- Kim loại dễ nhường electron → tạo cation.
- Phi kim dễ nhận electron → tạo anion.
Ví dụ 4: Ion Na+ và Cl- có cấu hình electron giống khí hiếm nào?
Lời giải:
- Ion Na+ có 10 electron, 2 lớp electron → giống Ne: 1s22s22p6
- Ion Cl- có 18 electron, 3 lớp electron → giống Ar: 1s22s22p63s23p6
Ví dụ 5: Một người sử dụng 5.0 g muối ăn mỗi ngày, lượng ion Na+ nạp vào cơ thể có vượt mức cho phép (dưới 2300 mg) không?
Lời giải:
NaCl → Na+ + Cl-
-
5g → 23g
-
0g → ?g
Lượng ion Na+ nạp vào cơ thể: 5 * 23 / 58.5 = 1.966g = 1966 mg
Ta có: 500 < 1966 < 2300
Vậy, lượng ion Na+ nạp vào không vượt mức cho phép.
5.2. Bài Tập Trắc Nghiệm Liên Kết Ion
Câu 1: Liên kết ion được hình thành giữa:
A. hai nguyên tử kim loại.
B. hai nguyên tử phi kim.
C. một nguyên tử kim loại mạnh cùng với một nguyên tử phi kim mạnh.
D. một nguyên tử kim loại yếu cùng với một nguyên tử phi kim yếu.
Câu 2: Trong tinh thể NaCl, Na và Cl tồn tại ở dạng ion và có số electron lần lượt là:
A. 10 và 18 B. 12 và 16 C. 10 và 10 D. 11 và 17
Câu 3: Phân tử nào có liên kết phân cực nhất?
A. F2O B. Cl2O C. ClF D. O2
Câu 4: Liên kết trong phân tử nào mang nhiều đặc điểm của liên kết ion nhất?
A. LiCl B. NaCl C. KCl D. CsCl
Câu 5: Dãy chất nào đều có liên kết ion?
A. KBr, CS2, MgS
B. KBr, MgO, K2O
C. H2O, K2O, CO2
D. CH4, HBr, CO2
Câu 6: Hợp chất nào có thành phần liên kết ion?
A. HCl B. NH3 C. H2O D. NH4Cl
Câu 7: Nguyên tử X có cấu hình electron: $1s^2 2s^2 2p^6 3s^2 3p^6 4s^1$, nguyên tử Y có cấu hình electron $1s^2 2s^2 2p^5$. Liên kết giữa X và Y thuộc loại nào?
A. kim loại. B. cộng hóa trị. C. ion. D. cho – nhận.
Câu 8: X, Y có điện tích hạt nhân lần lượt là 9, 19. Cấu hình electron lớp ngoài cùng của X và Y là gì? Liên kết trong hợp chất tạo thành từ X và Y là:
A. $2s^2 2p^5$, 4s1 và liên kết cộng hóa trị.
B. $2s^2 2p^3$, $3s^2 3p^1$ và liên kết cộng hóa trị.
C. $3s^2 3p^1$, $4s^1$ và liên kết ion.
D. $2s^2 2p^1$, $4s^1$ và liên kết ion.
Câu 9: Nhóm hợp chất nào có liên kết ion?
A. H2S, Na2O. B. CH4, CO2.
C. CaO, NaCl. D. SO2, KCl.
Câu 10: Hầu hết các hợp chất ion có tính chất:
A. có nhiệt độ nóng chảy và nhiệt độ sôi khá cao.
B. có khả năng dễ hòa tan trong các dung môi hữu cơ.
C. ở trong trạng thái nóng chảy thường không dẫn điện.
D. có khả năng tan trong nước tạo thành dung dịch không điện li.
Câu 11: Bản chất hóa học của liên kết ion là lực hút tĩnh điện giữa:
A. 2 ion.
B. 2 ion mang điện trái dấu.
C. các hạt mang điện trái dấu.
D. hạt nhân và các hạt electron hóa trị.
Câu 12: Điện hóa trị của Mg và Cl trong MgCl2 theo thứ tự là:
A. 2 và 1. B. 2+ và 1–.
C. +2 và –1. D. 2+ và 2–
Câu 13: Hợp chất nào tồn tại liên kết ion?
A. NH4Cl. B. HCl.
C. NH3. D. H2O.
Câu 14: Nội dung nào chưa đúng khi nói về ion?
A. Ion là những phân tử mang điện.
B. Ion âm được gọi là cation, ion dương được gọi là anion.
C. Ion có thể chia thành 2 loại: ion đơn nguyên tử và ion đa nguyên tử.
D. Ion được tạo thành khi nguyên tử nhường hoặc nhận electron.
Câu 15: Liên kết hóa học hình thành giữa các ion được gọi là:
A. liên kết anion – cation.
B. liên kết ion hóa.
C. liên kết tĩnh điện.
D. liên kết ion.
Câu 16: Tính chất nào phù hợp nhất với liên kết ion?
A. Có tính định hướng và có tính bão hòa
B. Không có tính định hướng, không có tính bão hòa
C. Không có tính định hướng và có tính bão hòa
D. Có tính định hướng, không có tính bão hòa
Câu 17: Hầu hết các hợp chất ion thường:
A. có nhiệt độ nóng chảy và nhiệt độ sôi khá cao.
B. dễ có thể hòa tan trong các dung môi hữu cơ.
C. ở trong trạng thái nóng chảy thường không dẫn điện.
D. có khả năng tan trong nước tạo thành dung dịch không điện li.
Câu 18: Hợp chất tạo bởi Clo và nguyên tố nào chứa liên kết ion?
A. Ca, Ba, Si
B. Cs, Ba, K
C. Mg, P, S
D. Be, Mg, C
Câu 19: Bản chất hóa học của liên kết ion là lực hút tĩnh điện giữa:
A. 2 ion.
B. 2 ion mang điện trái dấu.
C. các hạt mang điện trái dấu.
D. hạt nhân và các hạt electron hóa trị.
Câu 20: Điện hóa trị của Mg và Cl trong MgCl2 theo thứ tự là:
A. 2 và 1.
B. 2+ và 1–.
C. +2 và –1.
D. 2+ và 2–
Đáp án tham khảo:
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
|---|---|---|---|---|---|---|---|---|---|
| C | A | C | D | B | D | C | C | C | A |
| 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
| B | B | A | B | D | B | A | B | B | B |
FAQ Về Liên Kết Ion và Tài Liệu Học Tập Tại Tic.edu.vn
-
Liên kết ion là gì và tại sao nó quan trọng?
Liên kết ion là lực hút tĩnh điện giữa các ion trái dấu, tạo nên các hợp chất ion bền vững, đóng vai trò quan trọng trong nhiều phản ứng hóa học.
-
Điều kiện nào cần thiết để hình thành liên kết ion?
Sự chênh lệch độ âm điện giữa hai nguyên tử liên kết phải lớn (thường ≥ 1.7) và một nguyên tử phải là kim loại điển hình, nguyên tử kia là phi kim điển hình.
-
Liên kết ion khác liên kết cộng hóa trị như thế nào?
Liên kết ion là sự chuyển electron, tạo ion trái dấu hút nhau, còn liên kết cộng hóa trị là sự góp chung electron.
-
Những loại hợp chất nào thường có liên kết ion?
Các hợp chất giữa kim loại nhóm IA, IIA và phi kim nhóm VIIA, Oxi thường có liên kết ion (ví dụ: NaCl, MgO).
-
Mạng tinh thể ion là gì và nó ảnh hưởng đến tính chất của hợp chất ion như thế nào?
Mạng tinh thể ion là sự sắp xếp các ion theo cấu trúc hình học nhất định, làm cho hợp chất ion có độ cứng cao, nhiệt độ nóng chảy và nhiệt độ sôi cao.
-
Tại sao hợp chất ion thường dẫn điện khi hòa tan trong nước hoặc nóng chảy mà không dẫn điện ở trạng thái rắn?
Trong trạng thái rắn, các ion bị cố định trong mạng tinh thể, không thể di chuyển tự do. Khi hòa tan hoặc nóng chảy, các ion được giải phóng và di chuyển tự do, dẫn điện.
-
Làm thế nào để xác định một hợp chất có liên kết ion hay không?
Dựa vào độ âm điện của các nguyên tố tham gia liên kết và tính chất của hợp chất (nhiệt độ nóng chảy, khả năng dẫn điện).
-
Tôi có thể tìm thêm tài liệu và bài tập về liên kết ion ở đâu trên tic.edu.vn?
Bạn có thể tìm kiếm theo từ khóa “liên kết ion”, “hóa học lớp 10” hoặc truy cập vào mục “Tài liệu hóa học” trên website.
-
Tic.edu.vn có cung cấp các công cụ hỗ trợ học tập nào để giúp tôi hiểu rõ hơn về liên kết ion không?
Chúng tôi cung cấp các bài giảng chi tiết, bài tập trắc nghiệm, bài tập tự luận có lời giải và các video thí nghiệm minh họa.
-
Làm thế nào để tôi có thể trao đổi kiến thức và kinh nghiệm học tập về liên kết ion với những người khác trên tic.edu.vn?
Bạn có thể tham gia vào diễn đàn hoặc nhóm học tập trực tuyến của tic.edu.vn để thảo luận và chia sẻ kiến thức với các bạn học và giáo viên.
Khám phá ngay nguồn tài liệu học tập phong phú và các công cụ hỗ trợ hiệu quả tại tic.edu.vn để chinh phục kiến thức về liên kết ion và các chủ đề hóa học khác! Hãy để tic.edu.vn đồng hành cùng bạn trên con đường học tập!
Liên hệ với chúng tôi:
- Email: tic.edu@gmail.com
- Website: tic.edu.vn
Bạn đang gặp khó khăn trong việc tìm kiếm tài liệu học tập chất lượng? Bạn muốn nâng cao hiệu quả học tập và kết nối với cộng đồng học tập sôi nổi? Hãy truy cập tic.edu.vn ngay hôm nay để khám phá kho tài liệu phong phú, các công cụ hỗ trợ học tập hiệu quả và cơ hội giao lưu, học hỏi từ những người cùng chí hướng. tic.edu.vn sẽ giúp bạn tự tin chinh phục mọi thử thách trên con đường học vấn.