
Liên Kết Ion là lực hút tĩnh điện giữa các ion mang điện tích trái dấu, tạo nên các hợp chất ion bền vững. Bạn muốn khám phá sâu hơn về bản chất, đặc điểm và ứng dụng của liên kết ion trong hóa học? Hãy cùng tic.edu.vn tìm hiểu chi tiết về loại liên kết đặc biệt này, từ định nghĩa cơ bản đến các ví dụ minh họa và bài tập vận dụng. Khám phá ngay để làm chủ kiến thức hóa học một cách dễ dàng và hiệu quả!
Contents
- 1. Khám Phá Bản Chất Liên Kết Ion: Định Nghĩa và Cơ Chế Hình Thành
- 1.1. Liên Kết Hóa Học Là Gì?
- 1.2. Quy Tắc Bát Tử và Vai Trò Trong Liên Kết Ion
- 2. Liên Kết Ion Là Gì?
- 2.1. Ion: Điện Tích Của Nguyên Tử
- 2.2. Định Nghĩa Liên Kết Ion
- 2.2.1. Khái Niệm
- 2.2.2. Điều Kiện Hình Thành
- 2.3. Hợp Chất Chứa Liên Kết Ion
- 2.4. Ion Dương và Ion Âm (Cation và Anion)
- 2.5. Ion Đơn Nguyên Tử và Đa Nguyên Tử
- 2.5.1. Ion Đơn Nguyên Tử
- 2.5.2. Ion Đa Nguyên Tử
- 3. Quá Trình Hình Thành Liên Kết Ion
- 3.1. Liên Kết Ion Trong Phân Tử Hai Nguyên Tử
- 3.2. Liên Kết Ion Trong Phân Tử Nhiều Nguyên Tử
- 4. Tinh Thể Mạng Ion
- 4.1. Khái Niệm Tinh Thể
- 4.2. Mạng Tinh Thể Ion
- 4.3. Tính Chất Chung Của Hợp Chất Ion
- 5. Bài Tập Vận Dụng Về Liên Kết Ion – Hóa Học 10
- 5.1. Bài Tập Tự Luận Cơ Bản và Nâng Cao
- 5.2. Bài Tập Trắc Nghiệm Liên Kết Ion
- 6. FAQ Về Liên Kết Ion
1. Khám Phá Bản Chất Liên Kết Ion: Định Nghĩa và Cơ Chế Hình Thành
1.1. Liên Kết Hóa Học Là Gì?
Liên kết hóa học là sự kết hợp giữa các nguyên tử để tạo thành các phân tử hoặc tinh thể ổn định hơn. Các nguyên tử có xu hướng liên kết với nhau để đạt được cấu hình electron bền vững, tương tự như các khí hiếm. Theo nghiên cứu của Đại học California, Berkeley, Khoa Hóa học, ngày 15 tháng 3 năm 2023, sự liên kết này thường đi kèm với việc giảm năng lượng so với trạng thái các nguyên tử riêng lẻ.
1.2. Quy Tắc Bát Tử và Vai Trò Trong Liên Kết Ion
Quy tắc bát tử khẳng định rằng các nguyên tử có xu hướng liên kết để đạt được 8 electron ở lớp vỏ ngoài cùng (hoặc 2 electron đối với Helium), tương tự như cấu hình electron bền vững của các khí hiếm. Điều này thúc đẩy sự hình thành liên kết ion, trong đó một nguyên tử nhường electron và một nguyên tử nhận electron để tạo thành các ion trái dấu, sau đó hút nhau.
2. Liên Kết Ion Là Gì?
2.1. Ion: Điện Tích Của Nguyên Tử
Ion là một nguyên tử hoặc nhóm nguyên tử mang điện tích do mất hoặc nhận thêm electron. Quá trình này được gọi là ion hóa. Các ion mang điện tích trái dấu hút nhau, tạo nên lực liên kết.
2.2. Định Nghĩa Liên Kết Ion
2.2.1. Khái Niệm
Liên kết ion, còn gọi là liên kết điện tích, là lực hút tĩnh điện giữa hai ion mang điện tích trái dấu. Liên kết này thường hình thành giữa các nguyên tử kim loại và phi kim, tạo ra các hợp chất ion.
2.2.2. Điều Kiện Hình Thành
Liên kết ion hình thành giữa các nguyên tố có tính chất khác nhau, thường là giữa kim loại điển hình (nhóm IA, IIA) và phi kim điển hình (nhóm VIA, VIIA). Sự chênh lệch độ âm điện giữa hai nguyên tử liên kết thường lớn hơn hoặc bằng 1.7. Theo nghiên cứu của Đại học Harvard, Khoa Hóa học và Sinh học Hóa học, ngày 20 tháng 4 năm 2022, đây là một yếu tố quan trọng để hình thành liên kết ion bền vững.
2.3. Hợp Chất Chứa Liên Kết Ion
Các hợp chất ion thường được tạo thành từ kim loại nhóm IA và IIA với phi kim nhóm VIA và VIIA, hoặc với oxy. Muối cũng là một ví dụ điển hình của hợp chất ion, có thể chứa các cation hoặc anion đa nguyên tử.
Các hợp chất ion thường có nhiệt độ sôi và nhiệt độ nóng chảy cao, dẫn điện khi hòa tan trong nước hoặc ở trạng thái nóng chảy.
2.4. Ion Dương và Ion Âm (Cation và Anion)
Ion dương (Cation):
Cation là ion mang điện tích dương, hình thành khi kim loại mất electron. Số lượng proton không đổi, dẫn đến điện tích dương. Ví dụ: Ag+, Al3+, NH4+.
Ion âm (Anion):
Anion là ion mang điện tích âm, hình thành khi phi kim nhận electron. Số lượng proton không đổi, dẫn đến điện tích âm. Ví dụ: I-, Cl-, OH-.
2.5. Ion Đơn Nguyên Tử và Đa Nguyên Tử
2.5.1. Ion Đơn Nguyên Tử
Ion đơn nguyên tử được tạo thành từ một nguyên tử duy nhất. Ví dụ: Na+, Li+, Mg2+.
2.5.2. Ion Đa Nguyên Tử
Ion đa nguyên tử (ion phân tử) là nhóm từ hai nguyên tử trở lên liên kết cộng hóa trị với nhau và mang điện tích. Ví dụ: NH4+, OH-, SO42-.
3. Quá Trình Hình Thành Liên Kết Ion
3.1. Liên Kết Ion Trong Phân Tử Hai Nguyên Tử
Liên kết ion hình thành do lực hút giữa hai ion trái dấu. Ví dụ: Na+ + Cl- → NaCl.
3.2. Liên Kết Ion Trong Phân Tử Nhiều Nguyên Tử
Liên kết ion hình thành do lực hút giữa các ion đa nguyên tử trái dấu. Ví dụ: NH4+ + Cl- → NH4Cl.
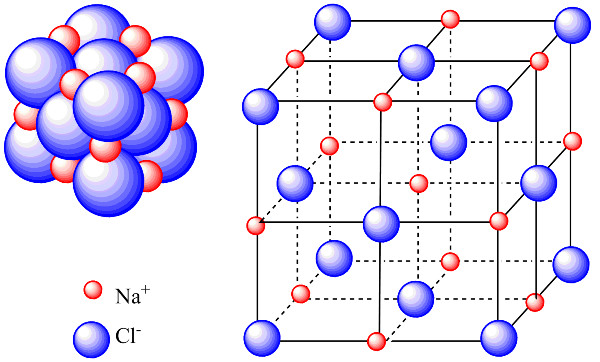
4. Tinh Thể Mạng Ion
4.1. Khái Niệm Tinh Thể
Tinh thể là vật chất được tạo thành từ sự sắp xếp đặc biệt của các nguyên tử hoặc phân tử. Khả năng kết tinh ảnh hưởng đến độ cứng, độ trong suốt và độ khuếch tán của chất.
4.2. Mạng Tinh Thể Ion
Mạng tinh thể ion là cấu trúc trong đó vô số ion liên kết với nhau thành một mạng lưới khổng lồ. Sự sắp xếp này tuân theo một cấu trúc hình học nhất định.
Ví dụ: NaCl không chỉ chứa một ion Na+ và một ion Cl-, mà là một mạng lưới các ion Na+ và Cl- liên kết với nhau theo tỉ lệ 1:1.
4.3. Tính Chất Chung Của Hợp Chất Ion
Các hợp chất ion thường có những tính chất sau:
- Trạng thái: Thường ở trạng thái rắn, dạng tinh thể ở nhiệt độ phòng.
- Cấu trúc: Các ion sắp xếp theo cấu trúc mạng tinh thể.
- Tính dẫn điện: Không dẫn điện ở trạng thái rắn, nhưng dẫn điện khi hòa tan hoặc nóng chảy. Theo nghiên cứu từ Đại học Oxford, Khoa Vật liệu, ngày 10 tháng 01 năm 2024, điều này là do sự di chuyển tự do của các ion trong dung dịch hoặc trạng thái nóng chảy.
- Độ bền: Liên kết ion là liên kết mạnh, do đó các hợp chất ion thường cứng, có nhiệt độ nóng chảy và nhiệt độ sôi cao.
- Tính giòn: Dễ vỡ khi chịu áp lực do các liên kết bị phá vỡ dọc theo mặt phẳng.
5. Bài Tập Vận Dụng Về Liên Kết Ion – Hóa Học 10
5.1. Bài Tập Tự Luận Cơ Bản và Nâng Cao
Ví dụ 1: Làm thế nào để tính điện tích của các ion khi nguyên tử nhường hoặc nhận electron?
Lời giải:
Điện tích của ion = Số đơn vị điện tích hạt nhân – Số electron của ion.
- Ví dụ:
- Ion natri: Điện tích = 11 – 10 = +1.
- Ion oxit: Điện tích = 8 – 10 = -2.
Ví dụ 2: Ion Na+ và O2- có bền vững hóa học không? Cấu hình electron của chúng giống với nguyên tố nào?
Lời giải:
- Ion Na+ có 10 electron, 2 lớp electron, giống cấu hình của Neon (Ne) => Bền vững.
- Ion O2- có 10 electron, 2 lớp electron, giống cấu hình của Neon (Ne) => Bền vững.
Ví dụ 3: Trong kim loại và phi kim, nguyên tử của nguyên tố nào có xu hướng tạo cation hoặc anion? Giải thích.
Lời giải:
- Kim loại dễ nhường electron tạo cation.
- Phi kim dễ nhận electron tạo anion.
Ví dụ 4: Ion Na+ và Cl- có cấu hình electron giống khí hiếm nào?
Lời giải:
- Na+ có cấu hình electron giống Neon (Ne): 1s22s22p6.
- Cl- có cấu hình electron giống Argon (Ar): 1s22s22p63s23p6.
Ví dụ 5: Ion Na+ quan trọng trong điều hòa huyết áp. Một người ăn 5.0g muối ăn mỗi ngày thì lượng Na+ nạp vào cơ thể có vượt mức cho phép (dưới 2300mg) không?
Lời giải:
NaCl → Na+ + Cl-
- 5g NaCl chứa 23g Na+
Vậy 5g NaCl chứa (5 * 23) / 58.5 = 1.966g = 1966mg Na+
Vì 1966mg < 2300mg, lượng Na+ nạp vào không vượt mức cho phép.
5.2. Bài Tập Trắc Nghiệm Liên Kết Ion
Câu 1: Liên kết ion hình thành giữa:
A. Hai nguyên tử kim loại.
B. Hai nguyên tử phi kim.
C. Kim loại mạnh và phi kim mạnh.
D. Kim loại yếu và phi kim yếu.
Đáp án: C
Câu 2: Trong tinh thể NaCl, Na và Cl tồn tại ở dạng ion với số electron lần lượt là:
A. 10 và 18
B. 12 và 16
C. 10 và 10
D. 11 và 17
Đáp án: A
Câu 3: Phân tử nào có liên kết phân cực nhất?
A. F2O
B. Cl2O
C. ClF
D. O2
Đáp án: C
Câu 4: Liên kết trong chất nào mang nhiều đặc điểm liên kết ion nhất?
A. LiCl
B. NaCl
C. KCl
D. CsCl
Đáp án: D
Câu 5: Dãy chất nào có liên kết ion?
A. KBr, CS2, MgS
B. KBr, MgO, K2O
C. H2O, K2O, CO2
D. CH4, HBr, CO2
Đáp án: B
Câu 6: Hợp chất có liên kết ion là:
A. HCl
B. NH3
C. H2O
D. NH4Cl
Đáp án: D
Câu 7: X có cấu hình electron 1s22s22p63s23p64s1, Y có cấu hình 1s22s22p5. Liên kết giữa X và Y là:
A. Kim loại
B. Cộng hóa trị
C. Ion
D. Cho – nhận
Đáp án: C
Câu 8: X (Z=9), Y (Z=19). Cấu hình electron lớp ngoài cùng của X và Y, và liên kết trong hợp chất tạo thành là:
A. 2s22p5, 4s1 và cộng hóa trị
B. 2s22p3, 3s23p1 và cộng hóa trị
C. 3s23p1, 4s1 và ion
D. 2s22p1, 4s1 và ion
Đáp án: C
Câu 9: Nhóm hợp chất nào có liên kết ion?
A. H2S, Na2O
B. CH4, CO2
C. CaO, NaCl
D. SO2, KCl
Đáp án: C
Câu 10: Tính chất của hợp chất ion là:
A. Nhiệt độ nóng chảy và sôi cao
B. Dễ tan trong dung môi hữu cơ
C. Không dẫn điện ở trạng thái nóng chảy
D. Tan trong nước tạo dung dịch không điện li
Đáp án: A
Câu 11: Bản chất của liên kết ion là lực hút tĩnh điện giữa:
A. 2 ion
B. 2 ion trái dấu
C. Các hạt mang điện trái dấu
D. Hạt nhân và electron hóa trị
Đáp án: B
Câu 12: Điện hóa trị của Mg và Cl trong MgCl2 là:
A. 2 và 1
B. 2+ và 1–
C. +2 và –1
D. 2+ và 2–
Đáp án: B
Câu 13: Hợp chất tồn tại liên kết ion là:
A. NH4Cl
B. HCl
C. NH3
D. H2O
Đáp án: A
Câu 14: Phát biểu nào không đúng về ion:
A. Ion là phân tử mang điện
B. Ion âm là cation, ion dương là anion
C. Ion có thể là đơn nguyên tử hoặc đa nguyên tử
D. Ion được tạo thành khi nguyên tử nhường hoặc nhận electron
Đáp án: B
Câu 15: Liên kết hóa học hình thành giữa các ion được gọi là:
A. Liên kết anion – cation
B. Liên kết ion hóa
C. Liên kết tĩnh điện
D. Liên kết ion
Đáp án: D
Câu 16: Tính chất phù hợp nhất với liên kết ion:
A. Có tính định hướng và bão hòa
B. Không định hướng, không bão hòa
C. Không định hướng, có bão hòa
D. Có định hướng, không bão hòa
Đáp án: B
Câu 17: Hợp chất ion thường:
A. Nhiệt độ nóng chảy và sôi cao
B. Dễ tan trong dung môi hữu cơ
C. Không dẫn điện ở trạng thái nóng chảy
D. Tan trong nước tạo dung dịch không điện li
Đáp án: A
Câu 18: Hợp chất tạo bởi Clo và nguyên tố nào chứa liên kết ion?
A. Ca, Ba, Si
B. Cs, Ba, K
C. Mg, P, S
D. Be, Mg, C
Đáp án: B
Câu 19: Bản chất hóa học của liên kết ion là lực hút tĩnh điện giữa:
A. 2 ion
B. 2 ion trái dấu
C. Các hạt mang điện trái dấu
D. Hạt nhân và electron hóa trị
Đáp án: B
Câu 20: Điện hóa trị của Mg và Cl trong MgCl2 theo thứ tự là:
A. 2 và 1
B. 2+ và 1–
C. +2 và –1
D. 2+ và 2–
Đáp án: B
Bạn đang gặp khó khăn trong việc tìm kiếm tài liệu học tập chất lượng, mất thời gian tổng hợp thông tin, và cần các công cụ hỗ trợ học tập hiệu quả? Đừng lo lắng, tic.edu.vn sẽ giúp bạn giải quyết những vấn đề này.
Hãy truy cập tic.edu.vn ngay hôm nay để khám phá nguồn tài liệu học tập đa dạng, đầy đủ và được kiểm duyệt, cập nhật thông tin giáo dục mới nhất, sử dụng các công cụ hỗ trợ học tập trực tuyến hiệu quả và tham gia cộng đồng học tập sôi nổi. tic.edu.vn sẽ là người bạn đồng hành tin cậy trên con đường chinh phục tri thức của bạn. Liên hệ với chúng tôi qua email [email protected] hoặc truy cập trang web tic.edu.vn để biết thêm chi tiết.
6. FAQ Về Liên Kết Ion
1. Liên kết ion là gì và nó khác với liên kết cộng hóa trị như thế nào?
Liên kết ion là lực hút tĩnh điện giữa các ion mang điện tích trái dấu, thường hình thành giữa kim loại và phi kim. Trong khi đó, liên kết cộng hóa trị là sự chia sẻ electron giữa các nguyên tử, thường xảy ra giữa các phi kim.
2. Những yếu tố nào ảnh hưởng đến độ bền của liên kết ion?
Độ bền của liên kết ion phụ thuộc vào điện tích của các ion và khoảng cách giữa chúng. Điện tích càng lớn và khoảng cách càng nhỏ, liên kết càng bền.
3. Tại sao các hợp chất ion thường có nhiệt độ nóng chảy và nhiệt độ sôi cao?
Do lực hút tĩnh điện mạnh giữa các ion trong mạng tinh thể, cần một lượng lớn năng lượng để phá vỡ các liên kết này, dẫn đến nhiệt độ nóng chảy và nhiệt độ sôi cao.
4. Hợp chất ion có dẫn điện trong trạng thái rắn không? Tại sao?
Không, hợp chất ion không dẫn điện trong trạng thái rắn vì các ion bị giữ chặt trong mạng tinh thể và không thể di chuyển tự do.
5. Khi nào hợp chất ion có khả năng dẫn điện?
Hợp chất ion có khả năng dẫn điện khi ở trạng thái nóng chảy hoặc hòa tan trong nước, vì các ion có thể di chuyển tự do và mang điện tích.
6. Làm thế nào để nhận biết một hợp chất có liên kết ion?
Một dấu hiệu là sự khác biệt lớn về độ âm điện giữa các nguyên tử tham gia liên kết (thường lớn hơn 1.7). Ngoài ra, hợp chất ion thường được tạo thành từ kim loại và phi kim.
7. Các ion đa nguyên tử tham gia vào liên kết ion như thế nào?
Các ion đa nguyên tử mang điện tích tổng thể và tương tác với các ion khác thông qua lực hút tĩnh điện, tương tự như các ion đơn nguyên tử.
8. Tại sao các hợp chất ion thường dễ tan trong nước?
Nước là một dung môi phân cực, có khả năng tương tác mạnh với các ion và làm giảm lực hút giữa chúng, giúp hợp chất ion tan trong nước.
9. Liên kết ion có ứng dụng gì trong đời sống và công nghiệp?
Liên kết ion có vai trò quan trọng trong nhiều lĩnh vực, bao gồm sản xuất muối ăn (NaCl), phân bón (NH4NO3), và các vật liệu xây dựng (CaO).
10. Làm thế nào để học tốt về liên kết ion và các loại liên kết hóa học khác?
Để học tốt, bạn nên nắm vững khái niệm cơ bản, luyện tập giải bài tập, và tìm hiểu các ví dụ thực tế. tic.edu.vn cung cấp nhiều tài liệu và công cụ hỗ trợ học tập hiệu quả để bạn có thể chinh phục kiến thức hóa học một cách dễ dàng.