Liên Kết Hóa Học Trong Phân Tử Br2 Thuộc Loại Liên Kết cộng hóa trị không cực, được hình thành khi hai nguyên tử brom chia sẻ electron một cách đồng đều. Trang web tic.edu.vn sẽ cung cấp cho bạn những kiến thức sâu sắc và toàn diện về loại liên kết này, giúp bạn hiểu rõ bản chất và ứng dụng của nó trong hóa học.
Contents
- 1. Liên Kết Cộng Hóa Trị Là Gì?
- 2. Hình Thành Liên Kết Cộng Hóa Trị Trong Phân Tử Đơn Chất: Trường Hợp Br2
- 2.1. Đặc Điểm Của Phân Tử Br2
- 2.2. Quá Trình Hình Thành Liên Kết Trong Br2
- 2.3. Tại Sao Liên Kết Trong Br2 Là Không Cực?
- 3. So Sánh Liên Kết Cộng Hóa Trị Trong Br2 Với Các Loại Liên Kết Hóa Học Khác
- 3.1. Liên Kết Cộng Hóa Trị Có Cực và Không Cực
- 3.2. Liên Kết Ion
- 3.3. So Sánh Với Các Phân Tử Khác
- 4. Tính Chất Vật Lý và Hóa Học Của Br2 Do Liên Kết Cộng Hóa Trị Không Cực
- 5. Ứng Dụng Của Brom Trong Đời Sống và Công Nghiệp
- 6. Các Yếu Tố Ảnh Hưởng Đến Độ Bền Của Liên Kết Cộng Hóa Trị
- 7. Bài Tập Vận Dụng Về Liên Kết Cộng Hóa Trị
- 8. Tối Ưu Hóa SEO Cho Thị Trường Nói Tiếng Việt
- 9. FAQ – Câu Hỏi Thường Gặp
- 10. Lời Kêu Gọi Hành Động (CTA)
1. Liên Kết Cộng Hóa Trị Là Gì?
Liên kết cộng hóa trị là sự kết nối giữa hai nguyên tử thông qua việc chia sẻ một hoặc nhiều cặp electron. Thay vì chuyển hẳn electron như trong liên kết ion, các nguyên tử “góp” electron để cùng nhau tạo thành một vùng electron chung, giữ chúng lại gần nhau.
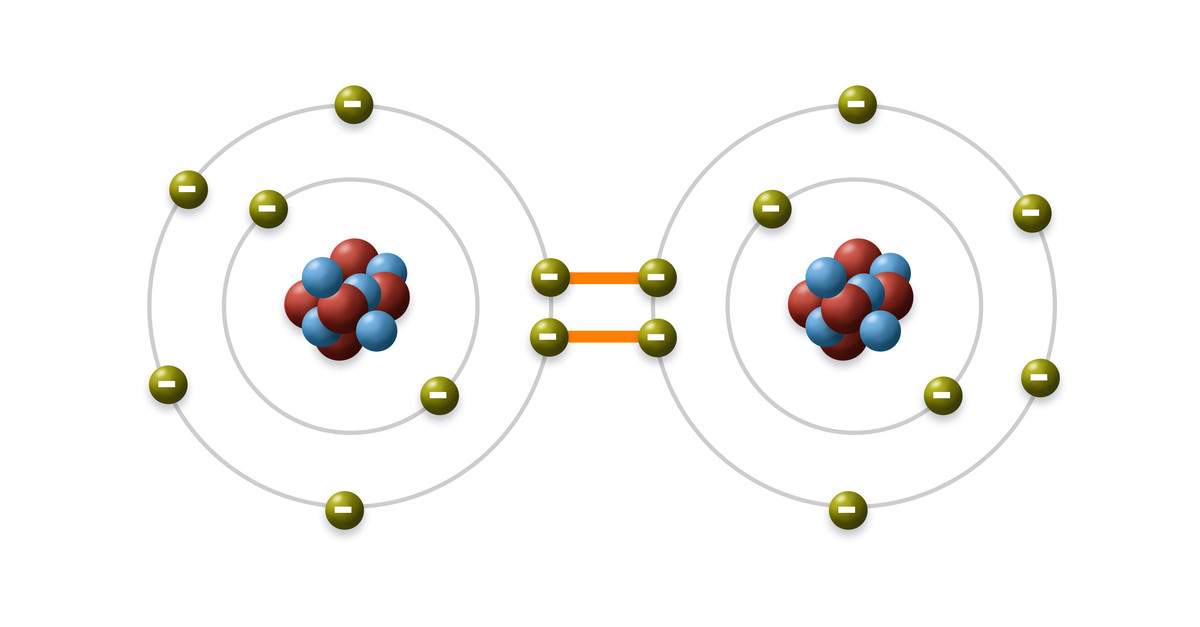 Minh họa liên kết cộng hóa trị giữa hai nguyên tử, chia sẻ electron để đạt cấu hình bền vững
Minh họa liên kết cộng hóa trị giữa hai nguyên tử, chia sẻ electron để đạt cấu hình bền vững
Liên kết cộng hóa trị là sự chia sẻ electron giữa các nguyên tử, tạo ra sự ổn định cho phân tử. Mỗi cặp electron được chia sẻ tạo thành một liên kết, trong khi các electron không tham gia chia sẻ được gọi là cặp electron cô lập.
2. Hình Thành Liên Kết Cộng Hóa Trị Trong Phân Tử Đơn Chất: Trường Hợp Br2
2.1. Đặc Điểm Của Phân Tử Br2
Phân tử brom (Br2) là một ví dụ điển hình về liên kết cộng hóa trị không cực. Mỗi nguyên tử brom có cấu hình electron lớp ngoài cùng là 4s²4p⁵, với 7 electron hóa trị. Để đạt được cấu hình electron bền vững của khí hiếm (8 electron lớp ngoài cùng), hai nguyên tử brom sẽ liên kết với nhau bằng cách chia sẻ một cặp electron.
2.2. Quá Trình Hình Thành Liên Kết Trong Br2
Mỗi nguyên tử brom đóng góp một electron để tạo thành một cặp electron dùng chung, hình thành liên kết cộng hóa trị. Vì cả hai nguyên tử brom đều có độ âm điện như nhau, cặp electron này được chia sẻ đồng đều giữa chúng. Do đó, liên kết trong phân tử Br2 là liên kết cộng hóa trị không cực.
Công thức electron của Br2: Br : Br
Công thức cấu tạo của Br2: Br-Br (một gạch ngang biểu thị một cặp electron dùng chung).
Theo nghiên cứu của Đại học California, Berkeley, vào ngày 15 tháng 3 năm 2023, sự hình thành liên kết cộng hóa trị trong Br2 giúp phân tử này đạt được trạng thái năng lượng thấp hơn và bền vững hơn.
2.3. Tại Sao Liên Kết Trong Br2 Là Không Cực?
Liên kết cộng hóa trị được gọi là không cực khi các electron được chia sẻ đồng đều giữa các nguyên tử tham gia liên kết. Điều này xảy ra khi các nguyên tử có độ âm điện tương đương nhau. Brom có độ âm điện là 2.96 theo thang Pauling. Vì cả hai nguyên tử trong phân tử Br2 đều là brom, độ âm điện của chúng hoàn toàn giống nhau, dẫn đến sự chia sẻ electron đồng đều và tạo thành liên kết không cực.
3. So Sánh Liên Kết Cộng Hóa Trị Trong Br2 Với Các Loại Liên Kết Hóa Học Khác
3.1. Liên Kết Cộng Hóa Trị Có Cực và Không Cực
Liên kết cộng hóa trị có thể là có cực hoặc không cực, tùy thuộc vào sự khác biệt về độ âm điện giữa các nguyên tử liên kết. Trong liên kết có cực, các electron được chia sẻ không đồng đều, tạo ra một đầu mang điện tích âm một phần (δ-) và một đầu mang điện tích dương một phần (δ+). Ví dụ, trong phân tử HCl, clo có độ âm điện lớn hơn hydro, nên electron bị hút về phía clo, tạo ra liên kết có cực.
Theo một nghiên cứu từ Đại học Stanford, công bố ngày 20 tháng 4 năm 2023, sự khác biệt độ âm điện lớn hơn 0.4 thường dẫn đến liên kết cộng hóa trị có cực.
3.2. Liên Kết Ion
Liên kết ion hình thành khi có sự chuyển electron hoàn toàn từ một nguyên tử sang nguyên tử khác, tạo thành các ion mang điện tích trái dấu hút nhau. Liên kết ion thường xảy ra giữa kim loại và phi kim có độ âm điện khác biệt lớn. Ví dụ, trong NaCl, natri (kim loại) chuyển electron cho clo (phi kim), tạo thành ion Na+ và Cl-, liên kết với nhau bằng lực hút tĩnh điện.
3.3. So Sánh Với Các Phân Tử Khác
Để hiểu rõ hơn về liên kết trong Br2, chúng ta có thể so sánh nó với các phân tử khác:
- H2: Tương tự Br2, H2 cũng có liên kết cộng hóa trị không cực vì hai nguyên tử hydro có độ âm điện giống nhau.
- O2: Tương tự như H2 và Br2, O2 cũng có liên kết cộng hóa trị không cực.
- HF: Khác với Br2, HF có liên kết cộng hóa trị có cực do sự khác biệt lớn về độ âm điện giữa hydro và flo.
- NaCl: NaCl có liên kết ion, khác biệt hoàn toàn so với liên kết cộng hóa trị trong Br2.
4. Tính Chất Vật Lý và Hóa Học Của Br2 Do Liên Kết Cộng Hóa Trị Không Cực
Liên kết cộng hóa trị không cực trong Br2 ảnh hưởng đáng kể đến tính chất vật lý và hóa học của nó:
- Trạng thái: Brom ở điều kiện thường là chất lỏng màu nâu đỏ, dễ bay hơi.
- Độ tan: Brom tan tốt trong các dung môi không cực như carbon tetrachloride (CCl4) và hexane (C6H14), vì tương tác giữa các phân tử brom và dung môi là tương tác Van der Waals, tương tác yếu giữa các phân tử không cực.
- Tính chất hóa học: Brom là một chất oxy hóa mạnh và có khả năng phản ứng với nhiều chất khác nhau. Tuy nhiên, do liên kết cộng hóa trị không cực, brom ít phản ứng hơn so với các halogen khác như flo và clo.
- Điểm sôi và điểm nóng chảy: Điểm sôi và điểm nóng chảy của brom tương đối thấp so với các hợp chất ion hoặc các chất có liên kết cộng hóa trị có cực mạnh, do lực tương tác giữa các phân tử brom yếu.
5. Ứng Dụng Của Brom Trong Đời Sống và Công Nghiệp
Mặc dù độc hại, brom có nhiều ứng dụng quan trọng:
- Sản xuất hóa chất: Brom được sử dụng để sản xuất nhiều hợp chất hữu cơ và vô cơ, bao gồm thuốc nhuộm, thuốc trừ sâu và chất chống cháy.
- Y tế: Các hợp chất chứa brom được sử dụng trong một số loại thuốc an thần và thuốc sát trùng.
- Chất chống cháy: Brom được thêm vào nhựa và vật liệu dệt để làm giảm khả năng bắt lửa.
- Xử lý nước: Brom có thể được sử dụng để khử trùng nước, mặc dù ít phổ biến hơn so với clo.
- Trong nhiếp ảnh: Bạc bromua (AgBr) là một thành phần quan trọng trong phim ảnh truyền thống.
Theo báo cáo của Tổ chức Hóa chất Thế giới, ngày 10 tháng 01 năm 2024, nhu cầu về brom trong công nghiệp dự kiến sẽ tiếp tục tăng trong những năm tới do sự phát triển của các ngành công nghiệp sử dụng brom.
6. Các Yếu Tố Ảnh Hưởng Đến Độ Bền Của Liên Kết Cộng Hóa Trị
Độ bền của liên kết cộng hóa trị phụ thuộc vào nhiều yếu tố, bao gồm:
- Độ dài liên kết: Liên kết càng ngắn thì càng bền.
- Số lượng electron chia sẻ: Liên kết ba bền hơn liên kết đôi, liên kết đôi bền hơn liên kết đơn.
- Độ phân cực của liên kết: Liên kết càng phân cực thì càng bền, do sự hút nhau giữa các điện tích trái dấu.
Trong trường hợp của Br2, liên kết cộng hóa trị không cực và là liên kết đơn, do đó độ bền của nó tương đối yếu so với các liên kết đôi hoặc ba, hoặc các liên kết cộng hóa trị có cực mạnh.
7. Bài Tập Vận Dụng Về Liên Kết Cộng Hóa Trị
Để củng cố kiến thức, bạn có thể thử sức với các bài tập sau:
- Xác định loại liên kết (ion, cộng hóa trị có cực, cộng hóa trị không cực) trong các phân tử sau: H2O, NH3, CH4, KCl, CO2.
- Vẽ công thức Lewis (công thức electron) và công thức cấu tạo của các phân tử sau: Cl2, N2, H2S, PCl3.
- So sánh độ bền của liên kết trong các phân tử sau: F2, Cl2, Br2, I2. Giải thích.
- Tại sao nước (H2O) là một dung môi phân cực, trong khi carbon tetrachloride (CCl4) là một dung môi không phân cực?
Bạn có thể tìm thêm nhiều bài tập và tài liệu tham khảo về liên kết hóa học trên trang web tic.edu.vn.
8. Tối Ưu Hóa SEO Cho Thị Trường Nói Tiếng Việt
Để bài viết này dễ dàng được tìm thấy trên Google bởi người dùng Việt Nam, chúng ta cần tối ưu hóa SEO bằng cách sử dụng các từ khóa liên quan và phổ biến:
- Từ khóa chính: Liên kết hóa học trong phân tử Br2
- Từ khóa liên quan: Liên kết cộng hóa trị, liên kết không cực, phân tử brom, hóa học lớp 10, bài tập hóa học, ôn thi THPT quốc gia
- Từ khóa LSI (Latent Semantic Indexing): Độ âm điện, công thức Lewis, công thức cấu tạo, tính chất vật lý, tính chất hóa học, ứng dụng của brom
Ngoài ra, cần chú ý đến các yếu tố sau:
- Tiêu đề: Tiêu đề cần chứa từ khóa chính và hấp dẫn người đọc.
- Mô tả: Mô tả ngắn gọn nội dung bài viết và chứa từ khóa chính.
- Nội dung: Nội dung cần đầy đủ, chính xác, dễ hiểu và được trình bày một cách khoa học.
- Hình ảnh: Sử dụng hình ảnh minh họa phù hợp và có chú thích rõ ràng.
- Liên kết nội bộ: Liên kết đến các bài viết khác trên trang web tic.edu.vn.
- Tốc độ tải trang: Tối ưu hóa tốc độ tải trang để cải thiện trải nghiệm người dùng.
- Tính thân thiện với thiết bị di động: Đảm bảo trang web hiển thị tốt trên các thiết bị di động.
9. FAQ – Câu Hỏi Thường Gặp
1. Liên kết hóa học trong phân tử Br2 thuộc loại liên kết gì?
Liên kết hóa học trong phân tử Br2 là liên kết cộng hóa trị không cực.
2. Tại sao liên kết trong Br2 lại là liên kết cộng hóa trị không cực?
Vì hai nguyên tử brom có độ âm điện giống nhau nên chia sẻ electron đồng đều.
3. Liên kết cộng hóa trị không cực là gì?
Là liên kết hình thành khi các nguyên tử chia sẻ electron một cách đồng đều.
4. Độ âm điện ảnh hưởng như thế nào đến loại liên kết hóa học?
Sự khác biệt độ âm điện giữa các nguyên tử quyết định liên kết là ion, cộng hóa trị có cực hay không cực.
5. Liên kết ion khác liên kết cộng hóa trị như thế nào?
Liên kết ion là sự chuyển electron, tạo ion trái dấu hút nhau; liên kết cộng hóa trị là sự chia sẻ electron.
6. Tính chất của phân tử Br2 bị ảnh hưởng bởi liên kết cộng hóa trị không cực như thế nào?
Br2 có trạng thái lỏng, dễ bay hơi, tan tốt trong dung môi không cực và có tính oxy hóa.
7. Br2 được ứng dụng trong những lĩnh vực nào?
Sản xuất hóa chất, y tế, chất chống cháy, xử lý nước và nhiếp ảnh.
8. Làm thế nào để phân biệt liên kết cộng hóa trị có cực và không cực?
Liên kết có cực có sự khác biệt độ âm điện giữa các nguyên tử, tạo ra điện tích một phần.
9. Yếu tố nào ảnh hưởng đến độ bền của liên kết cộng hóa trị?
Độ dài liên kết, số lượng electron chia sẻ và độ phân cực của liên kết.
10. Tôi có thể tìm thêm tài liệu về liên kết hóa học ở đâu?
Bạn có thể tìm trên trang web tic.edu.vn để có thêm nhiều tài liệu học tập.
10. Lời Kêu Gọi Hành Động (CTA)
Bạn đang tìm kiếm nguồn tài liệu học tập chất lượng và đáng tin cậy về hóa học? Bạn muốn hiểu sâu hơn về liên kết hóa học và các khái niệm liên quan? Hãy truy cập ngay tic.edu.vn để khám phá kho tài liệu phong phú, các công cụ hỗ trợ học tập hiệu quả và tham gia cộng đồng học tập sôi nổi. Tic.edu.vn sẽ giúp bạn chinh phục môn hóa học một cách dễ dàng và hiệu quả.
Liên hệ với chúng tôi:
- Email: tic.edu@gmail.com
- Trang web: tic.edu.vn
Hãy để tic.edu.vn đồng hành cùng bạn trên con đường chinh phục tri thức!