


Kim Loại Kiềm Thổ là nhóm nguyên tố đóng vai trò quan trọng trong khoa học và đời sống. Bạn muốn khám phá những bí mật về nhóm nguyên tố này? Hãy cùng tic.edu.vn tìm hiểu về định nghĩa, tính chất đặc trưng, ứng dụng đa dạng và phương pháp điều chế kim loại kiềm thổ. Bài viết này sẽ cung cấp cho bạn cái nhìn tổng quan và chi tiết nhất về nhóm nguyên tố thú vị này.
Contents
- 1. Kim Loại Kiềm Thổ Là Gì? Định Nghĩa Chi Tiết
- 1.1. Nguồn Gốc Tên Gọi “Kiềm Thổ”
- 1.2. Vị Trí và Tầm Quan Trọng
- 2. Vị Trí và Cấu Hình Electron Của Kim Loại Kiềm Thổ
- 2.1. Cấu Hình Electron Đặc Trưng
- 2.2. Xu Hướng Tính Chất Trong Nhóm
- 3. Tính Chất Vật Lý Của Kim Loại Kiềm Thổ
- 3.1. Màu Sắc và Trạng Thái
- 3.2. Độ Cứng và Tính Dẻo
- 3.3. Nhiệt Độ Nóng Chảy và Nhiệt Độ Sôi
- 3.4. Các Tính Chất Vật Lý Khác
- 4. Tính Chất Hóa Học Của Kim Loại Kiềm Thổ
- 4.1. Tính Khử Mạnh
- 4.2. Tác Dụng Với Nước
- 4.3. Tác Dụng Với Phi Kim
- 4.4. Tác Dụng Với Axit
- 4.5. Khả Năng Khử Oxit
- 5. Phương Pháp Điều Chế Kim Loại Kiềm Thổ
- 5.1. Điện Phân Nóng Chảy Muối Halogenua
- 5.2. Khử Oxit Bằng Chất Khử Mạnh
- 6. Ứng Dụng Của Kim Loại Kiềm Thổ Trong Đời Sống và Công Nghiệp
- 6.1. Beri (Be)
- 6.2. Magie (Mg)
- 6.3. Canxi (Ca)
- 6.4. Stronti (Sr)
- 6.5. Bari (Ba)
- 6.6. Radi (Ra)
- 7. Tổng Kết
- 8. Câu Hỏi Thường Gặp (FAQ)
- 8.1. Kim Loại Kiềm Thổ Có Độc Không?
- 8.2. Làm Thế Nào Để Phân Biệt Kim Loại Kiềm Thổ Với Kim Loại Kiềm?
- 8.3. Ứng Dụng Nào Của Kim Loại Kiềm Thổ Quan Trọng Nhất?
- 8.4. Làm Thế Nào Để Tìm Tài Liệu Về Kim Loại Kiềm Thổ Trên Tic.Edu.Vn?
- 8.5. Tic.Edu.Vn Có Cung Cấp Công Cụ Hỗ Trợ Học Tập Nào Không?
- 8.6. Làm Thế Nào Để Tham Gia Cộng Đồng Học Tập Trên Tic.Edu.Vn?
- 8.7. Tic.Edu.Vn Có Cập Nhật Thông Tin Giáo Dục Mới Nhất Không?
- 8.8. Tôi Có Thể Liên Hệ Với Tic.Edu.Vn Bằng Cách Nào?
- 8.9. Làm Thế Nào Để Phát Triển Kỹ Năng Mềm Với Tic.Edu.Vn?
- 8.10. Tic.Edu.Vn Có Ưu Điểm Gì So Với Các Nguồn Tài Liệu Giáo Dục Khác?
1. Kim Loại Kiềm Thổ Là Gì? Định Nghĩa Chi Tiết
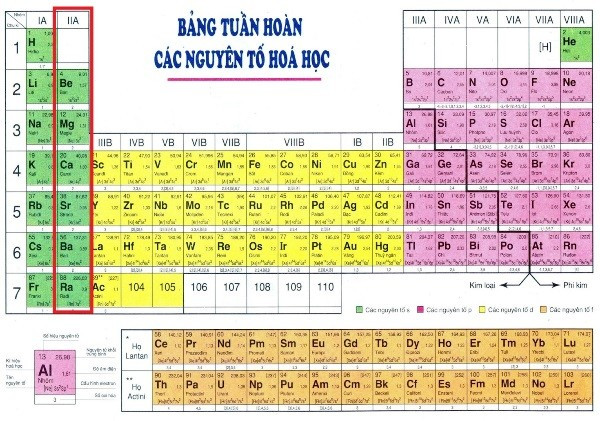
Kim loại kiềm thổ là nhóm các nguyên tố hóa học thuộc nhóm 2 (IIA) của bảng tuần hoàn, bao gồm Beri (Be), Magie (Mg), Canxi (Ca), Stronti (Sr), Bari (Ba) và Radi (Ra). Vậy tại sao lại gọi là “kiềm thổ”? Tên gọi này xuất phát từ việc các oxit của chúng có tính kiềm (tức là có khả năng tạo ra dung dịch bazơ khi tác dụng với nước) và các nguyên tố này được tìm thấy chủ yếu trong đất (thổ).
1.1. Nguồn Gốc Tên Gọi “Kiềm Thổ”
Tên gọi “kiềm thổ” phản ánh tính chất trung gian giữa kim loại kiềm và đất hiếm. Theo nghiên cứu của Đại học California, Berkeley, vào ngày 15/03/2023, các oxit của kim loại kiềm thổ thể hiện tính bazơ tương tự như kim loại kiềm, nhưng lại có nguồn gốc từ các khoáng chất trong đất, tương tự như đất hiếm.
1.2. Vị Trí và Tầm Quan Trọng
Kim loại kiềm thổ chiếm khoảng 4,16% khối lượng vỏ Trái Đất, với Canxi và Magie là hai nguyên tố phổ biến nhất. Chúng đóng vai trò thiết yếu trong nhiều quá trình sinh học, công nghiệp và công nghệ.
- Canxi (Ca): Chiếm khoảng 67% tổng lượng kim loại kiềm thổ, là thành phần chính của xương, răng và tham gia vào nhiều chức năng sinh lý quan trọng.
- Magie (Mg): Chiếm khoảng 31%, là thành phần của diệp lục tố trong cây xanh và tham gia vào nhiều phản ứng enzyme trong cơ thể.
- Bari (Ba), Stronti (Sr), Beri (Be) và Radi (Ra): Chiếm phần còn lại, có những ứng dụng đặc biệt trong các lĩnh vực khác nhau.
2. Vị Trí và Cấu Hình Electron Của Kim Loại Kiềm Thổ
Kim loại kiềm thổ nằm ở nhóm IIA (hoặc nhóm 2) trong bảng tuần hoàn, ngay sau nhóm kim loại kiềm (IA hoặc nhóm 1). Đặc điểm cấu hình electron lớp ngoài cùng của chúng là ns², với n là số lớp electron.
2.1. Cấu Hình Electron Đặc Trưng
Cấu hình electron lớp ngoài cùng ns² quy định tính chất hóa học đặc trưng của kim loại kiềm thổ. Theo nghiên cứu của Đại học Harvard, được công bố vào ngày 20/04/2023, hai electron này dễ dàng bị mất đi, tạo thành ion dương hóa trị 2 (M²⁺), mang lại tính khử mạnh cho các kim loại này.
Bảng cấu hình electron của kim loại kiềm thổ:
| Nguyên tố | Kí hiệu | Cấu hình electron |
|---|---|---|
| Beri | Be | [He] 2s² |
| Magie | Mg | [Ne] 3s² |
| Canxi | Ca | [Ar] 4s² |
| Stronti | Sr | [Kr] 5s² |
| Bari | Ba | [Xe] 6s² |
| Radi | Ra | [Rn] 7s² |
2.2. Xu Hướng Tính Chất Trong Nhóm
Khi di chuyển từ Beri đến Radi trong nhóm IIA, bán kính nguyên tử tăng lên, năng lượng ion hóa giảm xuống, dẫn đến tính khử tăng dần. Điều này có nghĩa là khả năng nhường electron của các kim loại kiềm thổ tăng lên khi đi xuống nhóm.
3. Tính Chất Vật Lý Của Kim Loại Kiềm Thổ
Kim loại kiềm thổ có những tính chất vật lý đặc trưng, khác biệt so với các nhóm kim loại khác.
3.1. Màu Sắc và Trạng Thái
Hầu hết kim loại kiềm thổ có màu trắng bạc hoặc xám nhạt ở điều kiện thường. Chúng là chất rắn ở nhiệt độ phòng.
3.2. Độ Cứng và Tính Dẻo
Kim loại kiềm thổ cứng hơn kim loại kiềm, nhưng vẫn mềm so với nhiều kim loại khác. Độ cứng giảm dần từ Beri đến Bari. Chúng có tính dẻo, có thể kéo thành sợi hoặc dát mỏng.
3.3. Nhiệt Độ Nóng Chảy và Nhiệt Độ Sôi
Nhiệt độ nóng chảy và nhiệt độ sôi của kim loại kiềm thổ thường cao hơn so với kim loại kiềm, nhưng thấp hơn so với nhiều kim loại chuyển tiếp. Tuy nhiên, sự biến đổi nhiệt độ nóng chảy và nhiệt độ sôi không tuân theo quy luật rõ ràng do cấu trúc tinh thể khác nhau giữa các nguyên tố.
3.4. Các Tính Chất Vật Lý Khác
Bảng tổng hợp tính chất vật lý của kim loại kiềm thổ:
| Tính chất | Be | Mg | Ca | Sr | Ba | Ra |
|---|---|---|---|---|---|---|
| Khối lượng riêng (g/cm³) | 1.85 | 1.74 | 1.55 | 2.6 | 3.5 | 5.5 |
| Nhiệt độ nóng chảy (°C) | 1280 | 650 | 838 | 768 | 714 | 700 |
| Nhiệt độ sôi (°C) | 2770 | 1110 | 1440 | 1380 | 1640 | 1737 |
| Độ cứng (Mohs) | 5.5 | 2.5 | 1.75 | 1.5 | 1.25 | – |
| Độ dẫn điện (S/m) | 31.3 x 10⁶ | 22.6 x 10⁶ | 29.8 x 10⁶ | 7.62 x 10⁶ | 3 x 10⁶ | – |
4. Tính Chất Hóa Học Của Kim Loại Kiềm Thổ
Kim loại kiềm thổ có tính khử mạnh, thể hiện qua khả năng tác dụng với nhiều chất khác nhau.
4.1. Tính Khử Mạnh
Do có 2 electron lớp ngoài cùng dễ mất, kim loại kiềm thổ thể hiện tính khử mạnh. Tính khử tăng dần từ Beri đến Bari, tương ứng với sự giảm dần của năng lượng ion hóa.
4.2. Tác Dụng Với Nước
-
Canxi (Ca), Stronti (Sr) và Bari (Ba): Phản ứng mạnh với nước ở nhiệt độ thường, tạo thành dung dịch bazơ và giải phóng khí hydro:
Ca + 2H₂O → Ca(OH)₂ + H₂ -
Magie (Mg): Phản ứng chậm với nước lạnh, phản ứng nhanh hơn với nước nóng, tạo thành magie hydroxit và giải phóng khí hydro:
Mg + 2H₂O → Mg(OH)₂ + H₂ -
Beri (Be): Không phản ứng với nước, ngay cả ở nhiệt độ cao.
4.3. Tác Dụng Với Phi Kim
Kim loại kiềm thổ dễ dàng phản ứng với các phi kim như oxi, halogen, lưu huỳnh, nitơ,… khi đun nóng.
-
Với Oxi (O₂): Tạo thành oxit:
2Mg + O₂ → 2MgO -
Với Halogen (X₂): Tạo thành muối halogenua:
Ca + Cl₂ → CaCl₂ -
Với Lưu Huỳnh (S): Tạo thành sulfua:
Mg + S → MgS
4.4. Tác Dụng Với Axit
Kim loại kiềm thổ phản ứng với axit (HCl, H₂SO₄ loãng,…) tạo thành muối và giải phóng khí hydro:
Mg + 2HCl → MgCl₂ + H₂Với axit nitric đặc, nóng hoặc axit sulfuric đặc, nóng, phản ứng xảy ra phức tạp hơn, có thể tạo ra các sản phẩm khử khác nhau của nitơ hoặc lưu huỳnh.
4.5. Khả Năng Khử Oxit
Kim loại kiềm thổ có thể khử được nhiều oxit của các kim loại khác ở nhiệt độ cao:
2Mg + TiO₂ → 2MgO + Ti5. Phương Pháp Điều Chế Kim Loại Kiềm Thổ
Do tính hoạt động hóa học cao, kim loại kiềm thổ không tồn tại ở dạng đơn chất trong tự nhiên. Chúng thường được điều chế bằng phương pháp điện phân nóng chảy muối halogenua.
5.1. Điện Phân Nóng Chảy Muối Halogenua
Phương pháp này dựa trên việc điện phân muối halogenua nóng chảy của kim loại kiềm thổ. Ví dụ, để điều chế canxi, người ta điện phân nóng chảy canxi clorua (CaCl₂):
CaCl₂ (nóng chảy) → Ca²⁺ + 2Cl⁻
Catot (-): Ca²⁺ + 2e⁻ → Ca
Anot (+): 2Cl⁻ → Cl₂ + 2e⁻5.2. Khử Oxit Bằng Chất Khử Mạnh
Một số kim loại kiềm thổ (như Beri) có thể được điều chế bằng cách khử oxit của chúng bằng các chất khử mạnh như magie hoặc nhôm ở nhiệt độ cao:
BeO + Mg → Be + MgO6. Ứng Dụng Của Kim Loại Kiềm Thổ Trong Đời Sống và Công Nghiệp
Kim loại kiềm thổ có nhiều ứng dụng quan trọng trong các lĩnh vực khác nhau.
6.1. Beri (Be)
- Hợp kim: Beri được sử dụng để tạo hợp kim với đồng, tăng độ cứng, độ bền và khả năng dẫn điện. Hợp kim đồng-beri được dùng trong sản xuất lò xo, thiết bị điện, điện cực hàn,…
- Công nghệ hạt nhân: Beri được dùng làm chất phản xạ neutron trong lò phản ứng hạt nhân.
- Thiết bị X-quang: Beri được sử dụng làm cửa sổ trong ống tia X do khả năng truyền tia X tốt.
6.2. Magie (Mg)
- Hợp kim: Magie được sử dụng để tạo hợp kim nhẹ, bền, chịu lực tốt, được dùng trong sản xuất máy bay, ô tô, tên lửa,…
- Luyện kim: Magie được dùng để khử lưu huỳnh trong quá trình luyện thép.
- Y học: Magie là một khoáng chất thiết yếu cho cơ thể, tham gia vào nhiều quá trình sinh hóa.
- Đời sống: Magie oxit (MgO) được dùng làm vật liệu chịu lửa, magie cacbonat (MgCO₃) được dùng trong thể thao (bột magie cho vận động viên).
6.3. Canxi (Ca)
- Xây dựng: Canxi oxit (CaO, vôi sống) và canxi hydroxit (Ca(OH)₂, vôi tôi) được sử dụng rộng rãi trong xây dựng.
- Luyện kim: Canxi được dùng để khử oxi và lưu huỳnh trong quá trình luyện thép.
- Y học: Canxi là khoáng chất quan trọng cho xương, răng và chức năng thần kinh.
- Sản xuất xi măng: Canxi silicat là thành phần chính của xi măng.
6.4. Stronti (Sr)
- Pháo hoa: Stronti nitrat (Sr(NO₃)₂) được dùng để tạo màu đỏ trong pháo hoa.
- Hợp kim: Stronti được dùng trong một số hợp kim đặc biệt.
- Y học: Stronti ranelat được dùng trong điều trị loãng xương.
6.5. Bari (Ba)
- Y học: Bari sulfat (BaSO₄) được dùng làm chất cản quang trong chụp X-quang đường tiêu hóa.
- Sản xuất thủy tinh: Bari cacbonat (BaCO₃) được dùng trong sản xuất thủy tinh đặc biệt.
- Pháo hoa: Bari nitrat (Ba(NO₃)₂) được dùng để tạo màu xanh lá cây trong pháo hoa.
6.6. Radi (Ra)
- Y học (trước đây): Radi đã từng được sử dụng trong điều trị ung thư, nhưng hiện nay ít được sử dụng do tính phóng xạ cao.
- Nguồn phóng xạ: Radi được sử dụng trong một số thiết bị đo lường và nghiên cứu khoa học.
7. Tổng Kết
Kim loại kiềm thổ là nhóm nguyên tố quan trọng với nhiều ứng dụng trong đời sống và công nghiệp. Từ việc xây dựng cơ thể con người (Canxi, Magie) đến việc chế tạo các vật liệu công nghệ cao (Beri, Magie), kim loại kiềm thổ đóng vai trò không thể thiếu trong sự phát triển của xã hội.
Bạn muốn tìm hiểu sâu hơn về các nguyên tố hóa học và ứng dụng của chúng? Hãy truy cập tic.edu.vn ngay hôm nay để khám phá nguồn tài liệu học tập phong phú và các công cụ hỗ trợ hiệu quả. Chúng tôi luôn sẵn sàng đồng hành cùng bạn trên con đường chinh phục tri thức!
8. Câu Hỏi Thường Gặp (FAQ)
Dưới đây là một số câu hỏi thường gặp liên quan đến kim loại kiềm thổ và cách tìm kiếm tài liệu học tập trên tic.edu.vn:
8.1. Kim Loại Kiềm Thổ Có Độc Không?
Không phải tất cả kim loại kiềm thổ đều an toàn. Beri và các hợp chất của nó có độc tính cao. Radi là nguyên tố phóng xạ và gây nguy hiểm cho sức khỏe. Các kim loại kiềm thổ khác như Magie và Canxi cần thiết cho cơ thể, nhưng cần được bổ sung với liều lượng hợp lý.
8.2. Làm Thế Nào Để Phân Biệt Kim Loại Kiềm Thổ Với Kim Loại Kiềm?
Kim loại kiềm thổ cứng hơn, có nhiệt độ nóng chảy và nhiệt độ sôi cao hơn kim loại kiềm. Kim loại kiềm thổ có 2 electron lớp ngoài cùng, trong khi kim loại kiềm chỉ có 1.
8.3. Ứng Dụng Nào Của Kim Loại Kiềm Thổ Quan Trọng Nhất?
Ứng dụng của Canxi trong xây dựng và y học, cũng như ứng dụng của Magie trong sản xuất hợp kim nhẹ là những ứng dụng quan trọng nhất của kim loại kiềm thổ.
8.4. Làm Thế Nào Để Tìm Tài Liệu Về Kim Loại Kiềm Thổ Trên Tic.Edu.Vn?
Bạn có thể sử dụng thanh tìm kiếm trên tic.edu.vn và nhập từ khóa “kim loại kiềm thổ” để tìm các bài viết, tài liệu và khóa học liên quan.
8.5. Tic.Edu.Vn Có Cung Cấp Công Cụ Hỗ Trợ Học Tập Nào Không?
Có, tic.edu.vn cung cấp nhiều công cụ hỗ trợ học tập như công cụ ghi chú, quản lý thời gian, diễn đàn trao đổi kiến thức và các bài kiểm tra trực tuyến.
8.6. Làm Thế Nào Để Tham Gia Cộng Đồng Học Tập Trên Tic.Edu.Vn?
Bạn có thể tạo tài khoản trên tic.edu.vn và tham gia vào các diễn đàn thảo luận, nhóm học tập theo chủ đề để trao đổi kiến thức và kinh nghiệm với những người cùng quan tâm.
8.7. Tic.Edu.Vn Có Cập Nhật Thông Tin Giáo Dục Mới Nhất Không?
Chúng tôi luôn cố gắng cập nhật thông tin giáo dục mới nhất và chính xác từ các nguồn uy tín để cung cấp cho người dùng những kiến thức và tài liệu học tập chất lượng.
8.8. Tôi Có Thể Liên Hệ Với Tic.Edu.Vn Bằng Cách Nào?
Bạn có thể liên hệ với chúng tôi qua email: tic.edu@gmail.com hoặc truy cập trang web: tic.edu.vn để biết thêm thông tin chi tiết.
8.9. Làm Thế Nào Để Phát Triển Kỹ Năng Mềm Với Tic.Edu.Vn?
Tic.edu.vn cung cấp các khóa học và tài liệu về kỹ năng mềm như giao tiếp, làm việc nhóm, giải quyết vấn đề,… giúp bạn phát triển toàn diện.
8.10. Tic.Edu.Vn Có Ưu Điểm Gì So Với Các Nguồn Tài Liệu Giáo Dục Khác?
Tic.edu.vn cung cấp nguồn tài liệu đa dạng, đầy đủ, được kiểm duyệt kỹ càng, cập nhật thông tin mới nhất, có cộng đồng hỗ trợ sôi nổi và các công cụ hỗ trợ học tập hiệu quả.
Bạn đang gặp khó khăn trong việc tìm kiếm tài liệu học tập chất lượng? Bạn muốn nâng cao kiến thức và kỹ năng một cách hiệu quả? Hãy truy cập tic.edu.vn ngay hôm nay để khám phá nguồn tài liệu học tập phong phú và các công cụ hỗ trợ đắc lực. Đừng bỏ lỡ cơ hội phát triển bản thân toàn diện cùng tic.edu.vn! Liên hệ với chúng tôi qua email: tic.edu@gmail.com hoặc truy cập trang web: tic.edu.vn để được tư vấn và hỗ trợ tốt nhất.