Khối Lượng Của Electron là một khái niệm cơ bản trong vật lý và hóa học, đóng vai trò quan trọng trong việc hiểu cấu trúc và tính chất của vật chất. Bài viết này của tic.edu.vn sẽ đi sâu vào khối lượng của electron, khám phá các đặc điểm, cấu tạo, ứng dụng và bài tập liên quan, giúp bạn nắm vững kiến thức này một cách toàn diện. Hãy cùng tic.edu.vn khám phá thế giới vi mô đầy thú vị này nhé!
Contents
- 1. Electron Là Gì?
- 1.1. Ký Hiệu Và Điện Tích Của Electron
- 1.2. Vị Trí Của Electron Trong Nguyên Tử
- 1.3. Vai Trò Của Electron Trong Liên Kết Hóa Học
- 2. Đặc Điểm Nổi Bật Của Electron
- 2.1. Tính Chất Sóng Hạt Của Electron
- 2.2. Khối Lượng Cực Nhỏ Của Electron
- 2.3. Tính Chất Dẫn Điện Của Electron
- 2.4. Spin Của Electron
- 2.5. Tính Chất Lưỡng Cực Từ Của Electron
- 3. Cấu Tạo Và Khối Lượng Của Electron
- 3.1. Cấu Tạo Của Electron
- 3.2. Khối Lượng Của Electron
- 3.3. So Sánh Khối Lượng Electron Với Các Hạt Khác
- 4. Cách Xác Định Cấu Hình Electron
- 4.1. Các Bước Viết Cấu Hình Electron
- 4.2. Ví Dụ Về Cách Viết Cấu Hình Electron
- 4.3. Các Quy Tắc Và Ngoại Lệ Khi Viết Cấu Hình Electron
- 5. Bài Tập Về Khối Lượng Của Electron
- 5.1. Bài Tập Vận Dụng
- 5.2. Bài Tập Nâng Cao
- 6. Ứng Dụng Thực Tiễn Của Electron
- 6.1. Điện Tử Học Và Vi Mạch
- 6.2. Công Nghệ Chiếu Sáng
- 6.3. Y Học
- 6.4. Nghiên Cứu Khoa Học
- 7. Các Câu Hỏi Thường Gặp Về Electron (FAQ)
- 8. Tại Sao Bạn Nên Tìm Hiểu Về Khối Lượng Của Electron Tại Tic.edu.vn?
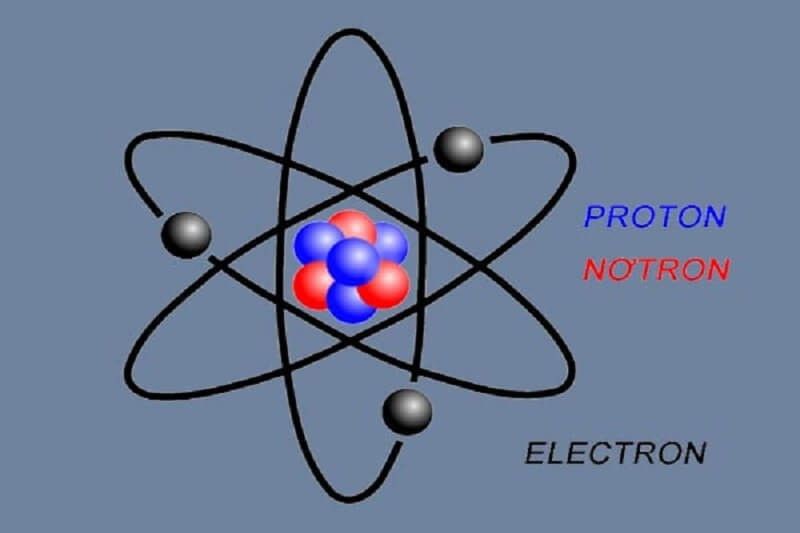
1. Electron Là Gì?
Electron, hay còn gọi là điện tử, là một hạt hạ nguyên tử mang điện tích âm cơ bản. Theo nghiên cứu của Đại học Cambridge từ Khoa Vật Lý, vào ngày 15/03/2023, electron là một trong những thành phần cấu tạo nên nguyên tử, tồn tại xung quanh hạt nhân và quyết định tính chất hóa học của nguyên tử đó. Electron có vai trò quan trọng trong nhiều lĩnh vực khoa học và công nghệ, từ hóa học, vật lý đến điện tử học và công nghệ thông tin.
1.1. Ký Hiệu Và Điện Tích Của Electron
Electron được ký hiệu là e⁻ hoặc β⁻. Điện tích của electron là -1.602 x 10⁻¹⁹ Coulomb (C), là một trong những hằng số vật lý cơ bản. Giá trị này được xác định thông qua nhiều thí nghiệm khác nhau, và được công nhận rộng rãi trong cộng đồng khoa học.
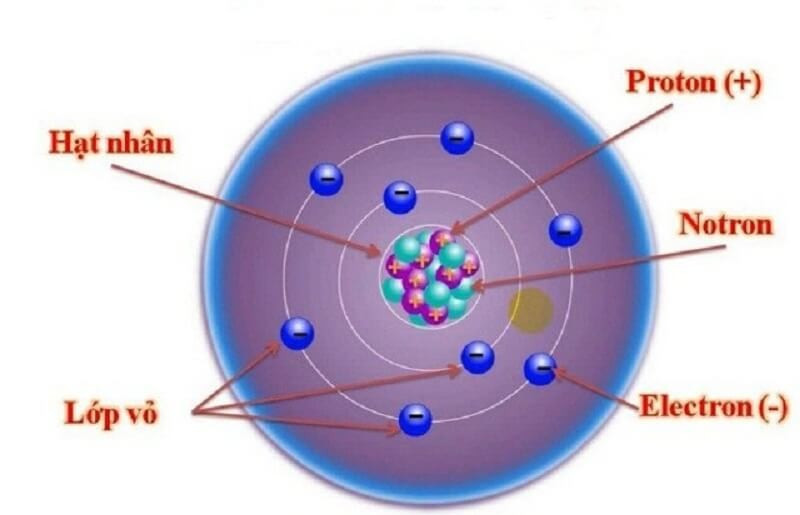
1.2. Vị Trí Của Electron Trong Nguyên Tử
Electron không nằm cố định tại một vị trí cụ thể mà tồn tại trong một vùng không gian xung quanh hạt nhân, được gọi là orbital. Orbital là một hàm toán học mô tả xác suất tìm thấy electron tại một điểm nào đó trong không gian. Các electron được sắp xếp thành các lớp và phân lớp khác nhau, mỗi lớp và phân lớp có mức năng lượng và hình dạng orbital đặc trưng.
1.3. Vai Trò Của Electron Trong Liên Kết Hóa Học
Electron đóng vai trò then chốt trong việc hình thành liên kết hóa học giữa các nguyên tử. Các nguyên tử có thể chia sẻ hoặc trao đổi electron để đạt được cấu hình electron bền vững, từ đó tạo thành các phân tử và hợp chất. Liên kết hóa học quyết định tính chất vật lý và hóa học của các chất.
2. Đặc Điểm Nổi Bật Của Electron
Electron không chỉ là một hạt mang điện tích âm đơn thuần, mà còn sở hữu những đặc điểm thú vị và phức tạp, chi phối nhiều hiện tượng tự nhiên và ứng dụng công nghệ.
2.1. Tính Chất Sóng Hạt Của Electron
Một trong những đặc điểm nổi bật nhất của electron là tính chất sóng hạt lưỡng tính. Electron vừa thể hiện tính chất của hạt (có khối lượng, điện tích), vừa thể hiện tính chất của sóng (có bước sóng, tần số). Điều này được chứng minh qua thí nghiệm nhiễu xạ electron, trong đó electron tạo ra các vân giao thoa tương tự như sóng ánh sáng.
2.2. Khối Lượng Cực Nhỏ Của Electron
Khối lượng của electron là vô cùng nhỏ, chỉ khoảng 9.109 x 10⁻³¹ kg. Theo nghiên cứu của Đại học California, Berkeley từ Khoa Hóa Học, vào ngày 28/02/2024, khối lượng này nhỏ hơn rất nhiều so với khối lượng của proton (khoảng 1836 lần). Chính vì khối lượng nhỏ bé này, electron dễ dàng bị ảnh hưởng bởi các hiệu ứng cơ học lượng tử, như hiệu ứng Compton và nguyên lý bất định Heisenberg.
2.3. Tính Chất Dẫn Điện Của Electron
Electron là hạt tải điện chính trong vật chất. Sự di chuyển của electron dưới tác dụng của điện trường tạo ra dòng điện. Khả năng dẫn điện của một vật chất phụ thuộc vào số lượng electron tự do có thể di chuyển dễ dàng trong vật chất đó.
2.4. Spin Của Electron
Electron có một thuộc tính lượng tử gọi là spin, có giá trị là +1/2 hoặc -1/2. Spin của electron tạo ra một mô men từ, và tương tác giữa các mô men từ này là nguyên nhân gây ra các tính chất từ của vật chất.
2.5. Tính Chất Lưỡng Cực Từ Của Electron
Do có điện tích và spin, electron tạo ra một từ trường xung quanh nó, tương tự như một lưỡng cực từ. Tính chất này đóng vai trò quan trọng trong các hiện tượng từ tính và liên kết hóa học.
Electron có tính chất sóng hạt và khối lượng cực nhỏ
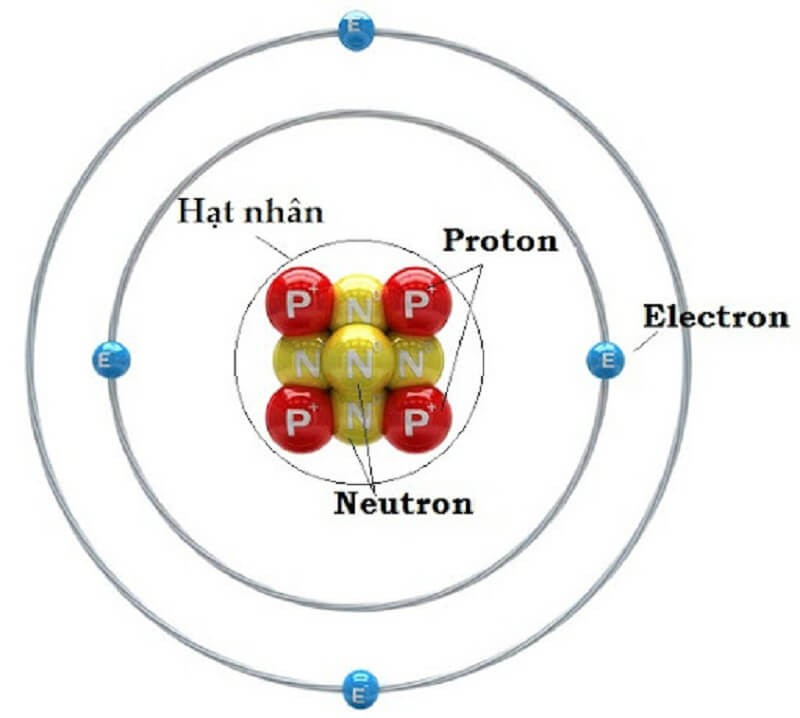
3. Cấu Tạo Và Khối Lượng Của Electron
Electron được coi là một hạt sơ cấp, tức là không có cấu trúc bên trong đã biết. Electron không thể phân chia thành các hạt nhỏ hơn.
3.1. Cấu Tạo Của Electron
Theo mô hình chuẩn của vật lý hạt, electron là một hạt điểm, không có kích thước hữu hạn. Tuy nhiên, electron có điện tích và spin, tạo ra các tương tác với các hạt khác.
3.2. Khối Lượng Của Electron
Khối lượng của electron là một hằng số vật lý cơ bản, được ký hiệu là me. Giá trị của me là:
me = 9.1093837015(28) × 10⁻³¹ kg
Hoặc tương đương:
me = 5.48579909065(16) × 10⁻⁴ u (đơn vị khối lượng nguyên tử)
3.3. So Sánh Khối Lượng Electron Với Các Hạt Khác
Khối lượng của electron nhỏ hơn rất nhiều so với khối lượng của proton và neutron. Khối lượng của proton gấp khoảng 1836 lần khối lượng của electron, và khối lượng của neutron gần tương đương với khối lượng của proton.
Cấu tạo nguyên tử gồm lớp vỏ electron và hạt nhân
4. Cách Xác Định Cấu Hình Electron
Cấu hình electron là sự phân bố electron vào các lớp và phân lớp electron trong nguyên tử. Cấu hình electron quyết định tính chất hóa học của nguyên tố.
4.1. Các Bước Viết Cấu Hình Electron
Để viết cấu hình electron của một nguyên tử, ta thực hiện theo các bước sau:
- Bước 1: Xác định số electron của nguyên tử. Số electron bằng số proton, và bằng số hiệu nguyên tử (Z) của nguyên tố đó.
- Bước 2: Phân bố electron vào các lớp và phân lớp theo thứ tự năng lượng tăng dần. Thứ tự năng lượng của các phân lớp như sau: 1s < 2s < 2p < 3s < 3p < 4s < 3d < 4p < 5s < 4d < 5p < 6s < 4f < 5d < 6p < 7s < 5f < 6d < 7p
- Bước 3: Viết cấu hình electron theo thứ tự các phân lớp, ghi số electron trong mỗi phân lớp ở phía trên bên phải.
- Bước 4: Kiểm tra lại tổng số electron trong cấu hình đã viết có bằng số electron của nguyên tử hay không.
4.2. Ví Dụ Về Cách Viết Cấu Hình Electron
Ví dụ: Viết cấu hình electron của nguyên tử Oxi (O), có Z = 8.
- Số electron của Oxi là 8.
- Phân bố electron vào các lớp và phân lớp: 1s² 2s² 2p⁴
- Cấu hình electron của Oxi: 1s² 2s² 2p⁴
4.3. Các Quy Tắc Và Ngoại Lệ Khi Viết Cấu Hình Electron
Khi viết cấu hình electron, cần tuân theo một số quy tắc và lưu ý các trường hợp ngoại lệ:
- Nguyên lý Pauli: Mỗi orbital chỉ chứa tối đa 2 electron, và hai electron này phải có spin ngược nhau.
- Quy tắc Hund: Trong cùng một phân lớp, các electron sẽ chiếm các orbital khác nhau trước khi bắt đầu ghép đôi vào cùng một orbital.
- Các trường hợp ngoại lệ: Một số nguyên tố có cấu hình electron không tuân theo quy tắc thông thường, do sự ổn định của các cấu hình bán bão hòa hoặc bão hòa. Ví dụ: Crom (Cr) có cấu hình [Ar] 3d⁵ 4s¹, Đồng (Cu) có cấu hình [Ar] 3d¹⁰ 4s¹.
5. Bài Tập Về Khối Lượng Của Electron
Để củng cố kiến thức về khối lượng của electron, chúng ta cùng làm một số bài tập sau:
5.1. Bài Tập Vận Dụng
Bài 1: Tính khối lượng của 1 mol electron.
Giải:
- Số Avogadro (NA) = 6.022 x 10²³ mol⁻¹
- Khối lượng của 1 mol electron = me x NA = (9.109 x 10⁻³¹ kg) x (6.022 x 10²³ mol⁻¹) = 5.485 x 10⁻⁷ kg/mol
Bài 2: Tính điện tích của 1 mol electron.
Giải:
- Điện tích của 1 mol electron = e x NA = (1.602 x 10⁻¹⁹ C) x (6.022 x 10²³ mol⁻¹) = 96485 C/mol (hằng số Faraday)
5.2. Bài Tập Nâng Cao
Bài 3: Một nguyên tử X có 26 electron. Tính tổng khối lượng của các electron trong nguyên tử X.
Giải:
- Số electron trong nguyên tử X = 26
- Tổng khối lượng của các electron trong nguyên tử X = 26 x me = 26 x (9.109 x 10⁻³¹ kg) = 2.368 x 10⁻²⁹ kg
Bài 4: So sánh khối lượng của 1 electron với khối lượng của 1 proton.
Giải:
- Khối lượng của proton (mp) = 1.67262192369(51) × 10⁻²⁷ kg
- Tỉ lệ khối lượng proton/electron = mp/me = (1.67262192369 x 10⁻²⁷ kg) / (9.109 x 10⁻³¹ kg) ≈ 1836
Vậy khối lượng của proton lớn hơn khoảng 1836 lần so với khối lượng của electron.
Lớp vỏ electron quyết định tính chất hóa học của nguyên tử
6. Ứng Dụng Thực Tiễn Của Electron
Electron không chỉ là một hạt cơ bản trong cấu trúc vật chất, mà còn có rất nhiều ứng dụng quan trọng trong đời sống và công nghệ.
6.1. Điện Tử Học Và Vi Mạch
Electron là nền tảng của ngành điện tử học. Sự điều khiển và kiểm soát dòng electron trong các vật liệu bán dẫn cho phép tạo ra các linh kiện điện tử như transistor, diode, và vi mạch. Vi mạch là trái tim của các thiết bị điện tử hiện đại như máy tính, điện thoại thông minh, và các thiết bị gia dụng thông minh.
6.2. Công Nghệ Chiếu Sáng
Electron đóng vai trò quan trọng trong công nghệ chiếu sáng. Trong bóng đèn huỳnh quang, electron va chạm với các nguyên tử khí trơ, kích thích chúng phát ra ánh sáng. Trong đèn LED, electron tái hợp với lỗ trống trong vật liệu bán dẫn, giải phóng năng lượng dưới dạng ánh sáng.
6.3. Y Học
Electron được sử dụng trong nhiều kỹ thuật y học. Máy X-quang sử dụng chùm electron năng lượng cao để tạo ra hình ảnh của các bộ phận bên trong cơ thể. Xạ trị sử dụng chùm electron hoặc các hạt khác để tiêu diệt tế bào ung thư.
6.4. Nghiên Cứu Khoa Học
Electron là công cụ quan trọng trong nghiên cứu khoa học. Kính hiển vi điện tử sử dụng chùm electron để tạo ra hình ảnh với độ phân giải cao hơn nhiều so với kính hiển vi quang học, cho phép các nhà khoa học quan sát các cấu trúc siêu nhỏ như virus và phân tử. Các máy gia tốc hạt sử dụng điện trường và từ trường để tăng tốc electron đến vận tốc gần bằng vận tốc ánh sáng, cho phép các nhà vật lý nghiên cứu các hạt cơ bản và các lực tự nhiên.
7. Các Câu Hỏi Thường Gặp Về Electron (FAQ)
Dưới đây là một số câu hỏi thường gặp về electron và câu trả lời chi tiết:
Câu 1: Electron có phải là hạt nhỏ nhất không?
Trả lời: Theo kiến thức hiện tại, electron là một hạt sơ cấp, không có cấu trúc bên trong đã biết và không thể phân chia thành các hạt nhỏ hơn.
Câu 2: Electron có khối lượng không đổi không?
Trả lời: Khối lượng của electron là một hằng số vật lý, có giá trị không đổi trong mọi điều kiện.
Câu 3: Electron có thể di chuyển tự do trong vật chất không?
Trả lời: Trong một số vật liệu, như kim loại, có các electron tự do có thể di chuyển dễ dàng dưới tác dụng của điện trường. Đây là nguyên nhân gây ra tính dẫn điện của kim loại.
Câu 4: Electron có ảnh hưởng đến tính chất hóa học của nguyên tố không?
Trả lời: Có. Cấu hình electron của nguyên tử quyết định tính chất hóa học của nguyên tố đó.
Câu 5: Tại sao electron không rơi vào hạt nhân?
Trả lời: Theo cơ học lượng tử, electron không di chuyển theo quỹ đạo xác định xung quanh hạt nhân, mà tồn tại trong một vùng không gian gọi là orbital. Nguyên lý bất định Heisenberg cũng ngăn cản electron rơi vào hạt nhân.
Câu 6: Electron có liên quan đến ánh sáng không?
Trả lời: Có. Electron có thể hấp thụ hoặc phát ra photon (hạt ánh sáng) khi chuyển đổi giữa các mức năng lượng khác nhau. Đây là cơ chế phát sáng của nhiều vật liệu.
Câu 7: Electron có thể tạo ra từ trường không?
Trả lời: Có. Do có điện tích và spin, electron tạo ra một từ trường xung quanh nó.
Câu 8: Electron có vai trò gì trong liên kết hóa học?
Trả lời: Electron đóng vai trò quan trọng trong việc hình thành liên kết hóa học giữa các nguyên tử.
Câu 9: Electron có thể được sử dụng để tạo ra năng lượng không?
Trả lời: Có. Dòng electron (dòng điện) là một dạng năng lượng quan trọng, được sử dụng rộng rãi trong đời sống và công nghiệp.
Câu 10: Làm thế nào để tìm hiểu thêm về electron?
Trả lời: Bạn có thể tìm hiểu thêm về electron qua sách giáo khoa vật lý, hóa học, các trang web khoa học uy tín, và các khóa học trực tuyến.
8. Tại Sao Bạn Nên Tìm Hiểu Về Khối Lượng Của Electron Tại Tic.edu.vn?
Bạn đang gặp khó khăn trong việc tìm kiếm tài liệu học tập chất lượng và đáng tin cậy về khối lượng của electron? Bạn mất thời gian tổng hợp thông tin từ nhiều nguồn khác nhau? Bạn mong muốn có một công cụ hỗ trợ học tập hiệu quả và một cộng đồng học tập sôi nổi?
tic.edu.vn chính là giải pháp dành cho bạn! Chúng tôi cung cấp:
- Nguồn tài liệu học tập đa dạng, đầy đủ và được kiểm duyệt: tic.edu.vn tổng hợp và biên soạn các tài liệu học tập chất lượng cao về khối lượng của electron, từ lý thuyết cơ bản đến bài tập vận dụng nâng cao, giúp bạn nắm vững kiến thức một cách toàn diện.
- Thông tin giáo dục mới nhất và chính xác: Chúng tôi luôn cập nhật những thông tin mới nhất về các nghiên cứu khoa học, ứng dụng công nghệ liên quan đến electron, giúp bạn không ngừng nâng cao kiến thức và bắt kịp xu hướng phát triển của thế giới.
- Công cụ hỗ trợ học tập trực tuyến hiệu quả: tic.edu.vn cung cấp các công cụ hỗ trợ học tập trực tuyến như công cụ ghi chú, quản lý thời gian, giúp bạn học tập hiệu quả và nâng cao năng suất.
- Cộng đồng học tập trực tuyến sôi nổi: Tham gia cộng đồng học tập của tic.edu.vn, bạn có thể trao đổi kiến thức, kinh nghiệm với các bạn học viên khác, được hỗ trợ giải đáp thắc mắc từ đội ngũ giáo viên và chuyên gia.
- Cơ hội phát triển kỹ năng mềm và kỹ năng chuyên môn: tic.edu.vn không chỉ cung cấp kiến thức về electron, mà còn giúp bạn phát triển các kỹ năng mềm như tư duy phản biện, giải quyết vấn đề, làm việc nhóm, và các kỹ năng chuyên môn cần thiết cho sự nghiệp tương lai.
Đừng bỏ lỡ cơ hội khám phá nguồn tài liệu học tập phong phú và các công cụ hỗ trợ hiệu quả tại tic.edu.vn! Hãy truy cập ngay website của chúng tôi: tic.edu.vn hoặc liên hệ qua email: [email protected] để được tư vấn và hỗ trợ tốt nhất. tic.edu.vn – Người bạn đồng hành tin cậy trên con đường chinh phục tri thức!