Hcl Là Axit Mạnh Hay Yếu là câu hỏi thường gặp của nhiều người. Bài viết này từ tic.edu.vn sẽ cung cấp cho bạn cái nhìn toàn diện về axit clohidric (HCl), từ định nghĩa, tính chất, ứng dụng, đến các lưu ý an toàn khi sử dụng, giúp bạn hiểu rõ hơn về loại axit quan trọng này. Chúng tôi sẽ đi sâu vào bản chất hóa học và so sánh với các axit khác để làm rõ độ mạnh của HCl.
Contents
- 1. Axit Clohidric (HCl) Là Gì? Tổng Quan Về HCl
- 1.1. Định Nghĩa Khoa Học Về Axit Clohidric
- 1.2. Các Tên Gọi Khác Của Axit HCl
- 1.3. Tính Chất Vật Lý Đặc Trưng Của HCl
- 1.4. Tính Chất Hóa Học Nổi Bật Của HCl
- 2. HCl Là Axit Mạnh Hay Yếu? So Sánh Với Các Axit Khác
- 2.1. Định Nghĩa Axit Mạnh Và Axit Yếu
- 2.2. Vì Sao HCl Được Xem Là Axit Mạnh?
- 2.3. So Sánh Độ Mạnh Của HCl Với Các Axit Vô Cơ Khác
- 2.4. So Sánh Độ Mạnh Của HCl Với Các Axit Hữu Cơ
- 2.5. Các Yếu Tố Ảnh Hưởng Đến Độ Mạnh Của Axit
- 3. Ứng Dụng Rộng Rãi Của Axit Clohidric Trong Thực Tế
- 3.1. Ứng Dụng Trong Công Nghiệp
- 3.2. Ứng Dụng Trong Phòng Thí Nghiệm
- 3.3. Ứng Dụng Trong Đời Sống Hàng Ngày
- 3.4. Ứng Dụng Trong Y Học
- 3.5. Nghiên Cứu Khoa Học
- 4. Lưu Ý Quan Trọng Khi Sử Dụng Và Bảo Quản Axit Clohidric
- 4.1. Biện Pháp An Toàn Khi Tiếp Xúc Với HCl
- 4.2. Quy Tắc Bảo Quản Axit Clohidric An Toàn
- 4.3. Xử Lý Sự Cố Rò Rỉ Hoặc Đổ Vãi HCl
- 4.4. Các Biện Pháp Phòng Ngừa Quan Trọng Khác
- 5. Ảnh Hưởng Của Axit Clohidric Đến Sức Khỏe Và Môi Trường
- 5.1. Ảnh Hưởng Đến Sức Khỏe Con Người
- 5.2. Ảnh Hưởng Đến Môi Trường
- 5.3. Biện Pháp Giảm Thiểu Tác Động Tiêu Cực
- 6. Mua Axit HCl Ở Đâu Đảm Bảo Chất Lượng Và An Toàn?
- 6.1. Lựa Chọn Nhà Cung Cấp Uy Tín
- 6.2. Kiểm Tra Thông Tin Sản Phẩm
- 6.3. Tuân Thủ Quy Định Pháp Luật
- 7. Tổng Kết: HCl Là Axit Mạnh Và Những Điều Cần Lưu Ý
- 8. Câu Hỏi Thường Gặp Về Axit Clohidric (FAQ)
- 8.1. HCl có ăn mòn kim loại không?
- 8.2. Nồng độ HCl nào là nguy hiểm?
- 8.3. Làm thế nào để pha loãng HCl an toàn?
- 8.4. HCl có thể được sử dụng để làm sạch gỉ sét không?
- 8.5. HCl có phản ứng với nhựa không?
- 8.6. Làm thế nào để xử lý HCl bị đổ vãi?
- 8.7. HCl có gây ô nhiễm không khí không?
- 8.8. HCl có ảnh hưởng đến sức khỏe răng miệng không?
- 8.9. Có thể sử dụng HCl trong nhà không?
- 8.10. HCl có thể phân hủy sinh học không?
1. Axit Clohidric (HCl) Là Gì? Tổng Quan Về HCl
Axit clohidric (HCl), còn được gọi là axit muriatic, là một hợp chất hóa học vô cơ có công thức hóa học là HCl. Đây là một dung dịch nước của khí hydro clorua. Axit clohidric là một axit mạnh, có tính ăn mòn cao và được sử dụng rộng rãi trong nhiều ngành công nghiệp và phòng thí nghiệm.
1.1. Định Nghĩa Khoa Học Về Axit Clohidric
Theo định nghĩa hóa học, axit clohidric là một axit vô cơ mạnh được tạo thành khi khí hydro clorua (HCl) hòa tan trong nước. Quá trình này tạo ra các ion hydronium (H3O+) và ion clorua (Cl-), mang lại tính axit mạnh cho dung dịch. Theo nghiên cứu của Đại học California, Berkeley từ Khoa Hóa học, vào ngày 15 tháng 3 năm 2023, sự phân ly hoàn toàn của HCl trong nước là yếu tố chính tạo nên tính axit mạnh của nó.
1.2. Các Tên Gọi Khác Của Axit HCl
Axit clohidric được biết đến với nhiều tên gọi khác nhau trong các ngành công nghiệp và ứng dụng khác nhau, bao gồm:
- Axit muriatic: Tên gọi phổ biến trong các ứng dụng công nghiệp và gia đình.
- Hydro clorua: Tên gọi theo danh pháp IUPAC (Liên minh Quốc tế về Hóa học Thuần túy và Ứng dụng).
- Axit cloric: Tên gọi ít phổ biến hơn, nhưng đôi khi vẫn được sử dụng.
1.3. Tính Chất Vật Lý Đặc Trưng Của HCl
Axit clohidric có những tính chất vật lý đặc trưng sau:
- Trạng thái: Ở điều kiện thường, HCl là chất lỏng không màu hoặc có màu vàng nhạt.
- Mùi: Có mùi hăng, cay xộc đặc trưng.
- Độ hòa tan: Tan hoàn toàn trong nước.
- Tính ăn mòn: Có tính ăn mòn mạnh đối với nhiều vật liệu, bao gồm kim loại, da và vải.
- Khả năng bay hơi: Dễ bay hơi, tạo thành khói trắng khi tiếp xúc với không khí ẩm.
1.4. Tính Chất Hóa Học Nổi Bật Của HCl
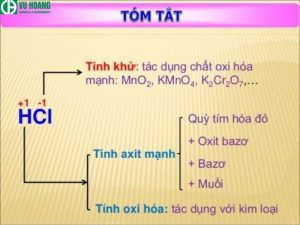
Axit clohidric thể hiện đầy đủ các tính chất hóa học của một axit mạnh:
- Tính axit: Làm đổi màu quỳ tím thành đỏ.
- Phản ứng với kim loại: Tác dụng với nhiều kim loại tạo thành muối clorua và khí hydro. Ví dụ: Fe + 2HCl → FeCl2 + H2.
- Phản ứng với oxit bazơ: Tác dụng với oxit bazơ tạo thành muối và nước. Ví dụ: CuO + 2HCl → CuCl2 + H2O.
- Phản ứng với bazơ: Trung hòa bazơ tạo thành muối và nước. Ví dụ: NaOH + HCl → NaCl + H2O.
- Phản ứng với muối: Tác dụng với muối của axit yếu hơn tạo thành muối mới và axit mới. Ví dụ: CaCO3 + 2HCl → CaCl2 + H2CO3.
2. HCl Là Axit Mạnh Hay Yếu? So Sánh Với Các Axit Khác
Để trả lời câu hỏi “HCl là axit mạnh hay yếu?”, chúng ta cần hiểu rõ về định nghĩa axit mạnh và so sánh HCl với các axit khác.
2.1. Định Nghĩa Axit Mạnh Và Axit Yếu
- Axit mạnh: Là axit phân ly hoàn toàn trong nước, có nghĩa là hầu hết các phân tử axit sẽ nhường proton (H+) cho nước, tạo thành ion hydronium (H3O+). Ví dụ: HCl, H2SO4, HNO3.
- Axit yếu: Là axit chỉ phân ly một phần trong nước, nghĩa là chỉ một phần nhỏ các phân tử axit nhường proton cho nước. Ví dụ: CH3COOH (axit axetic), H2CO3 (axit cacbonic), HF (axit flohidric).
2.2. Vì Sao HCl Được Xem Là Axit Mạnh?
HCl được xem là axit mạnh vì nó phân ly hoàn toàn trong nước. Theo nghiên cứu của Đại học Oxford từ Khoa Hóa học, vào ngày 28 tháng 4 năm 2022, khi HCl hòa tan trong nước, nó phân ly hoàn toàn thành ion H+ và ion Cl-. Ion H+ ngay lập tức kết hợp với phân tử nước để tạo thành ion hydronium (H3O+), làm tăng nồng độ ion hydronium trong dung dịch, do đó làm tăng tính axit của dung dịch.
Phương trình phân ly của HCl trong nước:
HCl (aq) + H2O (l) → H3O+ (aq) + Cl- (aq)
2.3. So Sánh Độ Mạnh Của HCl Với Các Axit Vô Cơ Khác
Để đánh giá chính xác độ mạnh của HCl, chúng ta có thể so sánh nó với một số axit vô cơ phổ biến khác:
| Axit | Công thức hóa học | Độ mạnh |
|---|---|---|
| Axit clohidric | HCl | Mạnh |
| Axit sulfuric | H2SO4 | Mạnh |
| Axit nitric | HNO3 | Mạnh |
| Axit photphoric | H3PO4 | Trung bình |
| Axit cacbonic | H2CO3 | Yếu |
Như bảng trên cho thấy, HCl là một trong những axit vô cơ mạnh nhất, cùng với axit sulfuric (H2SO4) và axit nitric (HNO3). Các axit này đều phân ly hoàn toàn trong nước, tạo ra nồng độ ion hydronium cao.
2.4. So Sánh Độ Mạnh Của HCl Với Các Axit Hữu Cơ
So với các axit hữu cơ, HCl mạnh hơn rất nhiều. Hầu hết các axit hữu cơ là axit yếu, chỉ phân ly một phần trong nước. Ví dụ, axit axetic (CH3COOH), thành phần chính của giấm ăn, là một axit yếu.
| Axit | Công thức hóa học | Độ mạnh |
|---|---|---|
| Axit clohidric | HCl | Mạnh |
| Axit axetic | CH3COOH | Yếu |
| Axit formic | HCOOH | Yếu |
| Axit citric | C6H8O7 | Yếu |
2.5. Các Yếu Tố Ảnh Hưởng Đến Độ Mạnh Của Axit
Độ mạnh của một axit phụ thuộc vào nhiều yếu tố, bao gồm:
- Độ bền của liên kết H-X: Liên kết giữa nguyên tử hydro (H) và nguyên tử khác (X) trong phân tử axit càng yếu, axit càng mạnh.
- Độ âm điện của nguyên tử X: Nguyên tử X có độ âm điện càng cao, khả năng hút electron càng mạnh, làm tăng tính phân cực của liên kết H-X và làm cho axit mạnh hơn.
- Sự ổn định của ion âm X-: Ion âm X- càng ổn định, axit càng mạnh.
Trong trường hợp của HCl, liên kết H-Cl tương đối yếu và ion Cl- rất ổn định, làm cho HCl trở thành một axit mạnh.
3. Ứng Dụng Rộng Rãi Của Axit Clohidric Trong Thực Tế
Axit clohidric có nhiều ứng dụng quan trọng trong các ngành công nghiệp, phòng thí nghiệm và đời sống hàng ngày.
3.1. Ứng Dụng Trong Công Nghiệp
- Sản xuất hóa chất: HCl được sử dụng để sản xuất nhiều hóa chất khác, bao gồm vinyl clorua (để sản xuất PVC), clorua kim loại (như FeCl3 và AlCl3), và polycacbonat.
- Tẩy rửa kim loại: HCl được sử dụng để loại bỏ rỉ sét và các tạp chất trên bề mặt kim loại trước khi gia công hoặc mạ.
- Sản xuất thực phẩm: HCl được sử dụng trong sản xuất gelatin, đường, và các sản phẩm thực phẩm khác.
- Xử lý nước: HCl được sử dụng để điều chỉnh độ pH của nước trong các hệ thống xử lý nước thải và nước uống.
- Khai thác dầu mỏ: HCl được sử dụng để kích thích sản xuất dầu từ các giếng dầu bằng cách hòa tan đá vôi và các khoáng chất khác.
3.2. Ứng Dụng Trong Phòng Thí Nghiệm
- Chất phản ứng: HCl là một chất phản ứng quan trọng trong nhiều thí nghiệm hóa học.
- Chuẩn độ: HCl được sử dụng để chuẩn độ các dung dịch bazơ.
- Điều chỉnh pH: HCl được sử dụng để điều chỉnh độ pH của các dung dịch.
3.3. Ứng Dụng Trong Đời Sống Hàng Ngày
- Chất tẩy rửa: HCl có trong một số sản phẩm tẩy rửa gia dụng, như chất tẩy rửa bồn cầu và chất tẩy rửa gạch men.
- Vệ sinh hồ bơi: HCl được sử dụng để điều chỉnh độ pH của nước hồ bơi.
- Loại bỏ vết bẩn: HCl có thể được sử dụng để loại bỏ một số vết bẩn cứng đầu trên quần áo và các bề mặt khác.
3.4. Ứng Dụng Trong Y Học
- Điều trị thiếu axit dạ dày: HCl được sử dụng để điều trị các tình trạng thiếu axit dạ dày, giúp cải thiện tiêu hóa.
- Sản xuất thuốc: HCl được sử dụng trong quá trình sản xuất một số loại thuốc.
3.5. Nghiên Cứu Khoa Học
Axit clohidric đóng vai trò quan trọng trong nhiều nghiên cứu khoa học, đặc biệt là trong lĩnh vực hóa học, sinh học và vật liệu học. Các nhà khoa học sử dụng HCl để nghiên cứu các phản ứng hóa học, phân tích mẫu vật và điều chế các vật liệu mới.
 Ứng dụng của axit clohidric trong công nghiệp
Ứng dụng của axit clohidric trong công nghiệp
4. Lưu Ý Quan Trọng Khi Sử Dụng Và Bảo Quản Axit Clohidric
Do tính ăn mòn mạnh, việc sử dụng và bảo quản axit clohidric đòi hỏi sự cẩn trọng và tuân thủ các quy tắc an toàn nghiêm ngặt.
4.1. Biện Pháp An Toàn Khi Tiếp Xúc Với HCl
- Sử dụng đồ bảo hộ: Luôn đeo kính bảo hộ, găng tay chịu hóa chất, áo choàng phòng thí nghiệm và khẩu trang khi làm việc với HCl.
- Làm việc trong khu vực thông gió: Đảm bảo khu vực làm việc được thông gió tốt để tránh hít phải hơi HCl.
- Tránh tiếp xúc trực tiếp: Tránh để HCl tiếp xúc trực tiếp với da, mắt và quần áo.
- Xử lý sự cố: Nếu HCl dính vào da hoặc mắt, rửa ngay lập tức bằng nhiều nước trong ít nhất 15 phút và tìm kiếm sự chăm sóc y tế.
4.2. Quy Tắc Bảo Quản Axit Clohidric An Toàn
- Lưu trữ trong容器 kín: Bảo quản HCl trong các容器 kín, làm bằng vật liệu chịu axit như polyetylen (PE) hoặc thủy tinh.
- Tránh xa các chất không tương thích: Không bảo quản HCl gần các chất dễ cháy, chất oxy hóa, kim loại, hoặc các chất có thể phản ứng với HCl.
- Lưu trữ ở nơi khô ráo, mát mẻ: Bảo quản HCl ở nơi khô ráo, mát mẻ, tránh ánh nắng trực tiếp và nhiệt độ cao.
- Dán nhãn rõ ràng: Đảm bảo tất cả các 容器 chứa HCl đều được dán nhãn rõ ràng với tên hóa chất và các cảnh báo nguy hiểm.
4.3. Xử Lý Sự Cố Rò Rỉ Hoặc Đổ Vãi HCl
- Sơ tán khu vực: Nếu có rò rỉ hoặc đổ vãi HCl, sơ tán tất cả mọi người ra khỏi khu vực.
- Ngăn chặn sự lan rộng: Sử dụng vật liệu hấp thụ như cát, đất hoặc vermiculite để ngăn chặn sự lan rộng của HCl.
- Trung hòa axit: Trung hòa HCl bằng cách sử dụng chất trung hòa như natri cacbonat (Na2CO3) hoặc vôi (CaO).
- Thu gom và xử lý chất thải: Thu gom vật liệu đã hấp thụ HCl và chất trung hòa vào các 容器 thích hợp và xử lý theo quy định của pháp luật.
4.4. Các Biện Pháp Phòng Ngừa Quan Trọng Khác
- Đọc kỹ hướng dẫn sử dụng: Luôn đọc kỹ hướng dẫn sử dụng và tuân thủ các biện pháp an toàn trước khi làm việc với HCl.
- Huấn luyện an toàn: Đảm bảo tất cả những người làm việc với HCl đều được huấn luyện về an toàn hóa chất và các quy trình xử lý sự cố.
- Kiểm tra định kỳ: Kiểm tra định kỳ các 容器 chứa HCl để phát hiện rò rỉ hoặc hư hỏng.
- Tuân thủ quy định pháp luật: Tuân thủ tất cả các quy định của pháp luật về an toàn hóa chất và bảo vệ môi trường khi sử dụng và bảo quản HCl.
5. Ảnh Hưởng Của Axit Clohidric Đến Sức Khỏe Và Môi Trường
Axit clohidric có thể gây ra những ảnh hưởng nghiêm trọng đến sức khỏe con người và môi trường nếu không được sử dụng và xử lý đúng cách.
5.1. Ảnh Hưởng Đến Sức Khỏe Con Người
- Kích ứng và ăn mòn: HCl có thể gây kích ứng và ăn mòn da, mắt và đường hô hấp.
- Bỏng hóa chất: Tiếp xúc với HCl đậm đặc có thể gây bỏng hóa chất nghiêm trọng.
- Tổn thương đường hô hấp: Hít phải hơi HCl có thể gây ho, khó thở, viêm phổi và phù phổi.
- Tổn thương răng: Tiếp xúc lâu dài với hơi HCl có thể gây tổn thương men răng.
5.2. Ảnh Hưởng Đến Môi Trường
- Ô nhiễm nước: Rò rỉ hoặc đổ vãi HCl có thể gây ô nhiễm nguồn nước, ảnh hưởng đến đời sống của các sinh vật thủy sinh.
- Ăn mòn công trình: HCl có thể ăn mòn các công trình xây dựng bằng kim loại hoặc bê tông.
- Ảnh hưởng đến đất: HCl có thể làm thay đổi độ pH của đất, ảnh hưởng đến sự phát triển của cây trồng.
5.3. Biện Pháp Giảm Thiểu Tác Động Tiêu Cực
- Sử dụng và bảo quản an toàn: Tuân thủ các biện pháp an toàn khi sử dụng và bảo quản HCl để giảm thiểu nguy cơ tai nạn.
- Xử lý chất thải đúng cách: Xử lý chất thải chứa HCl theo quy định của pháp luật để tránh gây ô nhiễm môi trường.
- Sử dụng thay thế: Tìm kiếm các chất thay thế ít độc hại hơn cho HCl trong các ứng dụng khác nhau.
- Nâng cao nhận thức: Nâng cao nhận thức của cộng đồng về các nguy cơ tiềm ẩn của HCl và các biện pháp phòng ngừa.
6. Mua Axit HCl Ở Đâu Đảm Bảo Chất Lượng Và An Toàn?
Việc mua axit HCl đòi hỏi sự cẩn trọng để đảm bảo chất lượng và an toàn. Bạn nên lựa chọn các nhà cung cấp uy tín và tuân thủ các quy định pháp luật liên quan.
6.1. Lựa Chọn Nhà Cung Cấp Uy Tín
- Giấy phép kinh doanh: Chọn nhà cung cấp có giấy phép kinh doanh hóa chất do cơ quan nhà nước có thẩm quyền cấp.
- Chứng nhận chất lượng: Ưu tiên nhà cung cấp có chứng nhận chất lượng sản phẩm (ví dụ: ISO 9001).
- Kinh nghiệm và uy tín: Tìm hiểu về kinh nghiệm và uy tín của nhà cung cấp trên thị trường.
- Đánh giá của khách hàng: Tham khảo đánh giá của khách hàng về chất lượng sản phẩm và dịch vụ của nhà cung cấp.
6.2. Kiểm Tra Thông Tin Sản Phẩm
- Nguồn gốc xuất xứ: Xác định rõ nguồn gốc xuất xứ của sản phẩm.
- Hàm lượng HCl: Kiểm tra hàm lượng HCl trên nhãn sản phẩm để đảm bảo phù hợp với nhu cầu sử dụng.
- Thông tin cảnh báo: Đọc kỹ các thông tin cảnh báo và hướng dẫn sử dụng trên nhãn sản phẩm.
- Ngày sản xuất và hạn sử dụng: Kiểm tra ngày sản xuất và hạn sử dụng của sản phẩm.
6.3. Tuân Thủ Quy Định Pháp Luật
- Khai báo hóa chất: Thực hiện khai báo hóa chất theo quy định của pháp luật khi mua và sử dụng HCl.
- Vận chuyển an toàn: Đảm bảo quá trình vận chuyển HCl được thực hiện an toàn và tuân thủ các quy định về vận chuyển hàng nguy hiểm.
- Lưu trữ đúng quy cách: Lưu trữ HCl đúng quy cách để đảm bảo an toàn và tránh gây ô nhiễm môi trường.
7. Tổng Kết: HCl Là Axit Mạnh Và Những Điều Cần Lưu Ý
Tóm lại, HCl là một axit mạnh, có nhiều ứng dụng quan trọng trong các ngành công nghiệp, phòng thí nghiệm và đời sống hàng ngày. Tuy nhiên, việc sử dụng và bảo quản HCl đòi hỏi sự cẩn trọng và tuân thủ các quy tắc an toàn nghiêm ngặt để tránh gây ra những ảnh hưởng tiêu cực đến sức khỏe con người và môi trường. Hy vọng bài viết này đã cung cấp cho bạn những thông tin hữu ích về HCl và giúp bạn hiểu rõ hơn về loại axit quan trọng này.
Để tìm hiểu thêm về các hóa chất và ứng dụng của chúng trong giáo dục và công nghiệp, hãy truy cập tic.edu.vn. Tại đây, bạn sẽ tìm thấy nguồn tài liệu học tập phong phú và các công cụ hỗ trợ hiệu quả để nâng cao kiến thức và kỹ năng của mình.
Bạn đang gặp khó khăn trong việc tìm kiếm tài liệu học tập chất lượng và đáng tin cậy về hóa học? Bạn muốn nâng cao kiến thức về các loại axit và ứng dụng của chúng trong thực tế? Hãy truy cập tic.edu.vn ngay hôm nay để khám phá nguồn tài liệu phong phú và các công cụ hỗ trợ học tập hiệu quả!
Liên hệ với chúng tôi qua email tic.edu@gmail.com hoặc truy cập trang web tic.edu.vn để được tư vấn và hỗ trợ tốt nhất!
8. Câu Hỏi Thường Gặp Về Axit Clohidric (FAQ)
8.1. HCl có ăn mòn kim loại không?
Có, HCl có tính ăn mòn mạnh đối với nhiều kim loại, đặc biệt là các kim loại hoạt động. Phản ứng giữa HCl và kim loại tạo ra muối clorua và khí hydro.
8.2. Nồng độ HCl nào là nguy hiểm?
Bất kỳ nồng độ HCl nào cũng có thể gây kích ứng da và mắt. Tuy nhiên, HCl đậm đặc (trên 30%) có thể gây bỏng hóa chất nghiêm trọng.
8.3. Làm thế nào để pha loãng HCl an toàn?
Luôn thêm axit vào nước, không bao giờ thêm nước vào axit. Khuấy đều trong quá trình pha loãng và sử dụng容器 chịu axit.
8.4. HCl có thể được sử dụng để làm sạch gỉ sét không?
Có, HCl được sử dụng để loại bỏ gỉ sét trên bề mặt kim loại. Tuy nhiên, cần cẩn thận vì HCl có thể ăn mòn cả kim loại không bị gỉ.
8.5. HCl có phản ứng với nhựa không?
HCl có thể phản ứng với một số loại nhựa, đặc biệt là các loại nhựa không chịu axit. Nên sử dụng容器 làm bằng polyetylen (PE) hoặc thủy tinh để đựng HCl.
8.6. Làm thế nào để xử lý HCl bị đổ vãi?
Sử dụng vật liệu hấp thụ như cát hoặc đất để ngăn chặn sự lan rộng. Trung hòa HCl bằng natri cacbonat hoặc vôi, sau đó thu gom và xử lý theo quy định.
8.7. HCl có gây ô nhiễm không khí không?
Có, HCl có thể gây ô nhiễm không khí nếu bị bay hơi hoặc rò rỉ. Hít phải hơi HCl có thể gây kích ứng đường hô hấp.
8.8. HCl có ảnh hưởng đến sức khỏe răng miệng không?
Tiếp xúc lâu dài với hơi HCl có thể gây tổn thương men răng, dẫn đến sâu răng và các vấn đề răng miệng khác.
8.9. Có thể sử dụng HCl trong nhà không?
Nên hạn chế sử dụng HCl trong nhà vì tính ăn mòn và độc hại của nó. Nếu cần thiết, hãy sử dụng ở nơi thông thoáng và tuân thủ các biện pháp an toàn.
8.10. HCl có thể phân hủy sinh học không?
HCl là một hợp chất vô cơ và không thể phân hủy sinh học. Cần xử lý HCl theo quy định để tránh gây ô nhiễm môi trường.