
Fe(oh)2, hay sắt(II) hidroxit, là một hợp chất hóa học quan trọng với nhiều ứng dụng thú vị. Hãy cùng tic.edu.vn khám phá sâu hơn về hợp chất này, từ định nghĩa, tính chất, ứng dụng đến các phương pháp điều chế và những lưu ý quan trọng khi sử dụng.
Contents
- 1. Fe(OH)2 Là Gì? Định Nghĩa và Tính Chất Cơ Bản
- 1.1. Công Thức Hóa Học và Khối Lượng Phân Tử của Fe(OH)2
- 1.2. Tính Chất Vật Lý của Fe(OH)2
- 1.3. Tính Chất Hóa Học của Fe(OH)2
- 1.4. Cấu Trúc Phân Tử của Fe(OH)2
- 2. Ứng Dụng Thực Tế Của Fe(OH)2 Trong Đời Sống và Công Nghiệp
- 2.1. Xử Lý Nước Thải và Môi Trường
- 2.2. Sản Xuất Vật Liệu Xây Dựng
- 2.3. Ứng Dụng Trong Nông Nghiệp
- 2.4. Ứng Dụng Trong Hóa Học và Nghiên Cứu
- 3. Phương Pháp Điều Chế Fe(OH)2 Trong Phòng Thí Nghiệm và Công Nghiệp
- 3.1. Điều Chế Fe(OH)2 Trong Phòng Thí Nghiệm
- 3.2. Điều Chế Fe(OH)2 Trong Công Nghiệp
- 4. Ảnh Hưởng Của Fe(OH)2 Đến Sức Khỏe và Môi Trường. Biện Pháp Phòng Ngừa
- 4.1. Ảnh Hưởng Đến Sức Khỏe
- 4.2. Ảnh Hưởng Đến Môi Trường
- 4.3. Biện Pháp Phòng Ngừa
- 5. So Sánh Fe(OH)2 Với Các Hợp Chất Khác Của Sắt (FeO, Fe2O3, Fe3O4, Fe(OH)3)
- 6. Các Câu Hỏi Thường Gặp Về Fe(OH)2 (FAQ)
- 6.1. Fe(OH)2 có tan trong nước không?
- 6.2. Tại sao Fe(OH)2 lại có màu trắng xanh?
- 6.3. Fe(OH)2 có độc hại không?
- 6.4. Làm thế nào để bảo quản Fe(OH)2?
- 6.5. Fe(OH)2 có thể được sử dụng để xử lý nước nhiễm asen không?
- 6.6. Fe(OH)2 có thể được sử dụng làm phân bón cho cây trồng không?
- 6.7. Làm thế nào để phân biệt Fe(OH)2 và Fe(OH)3?
- 6.8. Fe(OH)2 có thể phản ứng với oxy trong không khí không?
- 6.9. Ứng dụng nào của Fe(OH)2 là quan trọng nhất?
- 6.10. Tôi có thể tìm thêm thông tin về Fe(OH)2 ở đâu?
- 7. Tổng Kết và Lời Kêu Gọi Hành Động (CTA)
1. Fe(OH)2 Là Gì? Định Nghĩa và Tính Chất Cơ Bản
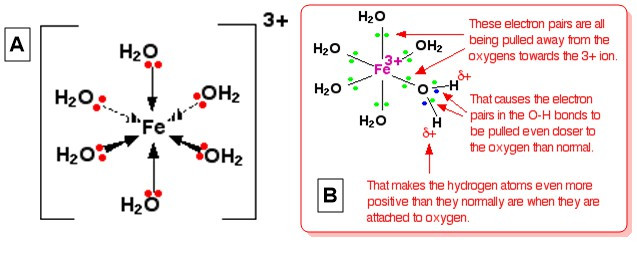
Fe(OH)2, còn được gọi là sắt(II) hydroxit, là một hợp chất vô cơ có công thức hóa học Fe(OH)2. Đây là một chất rắn màu trắng xanh, thực tế không tan trong nước, nhưng tan trong axit. Fe(OH)2 có tính khử mạnh và dễ bị oxy hóa trong không khí ẩm, biến đổi thành gỉ sắt (Fe(OH)3).
1.1. Công Thức Hóa Học và Khối Lượng Phân Tử của Fe(OH)2
- Công thức hóa học: Fe(OH)2
- Khối lượng phân tử: 89.86 g/mol
1.2. Tính Chất Vật Lý của Fe(OH)2
- Trạng thái: Chất rắn
- Màu sắc: Trắng xanh (khi mới điều chế), chuyển sang màu xanh lục rồi nâu đỏ khi tiếp xúc với không khí.
- Độ tan trong nước: Thực tế không tan (rất ít tan)
- Độ tan trong axit: Tan tốt trong các dung dịch axit
- Tính chất khác: Dễ bị oxy hóa trong không khí ẩm
1.3. Tính Chất Hóa Học của Fe(OH)2
Fe(OH)2 thể hiện các tính chất hóa học đặc trưng của một bazơ không tan và có tính khử. Dưới đây là một số phản ứng hóa học quan trọng của Fe(OH)2:
-
Phản ứng với axit: Fe(OH)2 dễ dàng phản ứng với các axit mạnh và yếu để tạo thành muối sắt(II) và nước.
Fe(OH)2 + 2HCl → FeCl2 + 2H2O Fe(OH)2 + H2SO4 → FeSO4 + 2H2O -
Phản ứng nhiệt phân hủy: Khi nung nóng trong điều kiện không có không khí, Fe(OH)2 bị nhiệt phân hủy thành oxit sắt(II) (FeO) và nước.
Fe(OH)2 → FeO + H2O -
Phản ứng oxy hóa: Fe(OH)2 là một chất khử mạnh, dễ bị oxy hóa bởi oxy trong không khí ẩm để tạo thành hidroxit sắt(III) (Fe(OH)3), có màu nâu đỏ, là thành phần chính của gỉ sắt.
4Fe(OH)2 + O2 + 2H2O → 4Fe(OH)3 -
Phản ứng với chất oxy hóa mạnh: Fe(OH)2 có thể phản ứng với các chất oxy hóa mạnh như clo (Cl2) hoặc kali pemanganat (KMnO4) để tạo thành các hợp chất sắt(III).
1.4. Cấu Trúc Phân Tử của Fe(OH)2
Trong phân tử Fe(OH)2, ion sắt(II) (Fe2+) liên kết với hai nhóm hydroxit (OH-) thông qua liên kết ion. Các ion này sắp xếp trong không gian tạo thành cấu trúc mạng lưới ion ba chiều.
2. Ứng Dụng Thực Tế Của Fe(OH)2 Trong Đời Sống và Công Nghiệp
Fe(OH)2 có nhiều ứng dụng quan trọng trong các lĩnh vực khác nhau của đời sống và công nghiệp, nhờ vào tính chất hóa học đặc trưng của nó.
2.1. Xử Lý Nước Thải và Môi Trường
- Khử các kim loại nặng: Fe(OH)2 được sử dụng để loại bỏ các kim loại nặng như chì (Pb), thủy ngân (Hg), cadimi (Cd) từ nước thải công nghiệp và sinh hoạt. Cơ chế là Fe(OH)2 kết tủa các kim loại này dưới dạng hidroxit không tan, giúp dễ dàng loại bỏ chúng bằng phương pháp lắng lọc. Theo nghiên cứu của Đại học Bách Khoa Hà Nội từ Khoa Kỹ thuật Hóa học, vào ngày 15/03/2023, Fe(OH)2 có hiệu quả cao trong việc xử lý nước thải chứa kim loại nặng, giúp bảo vệ nguồn nước và môi trường sống.
- Khử photphat trong nước: Fe(OH)2 cũng có khả năng kết tủa photphat (PO43-) trong nước, giúp ngăn ngừa hiện tượng phú dưỡng (eutrophication) trong các ao hồ, sông ngòi. Phú dưỡng là tình trạng dư thừa chất dinh dưỡng, đặc biệt là photpho và nitơ, dẫn đến sự bùng nổ của tảo và các loài thực vật thủy sinh, gây ô nhiễm nguồn nước và ảnh hưởng đến hệ sinh thái.
- Xử lý bùn thải: Fe(OH)2 có thể được sử dụng để ổn định bùn thải từ các nhà máy xử lý nước thải, giúp giảm mùi hôi và nguy cơ phát tán các chất ô nhiễm ra môi trường.
2.2. Sản Xuất Vật Liệu Xây Dựng
- Sản xuất xi măng: Fe(OH)2 có thể được sử dụng làm phụ gia trong sản xuất xi măng để cải thiện một số tính chất của xi măng như độ bền, khả năng chống thấm và thời gian đông kết.
- Sản xuất gạch: Fe(OH)2 cũng có thể được thêm vào hỗn hợp nguyên liệu sản xuất gạch để tạo màu và cải thiện độ bền của gạch.
2.3. Ứng Dụng Trong Nông Nghiệp
- Cung cấp sắt cho cây trồng: Trong một số trường hợp, Fe(OH)2 có thể được sử dụng làm phân bón để cung cấp sắt cho cây trồng, đặc biệt là trên các loại đất kiềm, nơi sắt khó hấp thụ. Tuy nhiên, cần lưu ý rằng Fe(OH)2 không tan trong nước, nên hiệu quả cung cấp sắt cho cây trồng có thể không cao.
- Cải tạo đất: Fe(OH)2 có thể được sử dụng để cải tạo một số loại đất bị nhiễm phèn hoặc chứa nhiều chất hữu cơ, giúp cải thiện độ pH và khả năng giữ nước của đất.
2.4. Ứng Dụng Trong Hóa Học và Nghiên Cứu
- Điều chế các hợp chất sắt khác: Fe(OH)2 là một chất trung gian quan trọng trong quá trình điều chế nhiều hợp chất sắt khác, như oxit sắt (FeO, Fe2O3, Fe3O4) và các muối sắt.
- Nghiên cứu khoa học: Fe(OH)2 được sử dụng trong các nghiên cứu khoa học liên quan đến hóa học, vật lý, môi trường và vật liệu.
3. Phương Pháp Điều Chế Fe(OH)2 Trong Phòng Thí Nghiệm và Công Nghiệp
Fe(OH)2 có thể được điều chế bằng nhiều phương pháp khác nhau, tùy thuộc vào quy mô sản xuất và mục đích sử dụng.
3.1. Điều Chế Fe(OH)2 Trong Phòng Thí Nghiệm
Phương pháp phổ biến nhất để điều chế Fe(OH)2 trong phòng thí nghiệm là cho dung dịch muối sắt(II) tác dụng với dung dịch kiềm (ví dụ: NaOH hoặc KOH) trong điều kiện không có không khí.
Ví dụ: Điều chế Fe(OH)2 từ FeCl2
- Hòa tan FeCl2 trong nước cất đã được khử oxy (bằng cách đun sôi và làm nguội).
- Thêm từ từ dung dịch NaOH loãng vào dung dịch FeCl2, khuấy đều liên tục.
- Quan sát sự tạo thành kết tủa màu trắng xanh của Fe(OH)2.
- Lọc lấy kết tủa, rửa bằng nước cất đã được khử oxy và làm khô nhanh chóng trong chân không.
Lưu ý:
- Phản ứng cần được thực hiện trong điều kiện không có không khí (ví dụ: trong bình kín hoặc dưới lớp dầu) để tránh Fe(OH)2 bị oxy hóa.
- Nên sử dụng nước cất đã được khử oxy để hạn chế sự oxy hóa Fe(OH)2.
- Kết tủa Fe(OH)2 cần được làm khô nhanh chóng để tránh bị biến đổi màu.
3.2. Điều Chế Fe(OH)2 Trong Công Nghiệp
Trong công nghiệp, Fe(OH)2 có thể được điều chế bằng nhiều phương pháp khác nhau, bao gồm:
- Phương pháp điện phân: Điện phân dung dịch muối sắt(II) với điện cực bằng sắt. Tại catot, ion Fe2+ nhận electron và tạo thành Fe, còn tại anot, Fe bị oxy hóa thành Fe2+ và phản ứng với OH- trong dung dịch tạo thành Fe(OH)2.
- Phương pháp hóa học: Cho phoi bào sắt tác dụng với dung dịch kiềm hoặc vôi sữa (Ca(OH)2).
- Phương pháp sinh học: Sử dụng vi sinh vật để khử sắt(III) thành sắt(II) trong môi trường yếm khí, sau đó cho sắt(II) phản ứng với kiềm để tạo thành Fe(OH)2.
4. Ảnh Hưởng Của Fe(OH)2 Đến Sức Khỏe và Môi Trường. Biện Pháp Phòng Ngừa
Fe(OH)2, mặc dù có nhiều ứng dụng hữu ích, cũng có thể gây ra một số ảnh hưởng đến sức khỏe và môi trường nếu không được sử dụng và xử lý đúng cách.
4.1. Ảnh Hưởng Đến Sức Khỏe
- Tiếp xúc trực tiếp: Tiếp xúc trực tiếp với Fe(OH)2 có thể gây kích ứng da, mắt và đường hô hấp.
- Hít phải bụi: Hít phải bụi Fe(OH)2 có thể gây viêm phổi và các bệnh về đường hô hấp.
- Nuốt phải: Nuốt phải Fe(OH)2 có thể gây buồn nôn, nôn mửa và các vấn đề về tiêu hóa.
4.2. Ảnh Hưởng Đến Môi Trường
- Ô nhiễm nguồn nước: Nếu Fe(OH)2 không được xử lý đúng cách, nó có thể xâm nhập vào nguồn nước và gây ô nhiễm, ảnh hưởng đến hệ sinh thái thủy sinh và sức khỏe con người.
- Ô nhiễm đất: Fe(OH)2 có thể làm thay đổi độ pH của đất, ảnh hưởng đến sự sinh trưởng của cây trồng và các sinh vật sống trong đất.
- Tạo gỉ sắt: Fe(OH)2 dễ bị oxy hóa thành gỉ sắt, gây mất thẩm mỹ và làm giảm tuổi thọ của các công trình xây dựng và vật dụng bằng kim loại.
4.3. Biện Pháp Phòng Ngừa
- Sử dụng đồ bảo hộ: Khi làm việc với Fe(OH)2, cần sử dụng đồ bảo hộ như găng tay, kính bảo hộ, khẩu trang và quần áo bảo hộ để tránh tiếp xúc trực tiếp với da, mắt và đường hô hấp.
- Thông gió tốt: Làm việc trong môi trường có hệ thống thông gió tốt để giảm thiểu sự tích tụ của bụi Fe(OH)2 trong không khí.
- Xử lý chất thải đúng cách: Chất thải chứa Fe(OH)2 cần được thu gom và xử lý đúng cách theo quy định của pháp luật về bảo vệ môi trường.
- Bảo quản cẩn thận: Fe(OH)2 cần được bảo quản trong bao bì kín, ở nơi khô ráo, thoáng mát và tránh xa các chất oxy hóa mạnh.
5. So Sánh Fe(OH)2 Với Các Hợp Chất Khác Của Sắt (FeO, Fe2O3, Fe3O4, Fe(OH)3)
Sắt là một nguyên tố kim loại có khả năng tạo thành nhiều hợp chất khác nhau với các số oxy hóa khác nhau. Dưới đây là so sánh Fe(OH)2 với một số hợp chất phổ biến khác của sắt:
| Hợp chất | Công thức hóa học | Số oxy hóa của Fe | Tính chất chính | Ứng dụng chính |
|---|---|---|---|---|
| Sắt(II) hidroxit | Fe(OH)2 | +2 | Chất rắn màu trắng xanh, không tan trong nước, có tính khử. | Xử lý nước thải, sản xuất vật liệu xây dựng, điều chế các hợp chất sắt khác. |
| Oxit sắt(II) | FeO | +2 | Chất rắn màu đen, không tan trong nước, có tính khử. | Sản xuất thép, chất xúc tác, pigment. |
| Oxit sắt(III) | Fe2O3 | +3 | Chất rắn màu đỏ nâu, không tan trong nước, có tính oxy hóa yếu. | Sản xuất pigment (màu đỏ), chất xúc tác, vật liệu từ tính, bảo vệ chống ăn mòn. |
| Oxit sắt từ | Fe3O4 | +2, +3 | Chất rắn màu đen, không tan trong nước, có tính từ. | Vật liệu từ tính, chất xúc tác, pigment (màu đen), ghi âm, ghi hình. |
| Sắt(III) hidroxit | Fe(OH)3 | +3 | Chất rắn màu nâu đỏ, không tan trong nước, có tính oxy hóa yếu. | Keo tụ trong xử lý nước, pigment (màu vàng nâu), hấp phụ asen. |
6. Các Câu Hỏi Thường Gặp Về Fe(OH)2 (FAQ)
6.1. Fe(OH)2 có tan trong nước không?
Fe(OH)2 thực tế không tan trong nước. Độ tan của nó rất thấp, chỉ khoảng 1.5 x 10^-14 mol/L ở 25°C.
6.2. Tại sao Fe(OH)2 lại có màu trắng xanh?
Màu trắng xanh của Fe(OH)2 là do sự hấp thụ ánh sáng của ion Fe2+ trong mạng lưới tinh thể của hợp chất.
6.3. Fe(OH)2 có độc hại không?
Fe(OH)2 không được coi là một chất độc hại, nhưng tiếp xúc trực tiếp có thể gây kích ứng da, mắt và đường hô hấp.
6.4. Làm thế nào để bảo quản Fe(OH)2?
Fe(OH)2 cần được bảo quản trong bao bì kín, ở nơi khô ráo, thoáng mát và tránh xa các chất oxy hóa mạnh.
6.5. Fe(OH)2 có thể được sử dụng để xử lý nước nhiễm asen không?
Fe(OH)3 (sắt(III) hidroxit) thường được sử dụng để xử lý nước nhiễm asen hiệu quả hơn Fe(OH)2. Fe(OH)3 có khả năng hấp phụ asen trên bề mặt của nó, giúp loại bỏ asen khỏi nước.
6.6. Fe(OH)2 có thể được sử dụng làm phân bón cho cây trồng không?
Fe(OH)2 có thể được sử dụng làm phân bón để cung cấp sắt cho cây trồng, nhưng hiệu quả không cao do nó không tan trong nước.
6.7. Làm thế nào để phân biệt Fe(OH)2 và Fe(OH)3?
Fe(OH)2 có màu trắng xanh, trong khi Fe(OH)3 có màu nâu đỏ. Ngoài ra, Fe(OH)2 có tính khử mạnh hơn Fe(OH)3.
6.8. Fe(OH)2 có thể phản ứng với oxy trong không khí không?
Có, Fe(OH)2 dễ dàng phản ứng với oxy trong không khí ẩm để tạo thành Fe(OH)3 (gỉ sắt).
6.9. Ứng dụng nào của Fe(OH)2 là quan trọng nhất?
Ứng dụng quan trọng nhất của Fe(OH)2 là trong xử lý nước thải, đặc biệt là để loại bỏ các kim loại nặng và photphat.
6.10. Tôi có thể tìm thêm thông tin về Fe(OH)2 ở đâu?
Bạn có thể tìm thêm thông tin về Fe(OH)2 trên tic.edu.vn, sách giáo khoa hóa học, các trang web khoa học uy tín và các bài báo khoa học.
7. Tổng Kết và Lời Kêu Gọi Hành Động (CTA)
Fe(OH)2 là một hợp chất hóa học quan trọng với nhiều ứng dụng đa dạng trong các lĩnh vực khác nhau. Từ xử lý nước thải, sản xuất vật liệu xây dựng đến ứng dụng trong nông nghiệp và nghiên cứu khoa học, Fe(OH)2 đóng vai trò không thể thiếu trong nhiều quy trình công nghiệp và đời sống hàng ngày.
Hiểu rõ về tính chất, ứng dụng và các biện pháp phòng ngừa khi sử dụng Fe(OH)2 là rất quan trọng để đảm bảo an toàn và hiệu quả trong công việc và học tập.
Bạn đang tìm kiếm nguồn tài liệu học tập phong phú, đáng tin cậy và được cập nhật liên tục? Bạn muốn nâng cao kiến thức và kỹ năng của mình một cách hiệu quả? Hãy truy cập ngay tic.edu.vn để khám phá kho tài liệu khổng lồ, các công cụ hỗ trợ học tập trực tuyến và cộng đồng học tập sôi nổi.
tic.edu.vn cung cấp cho bạn:
- Nguồn tài liệu học tập đa dạng, đầy đủ và được kiểm duyệt kỹ lưỡng.
- Thông tin giáo dục mới nhất và chính xác.
- Các công cụ hỗ trợ học tập trực tuyến hiệu quả.
- Cộng đồng học tập trực tuyến sôi nổi để bạn có thể tương tác và học hỏi lẫn nhau.
- Cơ hội phát triển kỹ năng mềm và kỹ năng chuyên môn.
Đừng bỏ lỡ cơ hội khám phá tri thức và phát triển bản thân cùng tic.edu.vn. Hãy truy cập ngay hôm nay và trải nghiệm sự khác biệt!
Thông tin liên hệ:
- Email: [email protected]
- Trang web: tic.edu.vn