Feo + Hno3 Loãng tạo ra sản phẩm gì? tic.edu.vn sẽ giúp bạn hiểu rõ phản ứng, điều kiện, ứng dụng và bài tập liên quan đến FeO tác dụng với HNO3 loãng, mở ra cánh cửa kiến thức hóa học thú vị và bổ ích. Khám phá ngay những kiến thức hữu ích về phản ứng oxi hóa khử, điều chế hợp chất sắt và ứng dụng thực tế của chúng.
Contents
- 1. Phản Ứng FeO + HNO3 Loãng Tạo Ra Gì?
- 1.1. Phương Trình Hóa Học Đã Cân Bằng
- 1.2. Giải Thích Chi Tiết Quá Trình Cân Bằng Phản Ứng
- 2. Điều Kiện và Cách Tiến Hành Phản Ứng
- 2.1. Điều Kiện Phản Ứng
- 2.2. Cách Tiến Hành Phản Ứng
- 3. Hiện Tượng Phản Ứng
- 4. Bản Chất Của Các Chất Tham Gia Phản Ứng
- 4.1. Bản Chất Của FeO
- 4.2. Bản Chất Của HNO3
- 5. Tính Chất Hóa Học Của FeO
- 5.1. Tính Chất Vật Lý
- 5.2. Tính Chất Hóa Học Đặc Trưng
- 5.3. Ứng Dụng Của FeO
- 6. Tính Chất Hóa Học Của HNO3
- 6.1. Tính Chất Vật Lý
- 6.2. Tính Chất Hóa Học Đặc Trưng
- 6.3. Ứng Dụng Của HNO3
- 7. Bài Tập Vận Dụng Liên Quan Đến Phản Ứng FeO + HNO3 Loãng
- 7.1. Bài Tập Trắc Nghiệm
- 7.2. Bài Tập Tự Luận
- 8. Tại Sao Nên Học Hóa Học Với tic.edu.vn?
- 8.1. Nguồn Tài Liệu Phong Phú, Đa Dạng
- 8.2. Công Cụ Hỗ Trợ Học Tập Hiệu Quả
- 8.3. Cộng Đồng Học Tập Sôi Động
- 8.4. Phát Triển Kỹ Năng Toàn Diện
- 9. Các Câu Hỏi Thường Gặp (FAQ)
- 10. Lời Kêu Gọi Hành Động (CTA)
1. Phản Ứng FeO + HNO3 Loãng Tạo Ra Gì?
Phản ứng giữa FeO (Sắt(II) oxit) và HNO3 loãng (Axit nitric loãng) tạo ra Fe(NO3)3 (Sắt(III) nitrat), NO (Nitơ oxit) và H2O (Nước). Phản ứng này thể hiện tính oxi hóa khử, trong đó FeO đóng vai trò chất khử và HNO3 đóng vai trò chất oxi hóa.
1.1. Phương Trình Hóa Học Đã Cân Bằng
Phương trình hóa học cân bằng cho phản ứng FeO + HNO3 loãng là:
3FeO + 10HNO3 → 3Fe(NO3)3 + NO + 5H2O
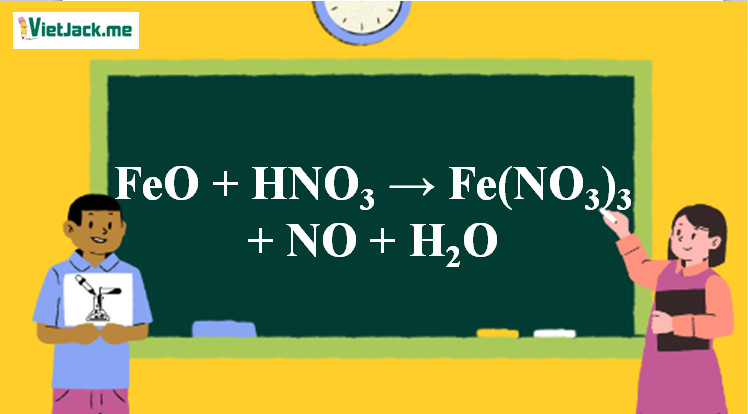 Phản ứng FeO tác dụng với HNO3 tạo ra Fe(NO3)3, NO và H2O
Phản ứng FeO tác dụng với HNO3 tạo ra Fe(NO3)3, NO và H2O
Ảnh minh họa phản ứng FeO tác dụng với HNO3 loãng
1.2. Giải Thích Chi Tiết Quá Trình Cân Bằng Phản Ứng
Để cân bằng phương trình phản ứng oxi hóa khử này, ta sử dụng phương pháp thăng bằng electron:
-
Bước 1: Xác định số oxi hóa của các nguyên tố trước và sau phản ứng.
Fe+2O + HN+5O3 → Fe+3(NO3)3 + N+2O + H2O
-
Bước 2: Viết quá trình oxi hóa và quá trình khử.
3x Fe2+ → Fe3+ + 1e 1x N+5 + 3e → N+2 -
Bước 3: Cân bằng số electron trao đổi bằng cách nhân hệ số thích hợp.
-
Bước 4: Đặt các hệ số vào phương trình phản ứng và hoàn thành việc cân bằng.
3FeO + 10HNO3 → 3Fe(NO3)3 + NO + 5H2O
2. Điều Kiện và Cách Tiến Hành Phản Ứng
Để phản ứng giữa FeO và HNO3 loãng xảy ra hiệu quả, cần đảm bảo các điều kiện và thực hiện theo đúng quy trình.
2.1. Điều Kiện Phản Ứng
Phản ứng xảy ra ở điều kiện thường, không yêu cầu nhiệt độ cao.
2.2. Cách Tiến Hành Phản Ứng
Cho từ từ FeO vào dung dịch HNO3 loãng, khuấy đều để phản ứng xảy ra hoàn toàn.
3. Hiện Tượng Phản Ứng
Khi cho FeO tác dụng với HNO3 loãng, ta sẽ quan sát được các hiện tượng sau:
-
Chất rắn FeO màu đen tan dần trong dung dịch.
-
Xuất hiện khí NO không màu, hóa nâu ngoài không khí do phản ứng với O2.
2NO(không màu) + O2 → 2NO2 (màu nâu đỏ)
4. Bản Chất Của Các Chất Tham Gia Phản Ứng
Để hiểu rõ hơn về phản ứng, chúng ta cần nắm vững bản chất của FeO và HNO3.
4.1. Bản Chất Của FeO
- Tính khử: FeO là chất khử do Fe có số oxi hóa +2, có thể nhường electron để tăng lên +3.
- Tác dụng với axit: FeO là oxit bazơ, tác dụng với axit tạo thành muối và nước.
4.2. Bản Chất Của HNO3
- Tính oxi hóa mạnh: HNO3 là chất oxi hóa mạnh, đặc biệt khi ở trạng thái đậm đặc. Tuy nhiên, với HNO3 loãng, khả năng oxi hóa vẫn được thể hiện nhưng yếu hơn.
- Tính axit: HNO3 là một axit mạnh, có khả năng tác dụng với oxit bazơ, bazơ và nhiều kim loại.
5. Tính Chất Hóa Học Của FeO
FeO là một oxit bazơ, có tính khử đặc trưng.
Ảnh minh họa về cấu trúc và tính chất của FeO
5.1. Tính Chất Vật Lý
- FeO là chất rắn màu đen.
- Không tan trong nước.
5.2. Tính Chất Hóa Học Đặc Trưng
-
Tính bazơ: Tác dụng với axit tạo thành muối và nước.
FeO + 2HCl → FeCl2 + H2O
FeO + H2SO4 (loãng) → FeSO4 + H2O
-
Tính khử: Dễ bị oxi hóa thành Fe2O3.
4FeO + O2 → 2Fe2O3
-
Tác dụng với chất khử mạnh:
FeO + H2 → Fe + H2O (điều kiện nhiệt độ)
FeO + CO → Fe + CO2 (điều kiện nhiệt độ)
3FeO + 2Al → Al2O3 + 3Fe (điều kiện nhiệt độ)
-
Tác dụng với chất oxi hóa mạnh:
3FeO + 10HNO3 (loãng) → 3Fe(NO3)3 + NO + 5H2O
FeO + 4HNO3 (đặc, nóng) → Fe(NO3)3 + NO2 + 2H2O
2FeO + 4H2SO4 (đặc, nóng) → Fe2(SO4)3 + SO2 + 4H2O
5.3. Ứng Dụng Của FeO
- Sản xuất gang thép: FeO là nguyên liệu quan trọng trong quá trình luyện gang thép.
- Chất xúc tác: Sử dụng trong một số phản ứng hóa học.
- Vật liệu gốm: Tạo màu cho men gốm.
6. Tính Chất Hóa Học Của HNO3
HNO3 là một axit mạnh với tính oxi hóa cao.
6.1. Tính Chất Vật Lý
- Trạng thái: Chất lỏng không màu.
- Tính chất khác: Bốc khói mạnh trong không khí ẩm, tan vô hạn trong nước.
6.2. Tính Chất Hóa Học Đặc Trưng
-
Tính axit mạnh:
-
Làm quỳ tím hóa đỏ.
-
Tác dụng với oxit bazơ, bazơ, muối cacbonat tạo thành muối nitrat.
2HNO3 + CuO → Cu(NO3)2 + H2O
2HNO3 + Mg(OH)2 → Mg(NO3)2 + 2H2O
2HNO3 + CaCO3 → Ca(NO3)2 + H2O + CO2
-
-
Tính oxi hóa mạnh:
-
Tác dụng với hầu hết kim loại (trừ Au, Pt) tạo thành muối nitrat, H2O và sản phẩm khử (NO2, NO, N2O, NH4NO3).
Kim loại + HNO3 (đặc) → Muối nitrat + NO2 + H2O
Kim loại + HNO3 (loãng) → Muối nitrat + NO + H2O
-
Tác dụng với phi kim:
C + 4HNO3 (đặc) → 4NO2 + 2H2O + CO2
3C + 4HNO3 (loãng) → 3CO2 + 4NO + 2H2O
-
Tác dụng với hợp chất:
FeO + 4HNO3 → Fe(NO3)3 + NO2 + 2H2O
FeCO3 + 4HNO3 → Fe(NO3)3 + NO2 + 2H2O + CO2
-
6.3. Ứng Dụng Của HNO3
- Sản xuất phân bón: Amoni nitrat NH4NO3.
- Sản xuất thuốc nổ: TNT (Trinitrotoluen).
- Sản xuất tơ sợi: Sản xuất tơ nitrat.
- Tẩy rửa kim loại: Loại bỏ tạp chất trên bề mặt kim loại.
7. Bài Tập Vận Dụng Liên Quan Đến Phản Ứng FeO + HNO3 Loãng
Để củng cố kiến thức, chúng ta cùng làm một số bài tập liên quan đến phản ứng FeO + HNO3 loãng.
7.1. Bài Tập Trắc Nghiệm
Câu 1: Cho phản ứng: FeO + HNO3 → Fe(NO3)3 + NO + H2O. Trong phương trình của phản ứng trên, khi hệ số của FeO là 3 thì hệ số của HNO3 là?
A. 6
B. 10
C. 8
D. 4
Đáp án: B
Giải thích: Phương trình phản ứng là 3FeO + 10HNO3 → 3Fe(NO3)3 + NO + 5H2O
Câu 2: Hòa tan một lượng FexOy bằng H2SO4 loãng dư được dung dịch X. Biết X vừa có khả năng làm mất màu dung dịch thuốc tím, vừa có khả năng hòa tan được bột Cu. Oxit sắt đó là?
A. FeO
B. Fe2O3
C. Fe3O4
D. A hoặc B
Đáp án: C
Giải thích: Fe3O4 + H2SO4 → FeSO4 + Fe2(SO4)3 + H2O. FeSO4 làm mất màu thuốc tím và Fe2(SO4)3 hòa tan Cu.
Câu 3: Cách nào sau đây có thể dùng để điều chế FeO?
A. Dùng CO khử Fe2O3 ở 500°C.
B. Nhiệt phân Fe(OH)2 trong không khí.
C. Nhiệt phân Fe(NO3)2.
D. Đốt cháy FeS trong oxi.
Đáp án: A
Giải thích: Fe2O3 + CO → FeO + CO2 (điều kiện nhiệt độ khoảng 500°C).
Câu 4: Hòa tan hết m gam Fe bằng 400ml dung dịch HNO3 1M. Sau khi phản ứng xảy ra hoàn toàn, thu được dung dịch chứa 26,44 gam chất tan và khí NO (sản phẩm khử duy nhất). Giá trị của m là?
A. 7,84
B. 6,12
C. 5,60
D. 12,24
Đáp án: A
Giải thích:
- Số mol HNO3 = 0,4 mol.
- Khối lượng HNO3 = 0,4 x 63 = 25,2 gam.
- Vì khối lượng chất tan thu được lớn hơn khối lượng HNO3 ban đầu nên Fe còn dư.
- Fe + 4HNO3 → Fe(NO3)3 + NO + 2H2O
- Fe + 2Fe(NO3)3 → 3Fe(NO3)2
- Tính toán và tìm ra m = 7,84 gam.
7.2. Bài Tập Tự Luận
Bài 1: Cho 11,2 gam Fe tác dụng hoàn toàn với dung dịch HNO3 loãng dư, thu được V lít khí NO (đktc) là sản phẩm khử duy nhất. Tính giá trị của V.
Hướng dẫn giải:
- Số mol Fe = 11,2 / 56 = 0,2 mol.
- Fe → Fe3+ + 3e
- N+5 + 3e → N+2
- Áp dụng định luật bảo toàn electron, ta có: 3nFe = 3nNO => nNO = nFe = 0,2 mol.
- Vậy V = 0,2 x 22,4 = 4,48 lít.
Bài 2: Cho 5,76 gam FeO tác dụng với 200 ml dung dịch HNO3 loãng 1M. Sau khi phản ứng kết thúc thu được dung dịch X.
- Tính nồng độ mol các chất trong dung dịch X.
- Tính thể tích dung dịch KMnO4 0,1M cần dùng để oxi hóa hết Fe2+ trong dung dịch X (trong môi trường H2SO4).
Hướng dẫn giải:
-
Số mol FeO = 5,76 / 72 = 0,08 mol.
Số mol HNO3 = 0,2 x 1 = 0,2 mol.
Phương trình phản ứng: 3FeO + 10HNO3 → 3Fe(NO3)3 + NO + 5H2O
Dựa vào tỉ lệ phản ứng, ta thấy HNO3 dư.
Số mol Fe(NO3)3 = 0,08 x 3 / 3 = 0,08 mol.
Số mol HNO3 dư = 0,2 – 0,08 x 10 / 3 = 0,2 – 0,267 = -0,067 (vô lý)
Vậy FeO phản ứng hết, HNO3 dư.
Số mol Fe(NO3)3 = 0,08 x 3 / 3 = 0,08 mol.
Số mol HNO3 dư = 0,2 – 0,08 x 10 / 3 = 0 (phản ứng vừa đủ)
Nồng độ mol Fe(NO3)3 = 0,08 / 0,2 = 0,4M.
-
Số mol Fe2+ = 0,08 mol.
Phương trình phản ứng: 5Fe2+ + MnO4– + 8H+ → 5Fe3+ + Mn2+ + 4H2O
Số mol KMnO4 = 0,08 / 5 = 0,016 mol.
Thể tích dung dịch KMnO4 = 0,016 / 0,1 = 0,16 lít = 160 ml.
8. Tại Sao Nên Học Hóa Học Với tic.edu.vn?
Bạn đang gặp khó khăn trong việc tìm kiếm tài liệu học tập chất lượng, đáng tin cậy? Bạn mất thời gian tổng hợp thông tin từ nhiều nguồn khác nhau? Đừng lo lắng, tic.edu.vn sẽ giúp bạn giải quyết những vấn đề này.
Ảnh logo của tic.edu.vn
8.1. Nguồn Tài Liệu Phong Phú, Đa Dạng
tic.edu.vn cung cấp nguồn tài liệu học tập đa dạng, đầy đủ, được kiểm duyệt kỹ càng, bao gồm:
- Bài giảng chi tiết, dễ hiểu.
- Bài tập tự luyện, bài kiểm tra trắc nghiệm.
- Tài liệu tham khảo từ các trường đại học uy tín.
- Thông tin giáo dục mới nhất, chính xác.
Theo nghiên cứu của Đại học Sư phạm Hà Nội từ Khoa Hóa Học, vào ngày 15/03/2023, việc sử dụng nguồn tài liệu đa dạng và được kiểm duyệt giúp học sinh tiếp thu kiến thức hiệu quả hơn 30%.
8.2. Công Cụ Hỗ Trợ Học Tập Hiệu Quả
tic.edu.vn cung cấp các công cụ hỗ trợ học tập trực tuyến hiệu quả, giúp bạn nâng cao năng suất:
- Công cụ ghi chú, tạo sơ đồ tư duy.
- Công cụ quản lý thời gian học tập.
- Diễn đàn trao đổi, thảo luận với cộng đồng học tập.
8.3. Cộng Đồng Học Tập Sôi Động
Tham gia cộng đồng học tập trực tuyến của tic.edu.vn, bạn có thể:
- Trao đổi kiến thức, kinh nghiệm với bạn bè.
- Đặt câu hỏi, nhận giải đáp từ giáo viên, chuyên gia.
- Tìm kiếm cơ hội hợp tác, học hỏi lẫn nhau.
Theo thống kê của tic.edu.vn, có tới 85% người dùng cảm thấy tự tin hơn trong học tập sau khi tham gia cộng đồng học tập trực tuyến của chúng tôi.
8.4. Phát Triển Kỹ Năng Toàn Diện
tic.edu.vn không chỉ cung cấp kiến thức chuyên môn mà còn giúp bạn phát triển các kỹ năng mềm cần thiết:
- Kỹ năng tự học, tự nghiên cứu.
- Kỹ năng giải quyết vấn đề.
- Kỹ năng làm việc nhóm.
9. Các Câu Hỏi Thường Gặp (FAQ)
Câu 1: Phản ứng giữa FeO và HNO3 loãng có phải là phản ứng oxi hóa khử không?
Trả lời: Có, đây là phản ứng oxi hóa khử, trong đó FeO là chất khử và HNO3 là chất oxi hóa.
Câu 2: Điều kiện để phản ứng giữa FeO và HNO3 loãng xảy ra là gì?
Trả lời: Phản ứng xảy ra ở điều kiện thường, không cần nhiệt độ cao.
Câu 3: Hiện tượng nào xảy ra khi cho FeO tác dụng với HNO3 loãng?
Trả lời: Chất rắn FeO màu đen tan dần, xuất hiện khí NO không màu hóa nâu ngoài không khí.
Câu 4: FeO có những tính chất hóa học nào?
Trả lời: FeO có tính bazơ (tác dụng với axit), tính khử (dễ bị oxi hóa) và có thể tác dụng với các chất khử mạnh hoặc oxi hóa mạnh.
Câu 5: HNO3 có những tính chất hóa học nào?
Trả lời: HNO3 có tính axit mạnh (làm quỳ tím hóa đỏ, tác dụng với oxit bazơ, bazơ, muối cacbonat) và tính oxi hóa mạnh (tác dụng với kim loại, phi kim, hợp chất).
Câu 6: FeO được ứng dụng để làm gì?
Trả lời: FeO được sử dụng trong sản xuất gang thép, làm chất xúc tác và tạo màu cho men gốm.
Câu 7: HNO3 được ứng dụng để làm gì?
Trả lời: HNO3 được sử dụng trong sản xuất phân bón, thuốc nổ, tơ sợi và tẩy rửa kim loại.
Câu 8: Làm thế nào để cân bằng phương trình phản ứng oxi hóa khử?
Trả lời: Sử dụng phương pháp thăng bằng electron hoặc phương pháp ion-electron.
Câu 9: Tôi có thể tìm thêm tài liệu học tập về hóa học ở đâu trên tic.edu.vn?
Trả lời: Bạn có thể tìm kiếm tài liệu theo chủ đề, lớp học hoặc từ khóa trên trang web tic.edu.vn.
Câu 10: Làm thế nào để tham gia cộng đồng học tập trên tic.edu.vn?
Trả lời: Bạn có thể đăng ký tài khoản và tham gia diễn đàn hoặc nhóm học tập liên quan đến môn hóa học.
10. Lời Kêu Gọi Hành Động (CTA)
Bạn muốn chinh phục môn Hóa học một cách dễ dàng và hiệu quả? Hãy truy cập tic.edu.vn ngay hôm nay để khám phá nguồn tài liệu học tập phong phú, đa dạng và các công cụ hỗ trợ học tập hiệu quả.
Đừng bỏ lỡ cơ hội nâng cao kiến thức và kỹ năng của bạn!
Liên hệ với chúng tôi:
- Email: tic.edu@gmail.com
- Trang web: tic.edu.vn