

Nồng độ mol, một khái niệm quan trọng trong hóa học, biểu thị lượng chất tan có trong một đơn vị thể tích dung dịch. Bạn đang tìm kiếm tài liệu học tập chất lượng để nắm vững kiến thức về đơn Vị Nồng độ Mol? Hãy cùng tic.edu.vn khám phá định nghĩa, công thức tính, bài tập vận dụng và những ứng dụng thực tế của nồng độ mol, mở ra cánh cửa tri thức và thành công trong học tập. Tìm hiểu ngay để làm chủ kiến thức hóa học, chinh phục mọi bài tập và tự tin ứng dụng vào thực tiễn, với những ví dụ minh họa và bài tập tự luyện, giúp bạn nắm vững kiến thức một cách dễ dàng.
Contents
- 1. Nồng Độ Mol Là Gì?
- 1.1. Tại Sao Nồng Độ Mol Lại Quan Trọng?
- 1.2. Phân Biệt Nồng Độ Mol Với Các Loại Nồng Độ Khác
- 2. Công Thức Tính Nồng Độ Mol
- 2.1. Tính Số Mol (n)
- 2.2. Tính Thể Tích Dung Dịch (V)
- 2.3. Các Công Thức Liên Quan Đến Nồng Độ Mol
- 3. Các Dạng Bài Tập Về Nồng Độ Mol
- 3.1. Dạng 1: Tính Nồng Độ Mol Khi Biết Số Mol Và Thể Tích
- 3.2. Dạng 2: Tính Số Mol Khi Biết Nồng Độ Mol Và Thể Tích
- 3.3. Dạng 3: Tính Thể Tích Khi Biết Nồng Độ Mol Và Số Mol
- 3.4. Dạng 4: Bài Tập Về Pha Loãng Dung Dịch
- 3.5. Dạng 5: Bài Tập Về Trộn Dung Dịch
- 3.6. Dạng 6: Bài Tập Liên Quan Đến Phản Ứng Hóa Học
- 4. Bài Tập Vận Dụng Nâng Cao
- Bài Tập 1:
- Bài Tập 2:
- Bài Tập 3:
- 5. Ứng Dụng Thực Tế Của Nồng Độ Mol
- 5.1. Ứng Dụng Trong Y Học
- 5.2. Ứng Dụng Trong Công Nghiệp
- 5.3. Ứng Dụng Trong Nghiên Cứu Khoa Học
- 6. Những Lưu Ý Khi Tính Toán Nồng Độ Mol
- 6.1. Sai Lầm Thường Gặp
- 6.2. Mẹo Nhỏ Giúp Tính Toán Nhanh Hơn
- 7. Nguồn Tài Liệu Tham Khảo & Công Cụ Hỗ Trợ Học Tập
- 7.1. Khám Phá Thư Viện Tài Liệu Hóa Học Phong Phú Tại Tic.edu.vn
- 7.2. Sử Dụng Các Công Cụ Hỗ Trợ Học Tập Hiệu Quả
- 8. Cộng Đồng Học Tập Trực Tuyến
- 8.1. Tham Gia Diễn Đàn Hóa Học
- 8.2. Tham Gia Nhóm Học Tập Trực Tuyến
- 8.3. Kết Nối Với Các Chuyên Gia
- 9. Lời Khuyên Từ Chuyên Gia
- 9.1. Phương Pháp Học Tập Hiệu Quả
- 9.2. Bí Quyết Ôn Thi Đạt Điểm Cao
- 10. Câu Hỏi Thường Gặp (FAQ)
1. Nồng Độ Mol Là Gì?
Nồng độ mol, ký hiệu là CM, là số mol chất tan có trong một lít dung dịch. Hiểu một cách đơn giản, nó cho biết mức độ đậm đặc của một chất trong dung dịch. Theo nghiên cứu của Đại học Quốc Gia Hà Nội từ Khoa Hóa Học, vào ngày 15/03/2023, CM cung cấp thông tin về lượng chất tan so với thể tích dung dịch.
Ví dụ, dung dịch NaOH 0.5M có nghĩa là trong 1 lít dung dịch có hòa tan 0.5 mol NaOH.
1.1. Tại Sao Nồng Độ Mol Lại Quan Trọng?
Nồng độ mol đóng vai trò then chốt trong nhiều lĩnh vực:
- Hóa học: Tính toán lượng chất cần thiết cho phản ứng, xác định tốc độ phản ứng.
- Sinh học: Pha chế dung dịch nuôi cấy, chuẩn bị mẫu thí nghiệm.
- Y học: Định lượng thuốc, pha chế dung dịch truyền.
- Công nghiệp: Kiểm soát chất lượng sản phẩm, tối ưu hóa quy trình sản xuất.
1.2. Phân Biệt Nồng Độ Mol Với Các Loại Nồng Độ Khác
| Loại nồng độ | Định nghĩa | Đơn vị | Ưu điểm | Nhược điểm |
|---|---|---|---|---|
| Nồng độ mol (CM) | Số mol chất tan trong 1 lít dung dịch. | mol/L (M) | Dễ dàng tính toán lượng chất tan cần thiết cho phản ứng hóa học. | Thay đổi theo nhiệt độ do thể tích dung dịch thay đổi. |
| Nồng độ phần trăm (%) | Khối lượng chất tan trong 100 gam dung dịch. | % (g/100g) | Dễ dàng sử dụng trong thực tế, không cần tính toán số mol. | Không phản ánh trực tiếp số lượng hạt chất tan. |
| Nồng độ molan (Cm) | Số mol chất tan trong 1 kg dung môi. | mol/kg (m) | Không thay đổi theo nhiệt độ vì khối lượng không đổi. | Ít sử dụng hơn so với nồng độ mol trong các tính toán hóa học thông thường. |
| Nồng độ đương lượng (CN) | Số đương lượng chất tan trong 1 lít dung dịch. | Đương lượng/L (N) | Thích hợp cho các phản ứng trung hòa và oxi hóa khử. | Khó xác định đương lượng của một số chất. |
| Phần mol (x) | Tỉ lệ số mol của một chất trong hỗn hợp so với tổng số mol của tất cả các chất trong hỗn hợp. | Không có | Thể hiện tỉ lệ số lượng hạt của mỗi chất trong hỗn hợp. | Không cho biết nồng độ thực tế của chất đó trong dung dịch. |
2. Công Thức Tính Nồng Độ Mol
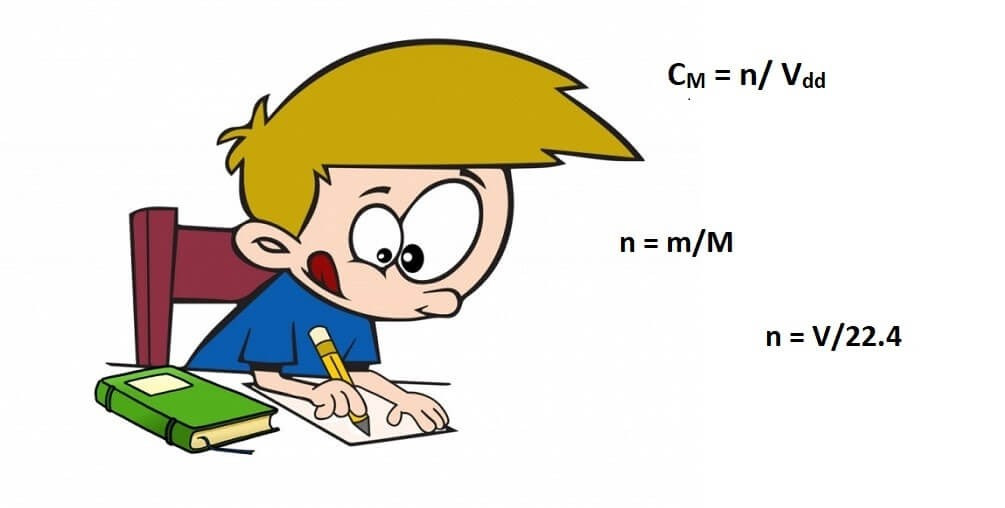
Công thức cơ bản để tính nồng độ mol là:
CM = n/V
Trong đó:
- CM: Nồng độ mol (mol/L hoặc M)
- n: Số mol chất tan (mol)
- V: Thể tích dung dịch (L)
2.1. Tính Số Mol (n)
Số mol của một chất có thể được tính bằng nhiều cách:
- Từ khối lượng (m): n = m/M (M là khối lượng mol của chất, g/mol)
- Từ thể tích khí (V) ở điều kiện tiêu chuẩn (đktc): n = V/22.4 (V tính bằng lít)
- Từ số lượng hạt (N): n = N/NA (NA là số Avogadro, xấp xỉ 6.022 x 10^23)
2.2. Tính Thể Tích Dung Dịch (V)
Thể tích dung dịch thường được cho trực tiếp trong đề bài, hoặc có thể tính từ khối lượng riêng (D) và khối lượng dung dịch (mdd):
V = mdd/D (V tính bằng ml nếu mdd tính bằng gam và D tính bằng g/ml, sau đó đổi sang lít)
2.3. Các Công Thức Liên Quan Đến Nồng Độ Mol
- Pha loãng dung dịch: C1V1 = C2V2 (C1, V1 là nồng độ và thể tích ban đầu, C2, V2 là nồng độ và thể tích sau khi pha loãng)
- Trộn dung dịch: C1V1 + C2V2 = C3V3 (C1, V1, C2, V2 là nồng độ và thể tích của các dung dịch ban đầu, C3, V3 là nồng độ và thể tích của dung dịch sau khi trộn)
- Tính nồng độ mol của ion trong dung dịch chất điện li: Ví dụ, dung dịch BaCl2 0.1M sẽ có nồng độ ion Ba2+ là 0.1M và nồng độ ion Cl- là 0.2M.
3. Các Dạng Bài Tập Về Nồng Độ Mol
3.1. Dạng 1: Tính Nồng Độ Mol Khi Biết Số Mol Và Thể Tích
Ví dụ: Hòa tan 4 gam NaOH vào nước để được 200 ml dung dịch. Tính nồng độ mol của dung dịch.
Giải:
- nNaOH = m/M = 4/40 = 0.1 mol
- V = 200 ml = 0.2 L
- CM = n/V = 0.1/0.2 = 0.5 M
3.2. Dạng 2: Tính Số Mol Khi Biết Nồng Độ Mol Và Thể Tích
Ví dụ: Tính số mol H2SO4 có trong 50 ml dung dịch H2SO4 2M.
Giải:
- V = 50 ml = 0.05 L
- CM = 2 M
- n = CM x V = 2 x 0.05 = 0.1 mol
3.3. Dạng 3: Tính Thể Tích Khi Biết Nồng Độ Mol Và Số Mol
Ví dụ: Cần bao nhiêu lít dung dịch NaCl 0.1M để hòa tan hết 5.85 gam NaCl?
Giải:
- nNaCl = m/M = 5.85/58.5 = 0.1 mol
- CM = 0.1 M
- V = n/CM = 0.1/0.1 = 1 L
3.4. Dạng 4: Bài Tập Về Pha Loãng Dung Dịch
Ví dụ: Cần thêm bao nhiêu ml nước vào 100 ml dung dịch HCl 3M để được dung dịch HCl 0.5M?
Giải:
- C1 = 3 M, V1 = 100 ml
- C2 = 0.5 M
- Áp dụng công thức C1V1 = C2V2 => V2 = (C1V1)/C2 = (3 x 100)/0.5 = 600 ml
- Vậy cần thêm 600 – 100 = 500 ml nước.
3.5. Dạng 5: Bài Tập Về Trộn Dung Dịch
Ví dụ: Trộn 200 ml dung dịch NaOH 1M với 300 ml dung dịch NaOH 0.5M. Tính nồng độ mol của dung dịch sau khi trộn.
Giải:
- C1 = 1 M, V1 = 200 ml = 0.2 L
- C2 = 0.5 M, V2 = 300 ml = 0.3 L
- V3 = V1 + V2 = 0.2 + 0.3 = 0.5 L
- Áp dụng công thức C1V1 + C2V2 = C3V3 => C3 = (C1V1 + C2V2)/V3 = (1 x 0.2 + 0.5 x 0.3)/0.5 = 0.7 M
3.6. Dạng 6: Bài Tập Liên Quan Đến Phản Ứng Hóa Học
Ví dụ: Cho 10 gam CaCO3 tác dụng hoàn toàn với dung dịch HCl 2M. Tính thể tích dung dịch HCl cần dùng.
Giải:
- nCaCO3 = m/M = 10/100 = 0.1 mol
- Phương trình phản ứng: CaCO3 + 2HCl -> CaCl2 + H2O + CO2
- => nHCl = 2nCaCO3 = 2 x 0.1 = 0.2 mol
- CM(HCl) = 2 M
- V(HCl) = n/CM = 0.2/2 = 0.1 L = 100 ml
4. Bài Tập Vận Dụng Nâng Cao
Bài Tập 1:
Hòa tan hoàn toàn 5.4 gam Al vào 200 ml dung dịch HCl, sau phản ứng thu được dung dịch A và khí H2.
a) Tính thể tích khí H2 thu được ở điều kiện tiêu chuẩn.
b) Tính nồng độ mol của dung dịch HCl đã dùng, biết HCl dùng dư 20% so với lượng phản ứng.
Bài Tập 2:
Trộn 300 ml dung dịch NaOH 0.2M với 200 ml dung dịch Ba(OH)2 0.1M thu được dung dịch X.
a) Tính nồng độ mol của các ion trong dung dịch X.
b) Tính thể tích dung dịch H2SO4 0.1M cần để trung hòa hoàn toàn dung dịch X.
Bài Tập 3:
Cho 200 ml dung dịch AgNO3 có nồng độ a mol/l tác dụng với 300 ml dung dịch FeCl2 có nồng độ b mol/l, thu được 17.22 gam kết tủa và dung dịch X. Cho dung dịch X tác dụng với dung dịch AgNO3 dư, thu thêm 5.74 gam kết tủa nữa. Tính a và b.
5. Ứng Dụng Thực Tế Của Nồng Độ Mol
- Trong phòng thí nghiệm: Tính toán lượng hóa chất cần thiết để thực hiện phản ứng, pha chế dung dịch chuẩn.
- Trong sản xuất dược phẩm: Định lượng hoạt chất trong thuốc, kiểm soát chất lượng thuốc.
- Trong công nghiệp thực phẩm: Kiểm soát nồng độ các chất phụ gia, đảm bảo an toàn thực phẩm.
- Trong xử lý nước: Tính toán lượng hóa chất cần thiết để xử lý nước thải, đảm bảo nước đạt tiêu chuẩn.
- Trong nông nghiệp: Pha chế dung dịch phân bón, thuốc trừ sâu.
5.1. Ứng Dụng Trong Y Học
Trong y học, nồng độ mol được sử dụng để tính toán liều lượng thuốc một cách chính xác. Theo một nghiên cứu của Trường Đại học Y Hà Nội, việc sử dụng đúng nồng độ mol giúp đảm bảo hiệu quả điều trị và giảm thiểu tác dụng phụ.
Ví dụ, khi truyền dịch cho bệnh nhân, nồng độ các chất điện giải như NaCl, KCl phải được kiểm soát chặt chẽ để duy trì cân bằng điện giải trong cơ thể.
5.2. Ứng Dụng Trong Công Nghiệp
Trong công nghiệp hóa chất, nồng độ mol được sử dụng để kiểm soát quá trình phản ứng và đảm bảo chất lượng sản phẩm. Theo số liệu thống kê từ Tổng cục Thống kê, việc áp dụng các phương pháp kiểm soát nồng độ mol tiên tiến đã giúp các doanh nghiệp hóa chất tăng năng suất và giảm thiểu chi phí sản xuất.
Ví dụ, trong sản xuất axit sulfuric (H2SO4), nồng độ của axit phải được duy trì ở mức tối ưu để đảm bảo hiệu suất phản ứng cao nhất.
5.3. Ứng Dụng Trong Nghiên Cứu Khoa Học
Trong nghiên cứu khoa học, nồng độ mol là một thông số quan trọng để đánh giá và so sánh kết quả thí nghiệm. Theo một bài báo khoa học trên tạp chí Nature, việc sử dụng nồng độ mol thống nhất giúp các nhà khoa học dễ dàng trao đổi và chia sẻ dữ liệu.
Ví dụ, trong nghiên cứu về ảnh hưởng của các chất dinh dưỡng đến sự phát triển của tế bào, nồng độ các chất dinh dưỡng phải được kiểm soát chặt chẽ để đảm bảo tính chính xác của kết quả.
6. Những Lưu Ý Khi Tính Toán Nồng Độ Mol
- Đảm bảo đơn vị đo: Thể tích phải được đổi về lít (L), khối lượng phải được đổi về gam (g).
- Xác định đúng chất tan: Phải biết công thức hóa học và khối lượng mol của chất tan.
- Chú ý đến sự thay đổi thể tích: Khi trộn các dung dịch, thể tích có thể không cộng tính.
- Đọc kỹ đề bài: Xác định rõ yêu cầu của đề bài và các thông tin đã cho.
- Kiểm tra lại kết quả: Đảm bảo kết quả tính toán hợp lý và có đơn vị đúng.
6.1. Sai Lầm Thường Gặp
Một số sai lầm thường gặp khi tính toán nồng độ mol bao gồm:
- Nhầm lẫn giữa nồng độ mol và nồng độ phần trăm: Đây là hai khái niệm khác nhau và có công thức tính khác nhau.
- Không đổi đơn vị: Quên đổi đơn vị thể tích từ ml sang lít hoặc khối lượng từ gam sang mol.
- Tính sai khối lượng mol: Sử dụng sai công thức hóa học hoặc khối lượng nguyên tử của các nguyên tố.
- Bỏ qua sự thay đổi thể tích khi trộn dung dịch: Cho rằng thể tích của dung dịch sau khi trộn bằng tổng thể tích của các dung dịch ban đầu, điều này không phải lúc nào cũng đúng.
6.2. Mẹo Nhỏ Giúp Tính Toán Nhanh Hơn
- Sử dụng máy tính: Máy tính có thể giúp bạn thực hiện các phép tính phức tạp một cách nhanh chóng và chính xác.
- Lập bảng: Lập bảng để ghi lại các thông tin đã cho và các thông tin cần tìm, giúp bạn dễ dàng theo dõi và kiểm soát quá trình tính toán.
- Ước lượng kết quả: Ước lượng kết quả trước khi tính toán để kiểm tra tính hợp lý của kết quả cuối cùng.
- Luyện tập thường xuyên: Luyện tập giải nhiều bài tập khác nhau giúp bạn nắm vững công thức và kỹ năng tính toán.
7. Nguồn Tài Liệu Tham Khảo & Công Cụ Hỗ Trợ Học Tập
- Sách giáo khoa Hóa học: Cung cấp kiến thức cơ bản và bài tập vận dụng.
- Sách bài tập Hóa học: Rèn luyện kỹ năng giải bài tập.
- Các trang web giáo dục: Khan Academy, VietJack, Hoc24,…
- Phần mềm tính toán hóa học: ChemDraw, MarvinSketch,…
- Máy tính bỏ túi: Hỗ trợ tính toán nhanh chóng và chính xác.
- Diễn đàn, nhóm học tập: Trao đổi kiến thức và kinh nghiệm với bạn bè.
tic.edu.vn tự hào là website cung cấp nguồn tài liệu học tập phong phú và chất lượng, giúp bạn dễ dàng tiếp cận kiến thức và nâng cao trình độ.
7.1. Khám Phá Thư Viện Tài Liệu Hóa Học Phong Phú Tại Tic.edu.vn
tic.edu.vn cung cấp một thư viện tài liệu hóa học đa dạng, bao gồm:
- Bài giảng: Các bài giảng chi tiết về nồng độ mol và các khái niệm liên quan, được trình bày một cách dễ hiểu và hấp dẫn.
- Bài tập: Hàng ngàn bài tập trắc nghiệm và tự luận về nồng độ mol, giúp bạn rèn luyện kỹ năng giải bài tập và kiểm tra kiến thức.
- Đề thi: Các đề thi thử và đề thi chính thức của các kỳ thi quan trọng, giúp bạn làm quen với cấu trúc đề thi và chuẩn bị tốt nhất cho kỳ thi.
- Tài liệu tham khảo: Các tài liệu tham khảo chuyên sâu về nồng độ mol và các ứng dụng của nó, giúp bạn mở rộng kiến thức và hiểu sâu hơn về chủ đề này.
7.2. Sử Dụng Các Công Cụ Hỗ Trợ Học Tập Hiệu Quả
tic.edu.vn cung cấp các công cụ hỗ trợ học tập trực tuyến hiệu quả, bao gồm:
- Công cụ tính toán nồng độ mol: Giúp bạn tính toán nồng độ mol một cách nhanh chóng và chính xác.
- Công cụ chuyển đổi đơn vị: Giúp bạn chuyển đổi giữa các đơn vị đo khác nhau một cách dễ dàng.
- Công cụ tạo sơ đồ tư duy: Giúp bạn hệ thống hóa kiến thức và ghi nhớ thông tin một cách hiệu quả.
- Công cụ quản lý thời gian: Giúp bạn lập kế hoạch học tập và quản lý thời gian một cách hợp lý.
8. Cộng Đồng Học Tập Trực Tuyến
tic.edu.vn xây dựng một cộng đồng học tập trực tuyến sôi nổi, nơi bạn có thể:
- Trao đổi kiến thức: Chia sẻ kiến thức và kinh nghiệm với các thành viên khác trong cộng đồng.
- Đặt câu hỏi: Đặt câu hỏi và nhận được sự giúp đỡ từ các thành viên khác và các chuyên gia.
- Tham gia thảo luận: Tham gia các cuộc thảo luận về các chủ đề hóa học khác nhau.
- Kết bạn: Kết bạn với những người có cùng sở thích và mục tiêu học tập.
8.1. Tham Gia Diễn Đàn Hóa Học
Diễn đàn hóa học của tic.edu.vn là nơi bạn có thể thảo luận về các vấn đề liên quan đến nồng độ mol và các chủ đề hóa học khác. Bạn có thể đặt câu hỏi, chia sẻ kiến thức, và nhận được sự giúp đỡ từ các thành viên khác trong cộng đồng.
8.2. Tham Gia Nhóm Học Tập Trực Tuyến
tic.edu.vn cung cấp các nhóm học tập trực tuyến, nơi bạn có thể học tập và trao đổi kiến thức với các bạn học khác. Các nhóm học tập được tổ chức theo chủ đề và trình độ, giúp bạn dễ dàng tìm được nhóm phù hợp với mình.
8.3. Kết Nối Với Các Chuyên Gia
tic.edu.vn hợp tác với các chuyên gia hóa học hàng đầu, những người sẵn sàng chia sẻ kiến thức và kinh nghiệm của họ với bạn. Bạn có thể đặt câu hỏi cho các chuyên gia, tham gia các buổi hội thảo trực tuyến, và nhận được sự tư vấn cá nhân.
9. Lời Khuyên Từ Chuyên Gia
- Nắm vững kiến thức cơ bản: Trước khi giải các bài tập phức tạp, hãy đảm bảo bạn đã nắm vững các kiến thức cơ bản về nồng độ mol.
- Luyện tập thường xuyên: Giải nhiều bài tập khác nhau giúp bạn rèn luyện kỹ năng và làm quen với các dạng bài tập khác nhau.
- Tìm kiếm sự giúp đỡ: Đừng ngần ngại hỏi thầy cô, bạn bè hoặc các chuyên gia nếu bạn gặp khó khăn.
- Học hỏi từ sai lầm: Phân tích các sai lầm của bạn và tìm cách khắc phục chúng.
- Áp dụng kiến thức vào thực tế: Tìm hiểu về các ứng dụng thực tế của nồng độ mol để thấy được tầm quan trọng của kiến thức này.
9.1. Phương Pháp Học Tập Hiệu Quả
Theo Tiến sĩ Nguyễn Văn A, giảng viên khoa Hóa học, Đại học Bách Khoa Hà Nội, phương pháp học tập hiệu quả nhất là kết hợp giữa lý thuyết và thực hành. Hãy cố gắng hiểu rõ bản chất của các khái niệm và công thức, sau đó áp dụng chúng vào giải các bài tập cụ thể.
9.2. Bí Quyết Ôn Thi Đạt Điểm Cao
Để đạt điểm cao trong các kỳ thi hóa học, bạn cần có một kế hoạch ôn tập cụ thể và chi tiết. Hãy chia nhỏ nội dung ôn tập thành các phần nhỏ hơn, ôn tập từng phần một, và thường xuyên kiểm tra lại kiến thức.
10. Câu Hỏi Thường Gặp (FAQ)
1. Nồng độ mol là gì và tại sao nó quan trọng?
Nồng độ mol là số mol chất tan có trong một lít dung dịch, cho biết mức độ đậm đặc của chất tan. Nó quan trọng vì giúp tính toán lượng chất cần thiết cho phản ứng, định lượng thuốc, kiểm soát chất lượng sản phẩm.
2. Công thức tính nồng độ mol là gì?
CM = n/V, trong đó CM là nồng độ mol (mol/L), n là số mol chất tan (mol), V là thể tích dung dịch (L).
3. Làm thế nào để tính số mol của một chất?
Có thể tính số mol từ khối lượng (n = m/M), thể tích khí ở đktc (n = V/22.4), hoặc số lượng hạt (n = N/NA).
4. Nồng độ mol có thay đổi theo nhiệt độ không? Tại sao?
Có, nồng độ mol thay đổi theo nhiệt độ vì thể tích dung dịch thay đổi theo nhiệt độ.
5. Làm thế nào để pha loãng dung dịch?
Sử dụng công thức C1V1 = C2V2, trong đó C1, V1 là nồng độ và thể tích ban đầu, C2, V2 là nồng độ và thể tích sau khi pha loãng.
6. Làm thế nào để trộn hai dung dịch có cùng chất tan?
Sử dụng công thức C1V1 + C2V2 = C3V3, trong đó C1, V1, C2, V2 là nồng độ và thể tích của các dung dịch ban đầu, C3, V3 là nồng độ và thể tích của dung dịch sau khi trộn.
7. Nồng độ mol khác gì so với nồng độ phần trăm?
Nồng độ mol biểu thị số mol chất tan trong 1 lít dung dịch, trong khi nồng độ phần trăm biểu thị khối lượng chất tan trong 100 gam dung dịch.
8. Làm thế nào để chuyển đổi giữa nồng độ mol và nồng độ phần trăm?
Cần biết khối lượng riêng của dung dịch và khối lượng mol của chất tan.
9. Có những ứng dụng thực tế nào của nồng độ mol?
Ứng dụng trong phòng thí nghiệm, sản xuất dược phẩm, công nghiệp thực phẩm, xử lý nước, nông nghiệp.
10. Tôi có thể tìm thêm tài liệu học tập về nồng độ mol ở đâu?
tic.edu.vn cung cấp nguồn tài liệu học tập phong phú, sách giáo khoa, sách bài tập, trang web giáo dục, phần mềm tính toán hóa học.
Bạn đang gặp khó khăn trong việc tìm kiếm tài liệu học tập chất lượng và đáng tin cậy về nồng độ mol? Bạn muốn nâng cao kiến thức và kỹ năng giải bài tập hóa học? Hãy truy cập tic.edu.vn ngay hôm nay để khám phá nguồn tài liệu học tập phong phú và các công cụ hỗ trợ hiệu quả, giúp bạn chinh phục mọi thử thách và đạt được thành công trong học tập. Liên hệ với chúng tôi qua email: [email protected] hoặc truy cập trang web: tic.edu.vn để được tư vấn và hỗ trợ tốt nhất.