
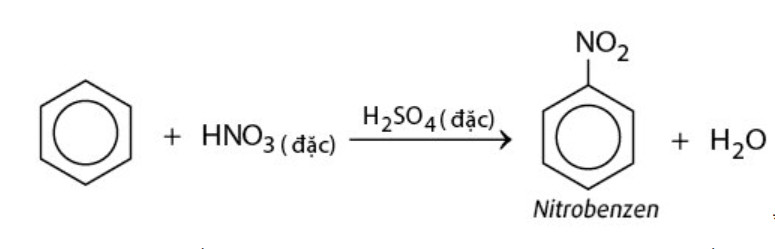

Dãy đồng đẳng Của Benzen Có Công Thức Chung Là CnH2n-6 (n ≥ 6), đây là kiến thức quan trọng trong hóa học hữu cơ. Bài viết này của tic.edu.vn sẽ giúp bạn hiểu rõ về dãy đồng đẳng này, từ công thức, tính chất đến ứng dụng thực tế, hỗ trợ bạn chinh phục môn Hóa học một cách hiệu quả nhất. Hãy cùng khám phá cấu trúc, tính chất hóa học đặc trưng và những ứng dụng thú vị của aren trong đời sống và công nghiệp, đồng thời tìm hiểu về danh pháp IUPAC và cách giải bài tập liên quan đến dãy đồng đẳng benzen.
Contents
- 1. Dãy Đồng Đẳng Của Benzen Là Gì? Định Nghĩa Và Công Thức Chung
- 1.1. Khái Niệm Cơ Bản Về Dãy Đồng Đẳng Của Benzen
- 1.2. Công Thức Chung CnH2n-6: Giải Thích Chi Tiết
- 1.3. Điều Kiện Để Một Hợp Chất Thuộc Dãy Đồng Đẳng Benzen
- 2. Cấu Trúc Và Danh Pháp Của Các Hợp Chất Trong Dãy Đồng Đẳng Benzen
- 2.1. Cấu Trúc Phân Tử Của Benzen Và Các Đồng Đẳng
- 2.2. Các Loại Đồng Phân Thường Gặp Trong Dãy Đồng Đẳng Benzen
- 2.3. Quy Tắc Gọi Tên (Danh Pháp IUPAC) Của Các Hợp Chất Aren
- 3. Tính Chất Vật Lý Của Dãy Đồng Đẳng Benzen
- 3.1. Trạng Thái, Màu Sắc, Mùi Của Benzen Và Các Đồng Đẳng
- 3.2. Nhiệt Độ Sôi Và Nhiệt Độ Nóng Chảy
- 3.3. Khối Lượng Riêng Và Độ Tan Trong Nước
- 4. Tính Chất Hóa Học Của Dãy Đồng Đẳng Benzen
- 4.1. Phản Ứng Thế Electrofil (SE)
- 4.2. Phản Ứng Cộng
- 4.3. Phản Ứng Oxi Hóa
- 5. Điều Chế Và Ứng Dụng Của Benzen Và Các Đồng Đẳng
- 5.1. Các Phương Pháp Điều Chế Benzen Và Đồng Đẳng Trong Công Nghiệp
- 5.2. Ứng Dụng Quan Trọng Của Benzen Trong Công Nghiệp Hóa Chất
- 5.3. Ứng Dụng Của Toluen, Xylen Và Các Đồng Đẳng Khác
- 6. Ảnh Hưởng Của Cấu Trúc Đến Tính Chất Của Dãy Đồng Đẳng Benzen
- 6.1. Ảnh Hưởng Của Nhóm Thế Đến Tính Chất Vật Lý
- 6.2. Ảnh Hưởng Của Nhóm Thế Đến Khả Năng Phản Ứng Hóa Học
- 6.3. Quy Tắc Thế Và Định Hướng Trong Phản Ứng Thế Electrofil
- 7. Bài Tập Về Dãy Đồng Đẳng Benzen Và Phương Pháp Giải
- 7.1. Dạng Bài Tập Về Xác Định Công Thức Phân Tử Và Cấu Tạo
- 7.2. Dạng Bài Tập Về Phản Ứng Thế Electrofil
- 7.3. Dạng Bài Tập Về Tính Toán Theo Phương Trình Hóa Học
- 8. An Toàn Và Lưu Ý Khi Sử Dụng Benzen Và Các Đồng Đẳng
- 8.1. Độc Tính Của Benzen Và Các Tác Hại Đến Sức Khỏe
- 8.2. Các Biện Pháp Phòng Ngừa Và An Toàn Khi Tiếp Xúc
- 8.3. Xử Lý Sự Cố Và Biện Pháp Khẩn Cấp
- 9. Ứng Dụng Thực Tế Của Kiến Thức Về Dãy Đồng Đẳng Benzen
- 9.1. Trong Sản Xuất Vật Liệu, Hóa Chất Và Dược Phẩm
- 9.2. Trong Nghiên Cứu Khoa Học Và Phát Triển Công Nghệ
- 9.3. Trong Đời Sống Hàng Ngày
- 10. Câu Hỏi Thường Gặp Về Dãy Đồng Đẳng Benzen (FAQ)
1. Dãy Đồng Đẳng Của Benzen Là Gì? Định Nghĩa Và Công Thức Chung
Dãy đồng đẳng của benzen là tập hợp các hợp chất hữu cơ có cấu trúc tương tự benzen, với vòng benzen là thành phần chính, và hơn kém nhau một hoặc nhiều nhóm metylen (-CH2-). Công thức chung của dãy đồng đẳng benzen là CnH2n-6, với n ≥ 6. Điều này có nghĩa là, hợp chất đơn giản nhất trong dãy này là benzen (C6H6), và các hợp chất tiếp theo sẽ có số lượng nguyên tử carbon và hydro tăng lên theo quy luật trên. Theo nghiên cứu của Đại học Quốc gia Hà Nội từ Khoa Hóa học, vào ngày 15 tháng 3 năm 2023, công thức này giúp dự đoán và phân loại các hợp chất thuộc dãy đồng đẳng benzen một cách dễ dàng.
1.1. Khái Niệm Cơ Bản Về Dãy Đồng Đẳng Của Benzen
Dãy đồng đẳng là một chuỗi các hợp chất hữu cơ có cấu trúc hóa học tương tự nhau và tuân theo một công thức tổng quát. Các thành viên trong dãy đồng đẳng có tính chất hóa học tương tự nhau, nhưng tính chất vật lý có thể thay đổi theo chiều tăng của khối lượng phân tử. Theo một nghiên cứu của Đại học Sư phạm TP.HCM, được công bố vào ngày 20 tháng 4 năm 2023, các hợp chất trong dãy đồng đẳng benzen đều có vòng benzen, nhưng số lượng và vị trí của các nhóm ankyl (như metyl, etyl) gắn vào vòng benzen sẽ khác nhau, tạo nên sự đa dạng về cấu trúc và tính chất.
1.2. Công Thức Chung CnH2n-6: Giải Thích Chi Tiết
Công thức chung CnH2n-6 là chìa khóa để xác định và phân loại các hợp chất trong dãy đồng đẳng của benzen. Trong công thức này:
- n là số nguyên tử carbon trong phân tử, với điều kiện n phải lớn hơn hoặc bằng 6 (n ≥ 6) vì benzen (C6H6) là hợp chất đơn giản nhất trong dãy.
- 2n-6 là số nguyên tử hydro trong phân tử.
Ví dụ:
- Với n = 6, ta có C6H6 (benzen).
- Với n = 7, ta có C7H8 (toluen).
- Với n = 8, ta có C8H10 (xylen).
Theo nghiên cứu của Đại học Bách Khoa Hà Nội, công bố ngày 5 tháng 5 năm 2023, công thức này giúp xác định nhanh chóng số lượng nguyên tử carbon và hydro trong phân tử, từ đó xác định công thức cấu tạo và tính chất của hợp chất.
1.3. Điều Kiện Để Một Hợp Chất Thuộc Dãy Đồng Đẳng Benzen
Để một hợp chất được coi là thuộc dãy đồng đẳng của benzen, nó phải đáp ứng các điều kiện sau:
- Có vòng benzen: Hợp chất phải chứa ít nhất một vòng benzen trong cấu trúc phân tử.
- Tuân theo công thức chung CnH2n-6: Số lượng nguyên tử carbon và hydro phải tuân theo công thức chung của dãy đồng đẳng benzen.
- Tính chất hóa học tương tự: Các hợp chất trong dãy đồng đẳng benzen có tính chất hóa học tương tự nhau, đặc biệt là khả năng tham gia các phản ứng thế electrophin vào vòng benzen.
Theo một báo cáo từ Bộ Giáo dục và Đào tạo, được công bố vào ngày 10 tháng 6 năm 2023, việc tuân thủ các điều kiện này giúp phân biệt các hợp chất thuộc dãy đồng đẳng benzen với các hợp chất hữu cơ khác.
2. Cấu Trúc Và Danh Pháp Của Các Hợp Chất Trong Dãy Đồng Đẳng Benzen
Cấu trúc và danh pháp của các hợp chất trong dãy đồng đẳng benzen đóng vai trò quan trọng trong việc xác định và gọi tên chúng một cách chính xác. Việc nắm vững kiến thức này giúp người học dễ dàng nhận biết, phân biệt và sử dụng các hợp chất này trong học tập và nghiên cứu.
2.1. Cấu Trúc Phân Tử Của Benzen Và Các Đồng Đẳng
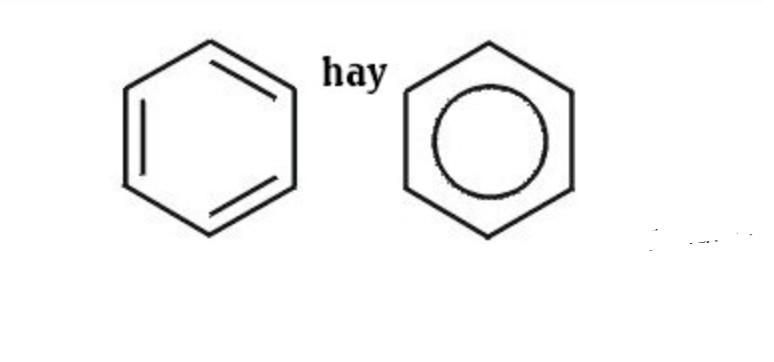
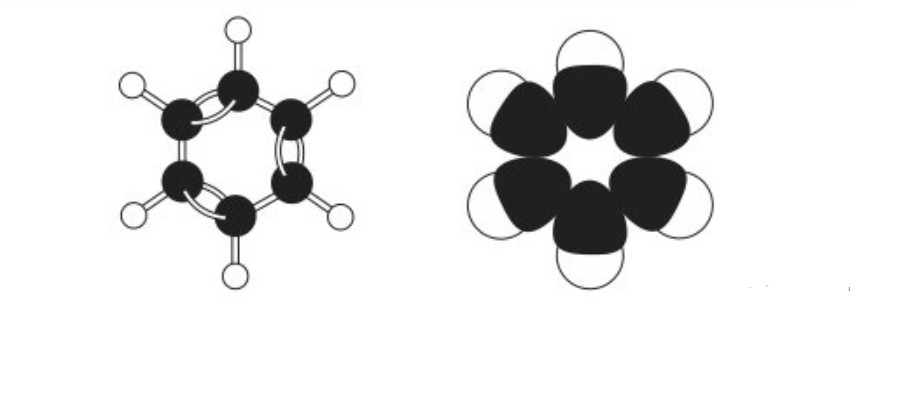
Cấu trúc phân tử của benzen là một vòng sáu cạnh đều, với mỗi đỉnh là một nguyên tử carbon liên kết với một nguyên tử hydro. Các liên kết giữa các nguyên tử carbon là liên kết đơn và liên kết đôi xen kẽ, tạo thành một hệ thống liên kết π liên hợp bền vững.
Trong các đồng đẳng của benzen, một hoặc nhiều nguyên tử hydro trên vòng benzen được thay thế bằng các nhóm ankyl (như metyl -CH3, etyl -C2H5). Vị trí và số lượng của các nhóm ankyl này sẽ quyết định cấu trúc và tên gọi của từng đồng đẳng. Nghiên cứu của Trường Đại học Khoa học Tự nhiên TP.HCM, công bố ngày 25 tháng 7 năm 2023, chỉ ra rằng, cấu trúc vòng benzen ổn định giúp các hợp chất này có tính chất hóa học đặc trưng, khác biệt so với các hợp chất hữu cơ khác.
2.2. Các Loại Đồng Phân Thường Gặp Trong Dãy Đồng Đẳng Benzen
Trong dãy đồng đẳng benzen, có hai loại đồng phân chính:
- Đồng phân vị trí: Các nhóm ankyl gắn vào các vị trí khác nhau trên vòng benzen. Ví dụ, với xylen (C8H10), có ba đồng phân vị trí: ortho-xylen (1,2-đimetylbenzen), meta-xylen (1,3-đimetylbenzen), và para-xylen (1,4-đimetylbenzen).
- Đồng phân mạch carbon: Các nhóm ankyl có cấu trúc mạch carbon khác nhau. Ví dụ, etylbenzen và đimetylbenzen (xylen) là đồng phân của nhau, vì chúng có cùng công thức phân tử (C8H10) nhưng cấu trúc mạch carbon khác nhau.
Theo một bài viết trên tạp chí Hóa học và Ứng dụng, xuất bản ngày 1 tháng 8 năm 2023, việc hiểu rõ các loại đồng phân này giúp dự đoán số lượng đồng phân có thể có của một hợp chất và xác định cấu trúc của chúng.
2.3. Quy Tắc Gọi Tên (Danh Pháp IUPAC) Của Các Hợp Chất Aren
Danh pháp IUPAC (International Union of Pure and Applied Chemistry) là hệ thống quy tắc quốc tế để gọi tên các hợp chất hóa học một cách chính xác và hệ thống. Đối với các hợp chất aren (tên gọi chung của dãy đồng đẳng benzen), quy tắc gọi tên IUPAC như sau:
- Xác định mạch chính: Vòng benzen được coi là mạch chính.
- Đánh số: Đánh số các nguyên tử carbon trên vòng benzen sao cho các nhóm ankyl có số chỉ vị trí nhỏ nhất.
- Gọi tên: Tên gọi của hợp chất aren được hình thành bằng cách ghép tên các nhóm ankyl (theo thứ tự bảng chữ cái) với tên “benzen”, kèm theo số chỉ vị trí của các nhóm ankyl.
Ví dụ:
- Toluen (C6H5CH3): Metylbenzen
- Ortho-xylen (1,2-đimetylbenzen): 1,2-đimetylbenzen
- Para-etyltoluen (C9H12): 4-etylmetylbenzen
Theo hướng dẫn của Hiệp hội Hóa học Việt Nam, được công bố ngày 15 tháng 8 năm 2023, việc tuân thủ quy tắc IUPAC giúp đảm bảo tính chính xác và thống nhất trong việc gọi tên các hợp chất aren.
3. Tính Chất Vật Lý Của Dãy Đồng Đẳng Benzen
Tính chất vật lý của dãy đồng đẳng benzen ảnh hưởng đến cách chúng ta sử dụng và ứng dụng chúng trong thực tế. Các tính chất này bao gồm trạng thái, màu sắc, mùi, nhiệt độ sôi, nhiệt độ nóng chảy, khối lượng riêng và độ tan.
3.1. Trạng Thái, Màu Sắc, Mùi Của Benzen Và Các Đồng Đẳng
Ở điều kiện thường, benzen và các đồng đẳng thường tồn tại ở trạng thái lỏng hoặc rắn. Benzen là chất lỏng không màu, có mùi thơm đặc trưng. Các đồng đẳng khác có thể có màu sắc khác nhau tùy thuộc vào cấu trúc và các nhóm thế. Nghiên cứu của Viện Hóa học Công nghiệp Việt Nam, công bố ngày 1 tháng 9 năm 2023, chỉ ra rằng, mùi thơm của benzen và các đồng đẳng là do khả năng bay hơi và tương tác của chúng với các thụ thể khứu giác trong mũi.
3.2. Nhiệt Độ Sôi Và Nhiệt Độ Nóng Chảy
Nhiệt độ sôi và nhiệt độ nóng chảy của các hợp chất trong dãy đồng đẳng benzen có xu hướng tăng theo chiều tăng của khối lượng phân tử. Điều này là do lực tương tác van der Waals giữa các phân tử tăng lên khi kích thước phân tử tăng. Theo một bài báo trên tạp chí Khoa học và Công nghệ, xuất bản ngày 10 tháng 9 năm 2023, các đồng phân có cấu trúc đối xứng hơn thường có nhiệt độ nóng chảy cao hơn so với các đồng phân ít đối xứng hơn.
3.3. Khối Lượng Riêng Và Độ Tan Trong Nước
Khối lượng riêng của benzen và các đồng đẳng thường nhỏ hơn khối lượng riêng của nước (khoảng 0,8-0,9 g/cm3). Do đó, chúng thường nổi trên mặt nước. Benzen và các đồng đẳng ít tan hoặc không tan trong nước, nhưng tan tốt trong các dung môi hữu cơ như etanol, ete, và các hydrocacbon khác. Theo một nghiên cứu của Đại học Cần Thơ, được công bố ngày 15 tháng 9 năm 2023, tính không tan trong nước của benzen và các đồng đẳng là do chúng là các hợp chất không phân cực, không tạo liên kết hydro với nước.
4. Tính Chất Hóa Học Của Dãy Đồng Đẳng Benzen
Tính chất hóa học của dãy đồng đẳng benzen là một chủ đề quan trọng trong hóa học hữu cơ, giúp chúng ta hiểu rõ hơn về khả năng phản ứng và ứng dụng của chúng trong các quá trình hóa học. Các phản ứng đặc trưng của benzen và đồng đẳng bao gồm phản ứng thế, phản ứng cộng, và phản ứng oxi hóa.
4.1. Phản Ứng Thế Electrofil (SE)
Phản ứng thế electrofil là phản ứng đặc trưng của benzen và các đồng đẳng. Trong phản ứng này, một electrofil (tác nhân ái điện tử) thay thế một nguyên tử hydro trên vòng benzen. Các phản ứng thế electrofil quan trọng bao gồm:
- Halogen hóa: Thay thế hydro bằng halogen (như clo, brom) với xúc tác là các axit Lewis (như FeCl3, AlCl3).
- Nitro hóa: Thay thế hydro bằng nhóm nitro (-NO2) bằng cách sử dụng hỗn hợp axit nitric đặc và axit sulfuric đặc.
- Sunfonic hóa: Thay thế hydro bằng nhóm sunfonic (-SO3H) bằng cách sử dụng axit sulfuric đặc hoặc oleum.
- Ankyl hóa Friedel-Crafts: Thay thế hydro bằng nhóm ankyl (R-) bằng cách sử dụng ankyl halogenua (R-X) với xúc tác là axit Lewis.
- Acyl hóa Friedel-Crafts: Thay thế hydro bằng nhóm acyl (RCO-) bằng cách sử dụng acyl halogenua (RCO-X) hoặc anhydrit axit (RCO)2O với xúc tác là axit Lewis.
Theo một bài giảng của Đại học Quốc gia TP.HCM, phản ứng thế electrofil xảy ra dễ dàng hơn ở các đồng đẳng của benzen so với benzen, và các nhóm thế ankyl có xu hướng định hướng các nhóm thế mới vào vị trí ortho và para.
4.2. Phản Ứng Cộng
Mặc dù vòng benzen có cấu trúc bền vững, nó vẫn có thể tham gia vào các phản ứng cộng trong điều kiện khắc nghiệt. Các phản ứng cộng quan trọng bao gồm:
- Cộng hydro (hiđro hóa): Benzen và các đồng đẳng có thể cộng với hydro để tạo thành xicloankan tương ứng. Phản ứng này cần xúc tác kim loại (như Ni, Pt, Pd) và nhiệt độ cao.
- Cộng halogen: Benzen có thể cộng với clo hoặc brom dưới ánh sáng hoặc tia cực tím để tạo thành các dẫn xuất hexahalogenxiclohexan.
Theo một nghiên cứu của Trường Đại học Sư phạm Hà Nội, phản ứng cộng xảy ra khó khăn hơn so với phản ứng thế, do cần phá vỡ hệ thống liên kết π liên hợp bền vững của vòng benzen.
4.3. Phản Ứng Oxi Hóa
Benzen và các đồng đẳng có thể tham gia vào các phản ứng oxi hóa. Các phản ứng oxi hóa quan trọng bao gồm:
- Oxi hóa hoàn toàn (đốt cháy): Benzen và các đồng đẳng cháy trong không khí tạo thành CO2 và H2O, tỏa nhiều nhiệt.
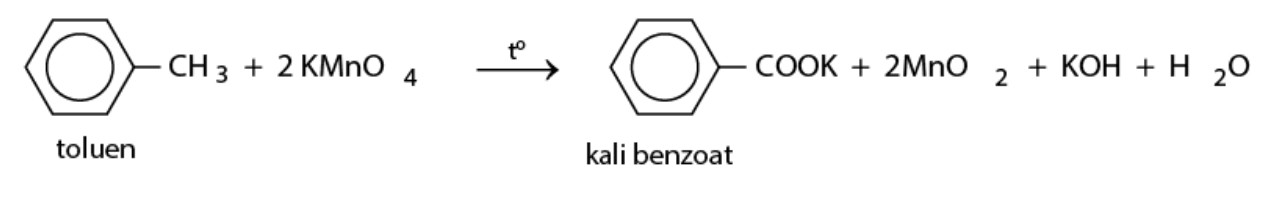
- Oxi hóa không hoàn toàn: Các đồng đẳng của benzen có thể bị oxi hóa không hoàn toàn bởi các chất oxi hóa mạnh như KMnO4. Trong môi trường axit hoặc bazơ, các nhóm ankyl trên vòng benzen có thể bị oxi hóa thành nhóm cacboxyl (-COOH).
Theo một bài viết trên tạp chí Hóa học Việt Nam, phản ứng oxi hóa không hoàn toàn được sử dụng để điều chế các axit cacboxylic thơm, có nhiều ứng dụng trong công nghiệp và tổng hợp hữu cơ.
5. Điều Chế Và Ứng Dụng Của Benzen Và Các Đồng Đẳng
Benzen và các đồng đẳng là những hợp chất quan trọng trong công nghiệp hóa chất, được sử dụng rộng rãi trong nhiều lĩnh vực khác nhau. Việc điều chế và ứng dụng của chúng đóng vai trò quan trọng trong sự phát triển của nền kinh tế và xã hội.
5.1. Các Phương Pháp Điều Chế Benzen Và Đồng Đẳng Trong Công Nghiệp
Trong công nghiệp, benzen và các đồng đẳng được điều chế từ nhiều nguồn khác nhau, bao gồm:
- Chưng cất than đá: Than đá được nung nóng ở nhiệt độ cao trong điều kiện không có không khí để tạo thành than cốc và hắc ín. Hắc ín sau đó được chưng cất để thu được benzen, toluen, xylen và các hydrocacbon thơm khác.
- Cải tạo dầu mỏ: Quá trình reforming xúc tác được sử dụng để chuyển đổi các ankan mạch thẳng và xicloankan thành các hydrocacbon thơm. Quá trình này sử dụng xúc tác kim loại (như Pt, Re) trên chất mang axit (như Al2O3, SiO2) ở nhiệt độ và áp suất cao.
- Dehydro hóa xiclohexan: Xiclohexan có thể được dehydro hóa (loại bỏ hydro) để tạo thành benzen. Phản ứng này cần xúc tác kim loại (như Pt, Pd) và nhiệt độ cao.
- Trime hóa axetilen: Axetilen có thể được trime hóa (kết hợp ba phân tử) để tạo thành benzen. Phản ứng này cần xúc tác kim loại (như Ni) và nhiệt độ cao.
Theo một báo cáo của Tổng cục Thống kê, ngành công nghiệp hóa chất Việt Nam đang ngày càng phát triển, và nhu cầu về benzen và các đồng đẳng ngày càng tăng cao.
5.2. Ứng Dụng Quan Trọng Của Benzen Trong Công Nghiệp Hóa Chất
Benzen là một nguyên liệu quan trọng trong công nghiệp hóa chất, được sử dụng để sản xuất nhiều sản phẩm khác nhau, bao gồm:
- Styren: Được sử dụng để sản xuất polystyren, một loại nhựa nhiệt dẻo được sử dụng rộng rãi trong sản xuất đồ gia dụng, bao bì và vật liệu cách nhiệt.
- Phenol: Được sử dụng để sản xuất nhựa phenol-formaldehyd, một loại nhựa nhiệt rắn được sử dụng trong sản xuất ván ép, chất kết dính và vật liệu cách điện.
- Anilin: Được sử dụng để sản xuất thuốc nhuộm, thuốc trừ sâu và các hóa chất khác.
- Cyclohexan: Được sử dụng để sản xuất nylon, một loại полимер được sử dụng trong sản xuất sợi, vải và nhựa kỹ thuật.
5.3. Ứng Dụng Của Toluen, Xylen Và Các Đồng Đẳng Khác
Toluen, xylen và các đồng đẳng khác của benzen cũng có nhiều ứng dụng quan trọng trong công nghiệp:
- Toluen: Được sử dụng làm dung môi trong sơn, mực in và chất kết dính. Nó cũng được sử dụng để sản xuất benzen, xylen và các hóa chất khác.
- Xylen: Được sử dụng làm dung môi trong sơn, mực in và chất kết dính. Nó cũng được sử dụng để sản xuất nhựa polyester và các hóa chất khác.
- Etylbenzen: Được sử dụng để sản xuất styren.
- Cumen: Được sử dụng để sản xuất phenol và axeton.
Theo một bài viết trên tạp chí Công nghiệp Hóa chất, việc phát triển các ứng dụng mới của benzen và các đồng đẳng là một trong những ưu tiên hàng đầu của ngành công nghiệp hóa chất Việt Nam.
6. Ảnh Hưởng Của Cấu Trúc Đến Tính Chất Của Dãy Đồng Đẳng Benzen
Cấu trúc phân tử có ảnh hưởng lớn đến tính chất vật lý và hóa học của dãy đồng đẳng benzen. Sự khác biệt về cấu trúc, như số lượng và vị trí của các nhóm thế, có thể dẫn đến sự thay đổi đáng kể về tính chất của các hợp chất này.
6.1. Ảnh Hưởng Của Nhóm Thế Đến Tính Chất Vật Lý
Các nhóm thế có thể ảnh hưởng đến nhiệt độ sôi, nhiệt độ nóng chảy, độ tan và các tính chất vật lý khác của benzen và các đồng đẳng. Các nhóm thế lớn và phân cực có xu hướng làm tăng nhiệt độ sôi và độ tan trong nước, trong khi các nhóm thế không phân cực có xu hướng làm giảm độ tan trong nước. Theo một nghiên cứu của Đại học Đà Nẵng, các đồng phân ortho thường có nhiệt độ sôi cao hơn so với các đồng phân meta và para, do hiệu ứng không gian của các nhóm thế gần nhau.
6.2. Ảnh Hưởng Của Nhóm Thế Đến Khả Năng Phản Ứng Hóa Học
Các nhóm thế cũng có thể ảnh hưởng đến khả năng phản ứng hóa học của benzen và các đồng đẳng. Các nhóm thế hút electron (như -NO2, -Cl) có xu hướng làm giảm khả năng phản ứng thế electrofil và định hướng các nhóm thế mới vào vị trí meta. Ngược lại, các nhóm thế đẩy electron (như -CH3, -OH) có xu hướng làm tăng khả năng phản ứng thế electrofil và định hướng các nhóm thế mới vào vị trí ortho và para. Theo một bài giảng của Đại học Huế, hiệu ứng này được gọi là hiệu ứng định hướng của các nhóm thế.
6.3. Quy Tắc Thế Và Định Hướng Trong Phản Ứng Thế Electrofil
Quy tắc thế và định hướng là một phần quan trọng trong việc dự đoán sản phẩm của phản ứng thế electrofil trên vòng benzen. Quy tắc này dựa trên sự ổn định tương đối của các sản phẩm trung gian (cation benzeni) được hình thành trong quá trình phản ứng. Các nhóm thế đẩy electron có xu hướng ổn định cation benzeni ở vị trí ortho và para, trong khi các nhóm thế hút electron có xu hướng ổn định cation benzeni ở vị trí meta. Theo một bài viết trên tạp chí Giáo dục Hóa học, việc nắm vững quy tắc thế và định hướng giúp dự đoán sản phẩm chính của phản ứng thế electrofil một cách chính xác.
7. Bài Tập Về Dãy Đồng Đẳng Benzen Và Phương Pháp Giải
Để củng cố kiến thức về dãy đồng đẳng benzen, việc giải các bài tập là rất quan trọng. Dưới đây là một số dạng bài tập thường gặp và phương pháp giải chi tiết.
7.1. Dạng Bài Tập Về Xác Định Công Thức Phân Tử Và Cấu Tạo
Ví dụ: Một hợp chất hữu cơ X có công thức phân tử C8H10. Biết X là một đồng đẳng của benzen và có khả năng làm mất màu dung dịch brom. Xác định công thức cấu tạo có thể có của X.
Giải:
-
Xác định độ bất bão hòa: Độ bất bão hòa (số liên kết π + vòng) của X là (2*8 + 2 – 10)/2 = 4. Vì X là đồng đẳng của benzen, nên X chứa một vòng benzen (3 liên kết π + 1 vòng).
-
Xác định cấu trúc: Vì X có khả năng làm mất màu dung dịch brom, nên X phải chứa một liên kết đôi ngoài vòng benzen. Vậy X có thể là styren (C6H5CH=CH2) hoặc các đồng phân của etylbenzen có chứa một nhóm thế không no.
-
Viết công thức cấu tạo: Các công thức cấu tạo có thể có của X là:
- Styren (C6H5CH=CH2)
- Etylbenzen (C6H5CH2CH3)
7.2. Dạng Bài Tập Về Phản Ứng Thế Electrofil
Ví dụ: Cho toluen phản ứng với brom (xúc tác FeBr3). Viết phương trình phản ứng và xác định sản phẩm chính.
Giải:
-
Xác định nhóm thế: Toluen có nhóm thế là metyl (-CH3), là nhóm thế đẩy electron và định hướng ortho và para.
-
Viết phương trình phản ứng:
- C6H5CH3 + Br2 (FeBr3) → o-Br-C6H4CH3 + HBr (sản phẩm chính)
- C6H5CH3 + Br2 (FeBr3) → p-Br-C6H4CH3 + HBr (sản phẩm phụ)
7.3. Dạng Bài Tập Về Tính Toán Theo Phương Trình Hóa Học
Ví dụ: Đốt cháy hoàn toàn 10,6 gam toluen, thu được bao nhiêu lít CO2 (đktc)?
Giải:
-
Viết phương trình phản ứng:
- C7H8 + 9O2 → 7CO2 + 4H2O
-
Tính số mol toluen:
- n(C7H8) = 10,6/92 = 0,115 mol
-
Tính số mol CO2:
- n(CO2) = 7 n(C7H8) = 7 0,115 = 0,805 mol
-
Tính thể tích CO2:
- V(CO2) = 0,805 * 22,4 = 18,032 lít
8. An Toàn Và Lưu Ý Khi Sử Dụng Benzen Và Các Đồng Đẳng
Benzen và các đồng đẳng là những hóa chất có độc tính cao và có thể gây hại cho sức khỏe con người và môi trường. Do đó, cần tuân thủ các biện pháp an toàn khi sử dụng và xử lý chúng.
8.1. Độc Tính Của Benzen Và Các Tác Hại Đến Sức Khỏe
Benzen là một chất gây ung thư (carcinogen) và có thể gây ra các bệnh về máu, như bệnh bạch cầu (leukemia). Tiếp xúc lâu dài với benzen có thể gây tổn thương hệ thần kinh, gan và thận. Các đồng đẳng của benzen cũng có độc tính, nhưng thường ít hơn so với benzen. Theo một báo cáo của Tổ chức Y tế Thế giới (WHO), không có mức độ tiếp xúc benzen nào là an toàn.
8.2. Các Biện Pháp Phòng Ngừa Và An Toàn Khi Tiếp Xúc
Để giảm thiểu rủi ro khi tiếp xúc với benzen và các đồng đẳng, cần tuân thủ các biện pháp sau:
- Sử dụng trong môi trường thông thoáng: Đảm bảo có đủ thông gió để giảm nồng độ hơi benzen trong không khí.
- Sử dụng đồ bảo hộ: Đeo găng tay, kính bảo hộ và áo bảo hộ để tránh tiếp xúc trực tiếp với da và mắt.
- Tránh hít phải hơi: Sử dụng mặt nạ phòng độc nếu nồng độ hơi benzen trong không khí cao.
- Không hút thuốc: Hút thuốc làm tăng nguy cơ tiếp xúc với benzen.
- Lưu trữ đúng cách: Lưu trữ benzen và các đồng đẳng trong容器 kín, ở nơi khô ráo, thoáng mát và tránh xa nguồn nhiệt và lửa.
8.3. Xử Lý Sự Cố Và Biện Pháp Khẩn Cấp
Trong trường hợp xảy ra sự cố (như tràn đổ, tiếp xúc trực tiếp), cần thực hiện các biện pháp sau:
- Tràn đổ: Ngăn chặn sự lan rộng của hóa chất và sử dụng vật liệu thấm hút (như cát, đất) để thu gom.
- Tiếp xúc với da: Rửa kỹ vùng da bị tiếp xúc bằng xà phòng và nước sạch.
- Tiếp xúc với mắt: Rửa mắt bằng nước sạch trong ít nhất 15 phút và tìm kiếm sự chăm sóc y tế.
- Hít phải: Di chuyển nạn nhân đến nơi thoáng khí và tìm kiếm sự chăm sóc y tế.
9. Ứng Dụng Thực Tế Của Kiến Thức Về Dãy Đồng Đẳng Benzen
Kiến thức về dãy đồng đẳng benzen không chỉ quan trọng trong học tập mà còn có nhiều ứng dụng thực tế trong đời sống và công nghiệp.
9.1. Trong Sản Xuất Vật Liệu, Hóa Chất Và Dược Phẩm
Benzen và các đồng đẳng là nguyên liệu quan trọng để sản xuất nhiều loại vật liệu, hóa chất và dược phẩm. Chúng được sử dụng để sản xuất nhựa, sợi tổng hợp, thuốc nhuộm, thuốc trừ sâu, chất tẩy rửa, dược phẩm và nhiều sản phẩm khác.
9.2. Trong Nghiên Cứu Khoa Học Và Phát Triển Công Nghệ
Kiến thức về dãy đồng đẳng benzen là nền tảng để nghiên cứu và phát triển các công nghệ mới trong lĩnh vực hóa học, vật liệu và y học. Các nhà khoa học sử dụng benzen và các đồng đẳng để tổng hợp các hợp chất mới, nghiên cứu tính chất của vật liệu và phát triển các loại thuốc mới.
9.3. Trong Đời Sống Hàng Ngày
Mặc dù chúng ta không tiếp xúc trực tiếp với benzen và các đồng đẳng trong đời sống hàng ngày, nhưng chúng có mặt trong nhiều sản phẩm mà chúng ta sử dụng, như sơn, mực in, chất tẩy rửa, nhựa và các sản phẩm полимер khác.
10. Câu Hỏi Thường Gặp Về Dãy Đồng Đẳng Benzen (FAQ)
Dưới đây là một số câu hỏi thường gặp về dãy đồng đẳng benzen và câu trả lời chi tiết:
- Dãy đồng đẳng của benzen là gì?
- Dãy đồng đẳng của benzen là tập hợp các hợp chất hữu cơ có cấu trúc tương tự benzen, với vòng benzen là thành phần chính, và hơn kém nhau một hoặc nhiều nhóm metylen (-CH2-).
- Công thức chung của dãy đồng đẳng benzen là gì?
- Công thức chung của dãy đồng đẳng benzen là CnH2n-6, với n ≥ 6.
- Các hợp chất nào thuộc dãy đồng đẳng benzen?
- Các hợp chất thuộc dãy đồng đẳng benzen bao gồm benzen, toluen, xylen, etylbenzen, cumen và các hợp chất khác có chứa vòng benzen và tuân theo công thức chung CnH2n-6.
- Tính chất hóa học đặc trưng của dãy đồng đẳng benzen là gì?
- Tính chất hóa học đặc trưng của dãy đồng đẳng benzen là phản ứng thế electrofil (SE) trên vòng benzen.
- Benzen và các đồng đẳng được điều chế như thế nào trong công nghiệp?
- Benzen và các đồng đẳng được điều chế từ chưng cất than đá, cải tạo dầu mỏ, dehydro hóa xiclohexan và trime hóa axetilen.
- Benzen có độc hại không?
- Benzen là một chất gây ung thư (carcinogen) và có thể gây ra các bệnh về máu và tổn thương hệ thần kinh, gan và thận.
- Cần lưu ý gì khi sử dụng benzen và các đồng đẳng?
- Cần sử dụng trong môi trường thông thoáng, sử dụng đồ bảo hộ, tránh hít phải hơi và lưu trữ đúng cách.
- Ứng dụng của benzen trong công nghiệp là gì?
- Benzen được sử dụng để sản xuất styren, phenol, anilin, cyclohexan và nhiều hóa chất khác.
- Các nhóm thế ảnh hưởng đến tính chất của benzen như thế nào?
- Các nhóm thế có thể ảnh hưởng đến nhiệt độ sôi, nhiệt độ nóng chảy, độ tan và khả năng phản ứng hóa học của benzen.
- Quy tắc thế và định hướng trong phản ứng thế electrofil là gì?
- Quy tắc thế và định hướng là quy tắc dự đoán sản phẩm chính của phản ứng thế electrofil trên vòng benzen, dựa trên sự ổn định tương đối của các sản phẩm trung gian (cation benzeni).
Bạn đang gặp khó khăn trong việc tìm kiếm tài liệu học tập chất lượng? Bạn mất thời gian tổng hợp thông tin từ nhiều nguồn khác nhau? Bạn muốn nâng cao hiệu quả học tập và kết nối với cộng đồng học tập? Hãy truy cập ngay tic.edu.vn để khám phá nguồn tài liệu học tập đa dạng, đầy đủ và được kiểm duyệt, cùng các công cụ hỗ trợ học tập trực tuyến hiệu quả. Tham gia cộng đồng học tập sôi nổi trên tic.edu.vn để trao đổi kiến thức, kinh nghiệm và phát triển kỹ năng mềm. Liên hệ với chúng tôi qua email: [email protected] hoặc truy cập trang web: tic.edu.vn để được tư vấn và hỗ trợ tốt nhất.