Chào mừng bạn đến với thế giới ankan, nơi những bí mật của hóa học hữu cơ được hé lộ một cách dễ dàng và thú vị trên tic.edu.vn. Bài viết này sẽ giúp bạn nắm vững Công Thức Tổng Quát Của Ankan, từ đó chinh phục mọi bài tập liên quan và mở ra cánh cửa kiến thức rộng lớn. Hãy cùng tic.edu.vn khám phá nhé!
Contents
- 1. Ankan Là Gì Và Tại Sao Cần Nắm Vững Công Thức Tổng Quát?
- 1.1. Định Nghĩa Ankan: Nền Tảng Vững Chắc Cho Hóa Học Hữu Cơ
- 1.2. Tầm Quan Trọng Của Công Thức Tổng Quát Của Ankan
- 2. Giải Mã Chi Tiết Công Thức Tổng Quát CnH2n+2
- 2.1. Ý Nghĩa Của “n” Trong Công Thức Ankan
- 2.2. Tại Sao Số Lượng Nguyên Tử Hydro Lại Là “2n+2”?
- 2.3. Liên Hệ Giữa Công Thức Tổng Quát Và Cấu Trúc Phân Tử Ankan
- 3. Ứng Dụng Công Thức Tổng Quát Của Ankan Trong Bài Tập Hóa Học
- 3.1. Xác Định Công Thức Phân Tử Của Ankan Khi Biết Số Nguyên Tử Cacbon
- 3.2. Tính Toán Khối Lượng Mol Và Thành Phần Phần Trăm Các Nguyên Tố Trong Ankan
- 3.3. Giải Các Bài Toán Đốt Cháy Ankan
- 3.4. Xác Định Ankan Dựa Vào Tỉ Lệ Số Mol CO2 Và H2O Khi Đốt Cháy
- 4. Mở Rộng Kiến Thức Về Ankan: Đồng Phân, Danh Pháp, Tính Chất
- 4.1. Đồng Phân Ankan: Sự Đa Dạng Của Cấu Trúc
- 4.2. Danh Pháp Ankan: Gọi Tên Theo Quy Tắc IUPAC
- 4.3. Tính Chất Vật Lý Của Ankan: Ảnh Hưởng Của Khối Lượng Phân Tử
- 4.4. Tính Chất Hóa Học Của Ankan: Phản Ứng Thế Là Chủ Yếu
- 5. Điều Chế Và Ứng Dụng Của Ankan Trong Đời Sống Và Công Nghiệp
- 5.1. Điều Chế Ankan: Từ Phòng Thí Nghiệm Đến Công Nghiệp
- 5.2. Ứng Dụng Của Ankan: Nguồn Năng Lượng Và Nguyên Liệu Quý Giá
- 6. So Sánh Ankan Với Anken Và Ankin: Điểm Giống Và Khác Biệt
- 7. Bài Tập Vận Dụng Về Công Thức Tổng Quát Của Ankan
- 8. Tại Sao Nên Học Hóa Hữu Cơ Với Tic.edu.vn?
- 8.1. Nguồn Tài Liệu Học Tập Đa Dạng Và Đầy Đủ
- 8.2. Cập Nhật Thông Tin Giáo Dục Mới Nhất
- 8.3. Công Cụ Hỗ Trợ Học Tập Trực Tuyến Hiệu Quả
- 8.4. Cộng Đồng Học Tập Trực Tuyến Sôi Nổi
- 8.5. Phát Triển Kỹ Năng Mềm Và Kỹ Năng Chuyên Môn
- 9. Lời Kêu Gọi Hành Động (CTA)
1. Ankan Là Gì Và Tại Sao Cần Nắm Vững Công Thức Tổng Quát?
1.1. Định Nghĩa Ankan: Nền Tảng Vững Chắc Cho Hóa Học Hữu Cơ
Ankan là gì? Ankan, hay còn gọi là parafin, là những hydrocacbon no mạch hở, nghĩa là chúng chỉ chứa các liên kết đơn (σ) giữa các nguyên tử cacbon và hydro. Đặc điểm này tạo nên sự ổn định tương đối của ankan. Theo nghiên cứu từ Khoa Hóa học, Đại học Quốc gia Hà Nội, ngày 15/03/2023, việc nắm vững khái niệm ankan là nền tảng để hiểu sâu hơn về các loại hợp chất hữu cơ khác.
1.2. Tầm Quan Trọng Của Công Thức Tổng Quát Của Ankan
Công thức tổng quát của ankan là gì? Công thức tổng quát của ankan là CnH2n+2, với n là số nguyên dương chỉ số lượng nguyên tử cacbon trong phân tử. Công thức này không chỉ giúp xác định số lượng nguyên tử của mỗi nguyên tố trong phân tử ankan mà còn là chìa khóa để giải quyết nhiều bài toán hóa học hữu cơ.
Ví dụ, nếu bạn biết một ankan có 5 nguyên tử cacbon (n=5), bạn có thể dễ dàng suy ra công thức phân tử của nó là C5H12.
2. Giải Mã Chi Tiết Công Thức Tổng Quát CnH2n+2
2.1. Ý Nghĩa Của “n” Trong Công Thức Ankan
“n” đại diện cho số nguyên tử cacbon trong phân tử ankan. Giá trị của n luôn là một số nguyên dương (n ≥ 1). Theo một báo cáo từ Viện Hóa học Công nghiệp Việt Nam năm 2022, sự thay đổi giá trị n ảnh hưởng trực tiếp đến tính chất vật lý (nhiệt độ sôi, nhiệt độ nóng chảy) và hóa học của ankan.
2.2. Tại Sao Số Lượng Nguyên Tử Hydro Lại Là “2n+2”?
Trong phân tử ankan, mỗi nguyên tử cacbon liên kết với bốn nguyên tử khác (cacbon hoặc hydro) thông qua các liên kết đơn. Do đó, số lượng nguyên tử hydro luôn nhiều hơn gấp đôi số lượng nguyên tử cacbon hai đơn vị (2n+2).
2.3. Liên Hệ Giữa Công Thức Tổng Quát Và Cấu Trúc Phân Tử Ankan
Công thức tổng quát CnH2n+2 phản ánh cấu trúc no của ankan, tức là mỗi nguyên tử cacbon đã liên kết tối đa với các nguyên tử khác. Điều này giải thích tại sao ankan tương đối trơ về mặt hóa học và chỉ tham gia vào một số phản ứng đặc trưng như phản ứng thế, phản ứng cracking, và phản ứng cháy.
3. Ứng Dụng Công Thức Tổng Quát Của Ankan Trong Bài Tập Hóa Học
3.1. Xác Định Công Thức Phân Tử Của Ankan Khi Biết Số Nguyên Tử Cacbon
Đây là ứng dụng cơ bản nhất của công thức tổng quát. Ví dụ:
- Một ankan có 3 nguyên tử cacbon. Áp dụng công thức CnH2n+2 với n=3, ta có công thức phân tử là C3H8 (propan).
- Một ankan có 8 nguyên tử cacbon. Áp dụng công thức CnH2n+2 với n=8, ta có công thức phân tử là C8H18 (octan).
3.2. Tính Toán Khối Lượng Mol Và Thành Phần Phần Trăm Các Nguyên Tố Trong Ankan
Khi biết công thức phân tử, bạn có thể dễ dàng tính toán khối lượng mol (M) của ankan và thành phần phần trăm khối lượng của cacbon (%C) và hydro (%H).
Ví dụ: Tính khối lượng mol và %C, %H trong etan (C2H6).
- M(C2H6) = 2 12 + 6 1 = 30 g/mol
- %C = (2 12 / 30) 100% = 80%
- %H = (6 1 / 30) 100% = 20%
3.3. Giải Các Bài Toán Đốt Cháy Ankan
Phản ứng đốt cháy ankan là một phản ứng quan trọng trong hóa học hữu cơ. Phương trình tổng quát của phản ứng đốt cháy ankan là:
CnH2n+2 + (3n+1)/2 O2 → nCO2 + (n+1) H2O
Từ phương trình này, bạn có thể giải các bài toán liên quan đến lượng chất tham gia và sản phẩm tạo thành, ví dụ:
- Tính thể tích khí oxi cần dùng để đốt cháy hoàn toàn một lượng ankan nhất định.
- Tính khối lượng CO2 và H2O tạo thành khi đốt cháy hoàn toàn một lượng ankan nhất định.
3.4. Xác Định Ankan Dựa Vào Tỉ Lệ Số Mol CO2 Và H2O Khi Đốt Cháy
Trong phản ứng đốt cháy ankan, tỉ lệ số mol CO2 và H2O luôn nhỏ hơn 1 (nCO2 < nH2O). Dựa vào tỉ lệ này, bạn có thể xác định một hydrocacbon đã cho có phải là ankan hay không.
Ví dụ: Đốt cháy hoàn toàn một hydrocacbon X thu được 2 mol CO2 và 3 mol H2O. Vì nCO2 < nH2O, X là ankan.
4. Mở Rộng Kiến Thức Về Ankan: Đồng Phân, Danh Pháp, Tính Chất
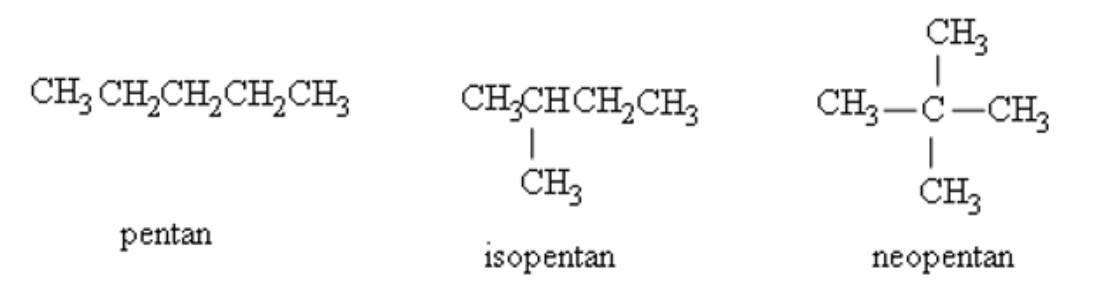
4.1. Đồng Phân Ankan: Sự Đa Dạng Của Cấu Trúc
Đồng phân là những hợp chất có cùng công thức phân tử nhưng khác nhau về công thức cấu tạo. Ankan bắt đầu có đồng phân từ C4H10 (butan). Số lượng đồng phân tăng lên nhanh chóng khi số lượng nguyên tử cacbon tăng lên.
Ví dụ: C4H10 có 2 đồng phân: butan và 2-metylpropan (isobutan).
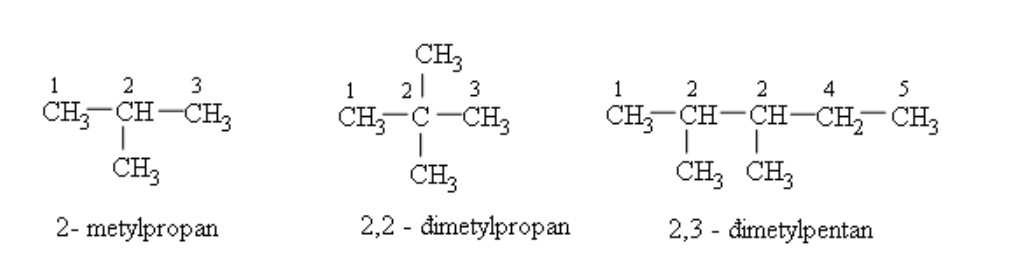
4.2. Danh Pháp Ankan: Gọi Tên Theo Quy Tắc IUPAC
Việc gọi tên ankan (danh pháp) tuân theo quy tắc của IUPAC (International Union of Pure and Applied Chemistry). Quy tắc này giúp đảm bảo mỗi ankan có một tên gọi duy nhất và dễ dàng nhận biết.
- Ankan mạch thẳng: Tên mạch cacbon + “an”. Ví dụ: CH4 (metan), C2H6 (etan), C3H8 (propan), C4H10 (butan), C5H12 (pentan)…
- Ankan mạch nhánh: Số chỉ vị trí nhánh – tên nhánh + tên mạch chính + “an”. Ví dụ: 2-metylpropan, 2,2-đimetylbutan…
4.3. Tính Chất Vật Lý Của Ankan: Ảnh Hưởng Của Khối Lượng Phân Tử
Tính chất vật lý của ankan (nhiệt độ sôi, nhiệt độ nóng chảy, trạng thái tồn tại) phụ thuộc vào khối lượng phân tử.
- Trạng thái: Từ C1 đến C4 là chất khí, từ C5 đến C17 là chất lỏng, từ C18 trở lên là chất rắn (ở điều kiện thường).
- Nhiệt độ sôi và nhiệt độ nóng chảy: Tăng dần khi số lượng nguyên tử cacbon tăng lên.
4.4. Tính Chất Hóa Học Của Ankan: Phản Ứng Thế Là Chủ Yếu
Ankan tương đối trơ về mặt hóa học do chỉ chứa các liên kết đơn bền vững. Tuy nhiên, chúng vẫn tham gia vào một số phản ứng quan trọng:
-
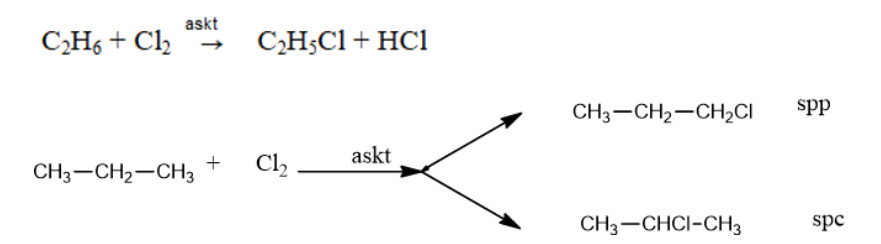
Phản ứng thế halogen (halogen hóa): Ankan phản ứng với halogen (Cl2, Br2) dưới tác dụng của ánh sáng hoặc nhiệt độ, tạo thành dẫn xuất halogen.
Ví dụ: CH4 + Cl2 → CH3Cl + HCl
-
Phản ứng cracking (phân cắt mạch cacbon): Ankan bị phân cắt thành các phân tử nhỏ hơn (ankan và anken) ở nhiệt độ cao và có xúc tác.
Ví dụ: C5H12 → C2H4 + C3H8
-
Phản ứng oxi hóa (đốt cháy): Ankan cháy trong oxi tạo thành CO2 và H2O, tỏa nhiều nhiệt.
Ví dụ: CH4 + 2O2 → CO2 + 2H2O
5. Điều Chế Và Ứng Dụng Của Ankan Trong Đời Sống Và Công Nghiệp
5.1. Điều Chế Ankan: Từ Phòng Thí Nghiệm Đến Công Nghiệp
-
Trong công nghiệp: Ankan được tách từ khí thiên nhiên và dầu mỏ.
-
Trong phòng thí nghiệm:
-
Điều chế metan bằng cách nung natri axetat với vôi tôi xút:
CH3COONa + NaOH → CH4 + Na2CO3
-
Cho nhôm cacbua tác dụng với nước:
Al4C3 + 12H2O → 3CH4 + 4Al(OH)3
-
5.2. Ứng Dụng Của Ankan: Nguồn Năng Lượng Và Nguyên Liệu Quý Giá
Ankan có nhiều ứng dụng quan trọng trong đời sống và công nghiệp:
- Nhiên liệu: Ankan được sử dụng làm nhiên liệu cho động cơ đốt trong, lò sưởi, và các thiết bị khác. Ví dụ: metan (khí đốt), propan (gas), butan (bật lửa), xăng (chứa nhiều ankan từ C5 đến C10).
- Dung môi: Ankan lỏng được sử dụng làm dung môi trong các quá trình hóa học và công nghiệp.
- Nguyên liệu: Ankan là nguyên liệu để sản xuất nhiều hóa chất quan trọng khác, như etilen, propilen, benzen, toluen, và các polyme.
- Dầu bôi trơn: Các ankan mạch dài được sử dụng làm dầu bôi trơn cho máy móc.
6. So Sánh Ankan Với Anken Và Ankin: Điểm Giống Và Khác Biệt
Để hiểu rõ hơn về ankan, chúng ta hãy so sánh chúng với hai loại hydrocacbon khác là anken và ankin.
| Đặc điểm | Ankan (CnH2n+2) | Anken (CnH2n) | Ankin (CnH2n-2) |
|---|---|---|---|
| Liên kết | Chỉ liên kết đơn | Có 1 liên kết đôi | Có 1 liên kết ba |
| Tính chất hóa học | Phản ứng thế, phản ứng cracking, phản ứng cháy | Phản ứng cộng, phản ứng trùng hợp, phản ứng oxi hóa | Phản ứng cộng, phản ứng đime hóa, trime hóa, phản ứng oxi hóa |
| Ứng dụng | Nhiên liệu, dung môi, nguyên liệu | Sản xuất polyme, hóa chất | Sản xuất hóa chất, hàn cắt kim loại |
7. Bài Tập Vận Dụng Về Công Thức Tổng Quát Của Ankan
Để củng cố kiến thức, hãy cùng giải một số bài tập vận dụng sau:
Câu 1: Đốt cháy hoàn toàn 5.8 gam ankan X thu được 8.96 lít CO2 (đktc). Xác định công thức phân tử của X.
Hướng dẫn giải:
- Tính số mol CO2: nCO2 = 8.96 / 22.4 = 0.4 mol
- Gọi công thức phân tử của ankan X là CnH2n+2.
- Phương trình đốt cháy: CnH2n+2 + (3n+1)/2 O2 → nCO2 + (n+1) H2O
- Theo phương trình, số mol ankan = nCO2 / n = 0.4 / n
- Khối lượng mol của ankan X: M(X) = 5.8 / (0.4 / n) = 14.5n
- Ta có: 14.5n = 12n + 2n + 2 => 0.5n = 2 => n = 4
- Vậy công thức phân tử của X là C4H10.
Câu 2: Một ankan có công thức phân tử là C6H14. Viết công thức cấu tạo và gọi tên các đồng phân của ankan này.
Hướng dẫn giải:
C6H14 có 5 đồng phân:
- CH3-CH2-CH2-CH2-CH2-CH3 (hexan)
- CH3-CH(CH3)-CH2-CH2-CH3 (2-metylpentan)
- CH3-CH2-CH(CH3)-CH2-CH3 (3-metylpentan)
- CH3-CH(CH3)-CH(CH3)-CH3 (2,3-đimetylbutan)
- CH3-C(CH3)2-CH2-CH3 (2,2-đimetylbutan)
Câu 3: Cho 10 lít hỗn hợp khí gồm ankan X và oxi dư vào khí nhiên kế. Sau khi cho nổ, thể tích giảm 16 lít (các thể tích đo ở cùng điều kiện). Tìm công thức phân tử của X.
Hướng dẫn giải:
- Gọi công thức phân tử của ankan X là CnH2n+2 và thể tích của X là V lít.
- Thể tích O2 dư là 10 – V lít.
- Phương trình phản ứng đốt cháy: CnH2n+2 + (3n+1)/2 O2 → nCO2 + (n+1) H2O
- Thể tích hỗn hợp khí sau phản ứng: nCO2 + nH2O + (10 – V) – (3n+1)/2 *V = 10 – 16
- Giả thiết H2O ngưng tụ hết: nCO2 + (10 – V) – (3n+1)/2 *V = 10 – 16
- Theo phương trình: V n + (10 – V) – (3n+1)/2 V = -6
- Giải phương trình bậc nhất một ẩn số, tìm ra n = 2 => công thức của ankan là C2H6
8. Tại Sao Nên Học Hóa Hữu Cơ Với Tic.edu.vn?
Bạn đang gặp khó khăn trong việc tìm kiếm tài liệu học tập chất lượng về hóa hữu cơ? Bạn mất thời gian tổng hợp kiến thức từ nhiều nguồn khác nhau? Bạn cần công cụ hỗ trợ học tập hiệu quả và một cộng đồng để trao đổi kiến thức? tic.edu.vn chính là giải pháp hoàn hảo cho bạn!
8.1. Nguồn Tài Liệu Học Tập Đa Dạng Và Đầy Đủ
tic.edu.vn cung cấp nguồn tài liệu học tập đa dạng, đầy đủ và được kiểm duyệt kỹ lưỡng, bao gồm:
- Bài giảng chi tiết về lý thuyết và bài tập hóa hữu cơ, từ cơ bản đến nâng cao.
- Đề thi và đáp án các năm, giúp bạn làm quen với cấu trúc đề thi và rèn luyện kỹ năng giải bài.
- Sách tham khảo và tài liệu chuyên ngành, giúp bạn mở rộng kiến thức và hiểu sâu hơn về hóa học.
8.2. Cập Nhật Thông Tin Giáo Dục Mới Nhất
tic.edu.vn luôn cập nhật thông tin giáo dục mới nhất và chính xác, giúp bạn không bỏ lỡ bất kỳ thông tin quan trọng nào:
- Thông tin về kỳ thi THPT Quốc gia, kỳ thi học sinh giỏi, và các kỳ thi khác.
- Thông tin về các trường đại học, cao đẳng, và các chương trình đào tạo.
- Thông tin về các phương pháp học tập hiệu quả và các xu hướng giáo dục mới nhất.
8.3. Công Cụ Hỗ Trợ Học Tập Trực Tuyến Hiệu Quả
tic.edu.vn cung cấp các công cụ hỗ trợ học tập trực tuyến hiệu quả, giúp bạn nâng cao năng suất học tập:
- Công cụ ghi chú trực tuyến, giúp bạn dễ dàng ghi lại và sắp xếp kiến thức.
- Công cụ quản lý thời gian, giúp bạn lên kế hoạch học tập và làm việc hiệu quả.
- Công cụ kiểm tra kiến thức, giúp bạn đánh giá trình độ và xác định những kiến thức cần bổ sung.
8.4. Cộng Đồng Học Tập Trực Tuyến Sôi Nổi
tic.edu.vn xây dựng cộng đồng học tập trực tuyến sôi nổi, nơi bạn có thể:
- Trao đổi kiến thức và kinh nghiệm với các bạn học sinh, sinh viên khác.
- Đặt câu hỏi và nhận được sự giúp đỡ từ các thầy cô giáo và các chuyên gia.
- Tham gia các hoạt động học tập nhóm và các cuộc thi trực tuyến.
8.5. Phát Triển Kỹ Năng Mềm Và Kỹ Năng Chuyên Môn
tic.edu.vn không chỉ cung cấp kiến thức chuyên môn mà còn giúp bạn phát triển các kỹ năng mềm cần thiết cho sự thành công trong học tập và công việc:
- Kỹ năng tự học và tự nghiên cứu.
- Kỹ năng làm việc nhóm và giao tiếp.
- Kỹ năng giải quyết vấn đề và tư duy sáng tạo.
9. Lời Kêu Gọi Hành Động (CTA)
Bạn đã sẵn sàng chinh phục hóa hữu cơ và đạt điểm cao trong các kỳ thi chưa? Hãy truy cập ngay tic.edu.vn để khám phá nguồn tài liệu học tập phong phú, sử dụng các công cụ hỗ trợ hiệu quả, và tham gia cộng đồng học tập sôi nổi. Chúng tôi tin rằng với sự hỗ trợ của tic.edu.vn, bạn sẽ thành công!
Liên hệ với chúng tôi:
- Email: [email protected]
- Trang web: tic.edu.vn
Hãy để tic.edu.vn đồng hành cùng bạn trên con đường chinh phục tri thức!