

Công Thức Tính C là gì? Bạn đang tìm kiếm cách tính nồng độ phần trăm một cách chính xác và hiệu quả? Bài viết này từ tic.edu.vn sẽ cung cấp cho bạn một hướng dẫn toàn diện về công thức tính C, các ứng dụng thực tế và những lưu ý quan trọng để giải quyết các bài toán hóa học một cách dễ dàng.
Contents
- 1. Hiểu Rõ Về Nồng Độ Dung Dịch
- 1.1. Định Nghĩa Nồng Độ Dung Dịch
- 1.2. Các Yếu Tố Ảnh Hưởng Đến Nồng Độ
- 1.3. Phân Loại Nồng Độ Dung Dịch
- 2. Nồng Độ Phần Trăm (C%) – Khái Niệm và Ý Nghĩa
- 2.1. Định Nghĩa Nồng Độ Phần Trăm (C%)
- 2.2. Ưu Điểm Của Nồng Độ Phần Trăm
- 2.3. Nhược Điểm Của Nồng Độ Phần Trăm
- 3. Công Thức Tính Nồng Độ Phần Trăm (C%) Chi Tiết
- 3.1. Công Thức Gốc
- 3.2. Xác Định Khối Lượng Dung Dịch (mdd)
- 3.3. Các Dạng Bài Tập Về Công Thức Tính C%
- 4. Hướng Dẫn Sử Dụng Công Thức Tính Nồng Độ Phần Trăm (C%) Hiệu Quả
- 4.1. Bước 1: Xác Định Các Chất Trong Dung Dịch
- 4.2. Bước 2: Tính Khối Lượng Dung Dịch Sau Phản Ứng
- 4.3. Bước 3: Tìm Khối Lượng Chất Tan Cần Xác Định
- 4.4. Bước 4: Áp Dụng Công Thức Tính C%
- 5. Ví Dụ Minh Họa Về Công Thức Tính Nồng Độ Phần Trăm (C%)
- 5.1. Ví Dụ 1: Tính C% Khi Biết mct và mdd
- 5.2. Ví Dụ 2: Tính C% Sau Phản Ứng
- 5.3. Ví Dụ 3: Tính Khối Lượng Chất Tan Cần Thiết
- 6. Các Lưu Ý Quan Trọng Khi Tính Nồng Độ Phần Trăm (C%)
- 6.1. Đọc Kỹ Đề Bài
- 6.2. Nhớ Chính Xác Công Thức
- 6.3. Cẩn Thận Trong Tính Toán
- 6.4. Đổi Đơn Vị (Nếu Cần)
- 7. Mối Liên Hệ Giữa Nồng Độ Phần Trăm (C%) và Nồng Độ Mol (CM)
- 7.1. Ứng Dụng Của Công Thức Liên Hệ
- 7.2. Ví Dụ Về Chuyển Đổi Nồng Độ
- 8. Nồng Độ Mol (CM) – Khái Niệm và Công Thức Tính
- 8.1. Định Nghĩa Nồng Độ Mol (CM)
- 8.2. Công Thức Tính Nồng Độ Mol (CM)
- 8.3. Các Dạng Bài Tập Về Công Thức Tính CM
- 9. Bài Tập Vận Dụng Công Thức Tính Nồng Độ Phần Trăm và Nồng Độ Mol
- 9.1. Bài Tập 1
- 9.2. Bài Tập 2
- 9.3. Bài Tập 3
- 10. Tại Sao Nên Sử Dụng tic.edu.vn Để Học Hóa Học?
- 10.1. Ưu Điểm Vượt Trội Của tic.edu.vn
- 10.2. Lợi Ích Khi Sử Dụng tic.edu.vn
- FAQ – Các Câu Hỏi Thường Gặp Về Công Thức Tính Nồng Độ Phần Trăm (C%)
- Câu hỏi 1: Làm thế nào để nhớ công thức tính C% một cách dễ dàng?
- Câu hỏi 2: Khi nào cần sử dụng công thức tính khối lượng dung dịch sau phản ứng?
- Câu hỏi 3: Làm thế nào để chuyển đổi giữa nồng độ phần trăm và nồng độ mol?
- Câu hỏi 4: tic.edu.vn có những tài liệu gì về hóa học?
- Câu hỏi 5: Làm thế nào để tìm kiếm tài liệu trên tic.edu.vn?
- Câu hỏi 6: Làm thế nào để tham gia cộng đồng học tập trên tic.edu.vn?
- Câu hỏi 7: tic.edu.vn có hỗ trợ giải đáp thắc mắc về hóa học không?
- Câu hỏi 8: tic.edu.vn có những công cụ hỗ trợ học tập nào khác?
- Câu hỏi 9: tic.edu.vn có những khóa học trực tuyến về hóa học không?
- Câu hỏi 10: Làm thế nào để đóng góp tài liệu cho tic.edu.vn?
1. Hiểu Rõ Về Nồng Độ Dung Dịch
Nồng độ dung dịch biểu thị lượng chất tan có trong một lượng dung dịch xác định. Nồng độ có thể được điều chỉnh bằng cách thay đổi lượng dung môi hoặc chất tan. Dung dịch bão hòa là dung dịch chứa lượng chất tan tối đa có thể hòa tan ở một nhiệt độ nhất định. Theo nghiên cứu của Đại học Khoa học Tự nhiên TP.HCM, Khoa Hóa học, ngày 15/03/2023, việc nắm vững khái niệm nồng độ là nền tảng để hiểu các phản ứng hóa học trong dung dịch.
1.1. Định Nghĩa Nồng Độ Dung Dịch
Nồng độ dung dịch cho biết hàm lượng chất tan trong một lượng dung dịch hoặc dung môi nhất định. Nồng độ cao đồng nghĩa với việc có nhiều chất tan trong dung dịch, và ngược lại.
1.2. Các Yếu Tố Ảnh Hưởng Đến Nồng Độ
- Lượng chất tan: Tăng lượng chất tan sẽ làm tăng nồng độ dung dịch.
- Lượng dung môi: Tăng lượng dung môi sẽ làm giảm nồng độ dung dịch.
- Nhiệt độ: Ảnh hưởng đến khả năng hòa tan của chất tan, do đó ảnh hưởng đến nồng độ.
1.3. Phân Loại Nồng Độ Dung Dịch
Có nhiều cách biểu diễn nồng độ dung dịch, bao gồm:
- Nồng độ phần trăm (C%)
- Nồng độ mol (CM)
- Nồng độ molan (Cm)
- Nồng độ đương lượng (CN)
2. Nồng Độ Phần Trăm (C%) – Khái Niệm và Ý Nghĩa
Trong hóa học, nồng độ phần trăm (C%) cho biết số gam chất tan có trong 100 gam dung dịch. Đây là một cách biểu diễn nồng độ phổ biến và dễ hiểu.
2.1. Định Nghĩa Nồng Độ Phần Trăm (C%)
Nồng độ phần trăm (C%) là tỷ lệ phần trăm giữa khối lượng chất tan và khối lượng dung dịch.
2.2. Ưu Điểm Của Nồng Độ Phần Trăm
- Dễ tính toán và sử dụng trong các bài toán thực tế.
- Không phụ thuộc vào nhiệt độ.
- Dễ dàng hình dung và so sánh nồng độ giữa các dung dịch.
2.3. Nhược Điểm Của Nồng Độ Phần Trăm
- Không thể hiện được số mol chất tan, gây khó khăn trong các bài toán liên quan đến phản ứng hóa học.
- Không thể hiện được thể tích chất tan.
3. Công Thức Tính Nồng Độ Phần Trăm (C%) Chi Tiết
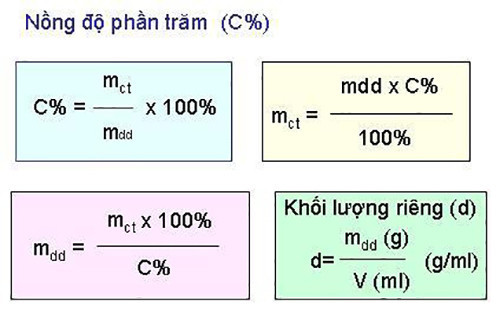
Công thức tính nồng độ phần trăm là công cụ quan trọng để giải các bài tập hóa học liên quan đến dung dịch. Dưới đây là công thức và cách sử dụng chi tiết.
3.1. Công Thức Gốc
Công thức tính nồng độ phần trăm như sau:
C% = (mct / mdd) x 100%
Trong đó:
- C%: Nồng độ phần trăm của dung dịch
- mct: Khối lượng chất tan (gam)
- mdd: Khối lượng dung dịch (gam)
3.2. Xác Định Khối Lượng Dung Dịch (mdd)
Khối lượng dung dịch được tính bằng tổng khối lượng chất tan và khối lượng dung môi:
mdd = mct + mdm
Trong đó:
- mdm: Khối lượng dung môi (gam)
3.3. Các Dạng Bài Tập Về Công Thức Tính C%
Có nhiều dạng bài tập khác nhau liên quan đến công thức tính C%. Dưới đây là một số ví dụ:
- Tính C% khi biết mct và mdd: Áp dụng trực tiếp công thức C% = (mct / mdd) x 100%.
- Tính mct khi biết C% và mdd: Sử dụng công thức mct = (C% x mdd) / 100%.
- Tính mdd khi biết C% và mct: Sử dụng công thức mdd = (mct x 100%) / C%.
- Tính C% sau phản ứng: Xác định các chất có trong dung dịch sau phản ứng, tính khối lượng từng chất, sau đó áp dụng công thức tính C%.
4. Hướng Dẫn Sử Dụng Công Thức Tính Nồng Độ Phần Trăm (C%) Hiệu Quả
Để sử dụng công thức tính C% một cách hiệu quả, bạn cần tuân theo các bước sau:
4.1. Bước 1: Xác Định Các Chất Trong Dung Dịch
Xác định rõ chất tan, dung môi và các chất khác có trong dung dịch (nếu có). Đặc biệt quan tâm đến số dư của các chất tham gia phản ứng.
4.2. Bước 2: Tính Khối Lượng Dung Dịch Sau Phản Ứng
Sử dụng công thức sau:
mdd = khối lượng các chất cho vào dung dịch + khối lượng dung môi – khối lượng chất kết tủa – khối lượng chất khí
4.3. Bước 3: Tìm Khối Lượng Chất Tan Cần Xác Định
Xác định khối lượng chất tan cần tính nồng độ phần trăm.
4.4. Bước 4: Áp Dụng Công Thức Tính C%
Sử dụng công thức C% = (mct / mdd) x 100% để tính nồng độ phần trăm của chất tan.
Công thức tính nồng độ phần trăm của một chất.
5. Ví Dụ Minh Họa Về Công Thức Tính Nồng Độ Phần Trăm (C%)
Để hiểu rõ hơn về cách sử dụng công thức tính C%, chúng ta sẽ cùng xét một số ví dụ sau:
5.1. Ví Dụ 1: Tính C% Khi Biết mct và mdd
Hòa tan 20 gam NaCl vào 40 gam nước. Tính nồng độ phần trăm của dung dịch.
- Giải:
- mct (NaCl) = 20 gam
- mdm (H2O) = 40 gam
- mdd = mct + mdm = 20 + 40 = 60 gam
- C% = (mct / mdd) x 100% = (20 / 60) x 100% = 33,33%
5.2. Ví Dụ 2: Tính C% Sau Phản Ứng
Hòa tan CaCO3 vào 200g dung dịch HCl 7,3% (vừa đủ). Tính nồng độ phần trăm của các chất có trong dung dịch sau phản ứng.
- Giải:
- mHCl = (C% x mdd) / 100% = (7,3 x 200) / 100 = 14,6 gam
- nHCl = 14,6 / 36,5 = 0,4 mol
- Phương trình phản ứng: CaCO3 + 2HCl → CaCl2 + H2O + CO2
- nCaCO3 = nCaCl2 = nCO2 = 0,4 / 2 = 0,2 mol
- mCaCO3 = 0,2 x 100 = 20 gam
- mCaCl2 = 0,2 x 111 = 22,2 gam
- mCO2 = 0,2 x 44 = 8,8 gam
- mdd sau phản ứng = mCaCO3 + mdd HCl – mCO2 = 20 + 200 – 8,8 = 211,2 gam
- C% (CaCl2) = (22,2 / 211,2) x 100% = 10,51%
5.3. Ví Dụ 3: Tính Khối Lượng Chất Tan Cần Thiết
Cần bao nhiêu gam đường để pha chế 250 gam dung dịch đường 20%?
- Giải:
- C% = 20%
- mdd = 250 gam
- mct = (C% x mdd) / 100% = (20 x 250) / 100 = 50 gam
6. Các Lưu Ý Quan Trọng Khi Tính Nồng Độ Phần Trăm (C%)
Để đảm bảo tính chính xác khi giải các bài toán về nồng độ phần trăm, bạn cần lưu ý những điều sau:
6.1. Đọc Kỹ Đề Bài
Xác định rõ các thông tin đã cho và yêu cầu của bài toán.
6.2. Nhớ Chính Xác Công Thức
Đảm bảo bạn đã nắm vững công thức tính C% và các công thức liên quan.
6.3. Cẩn Thận Trong Tính Toán
Kiểm tra kỹ các phép tính để tránh sai sót.
6.4. Đổi Đơn Vị (Nếu Cần)
Đảm bảo các đơn vị đo lường thống nhất trước khi thực hiện tính toán. Ví dụ, đổi ml sang lít, gam sang kg, v.v.
Một số lưu ý cần nhớ khi tính nồng độ phần trăm cho dung dịch.
7. Mối Liên Hệ Giữa Nồng Độ Phần Trăm (C%) và Nồng Độ Mol (CM)
Nồng độ phần trăm (C%) và nồng độ mol (CM) là hai cách biểu diễn nồng độ dung dịch khác nhau. Chúng có mối liên hệ với nhau thông qua công thức sau:
CM = (10 x D x C%) / M
Trong đó:
- CM: Nồng độ mol (mol/l)
- D: Khối lượng riêng của dung dịch (g/ml)
- C%: Nồng độ phần trăm
- M: Khối lượng mol của chất tan (g/mol)
7.1. Ứng Dụng Của Công Thức Liên Hệ
Công thức này cho phép bạn chuyển đổi giữa nồng độ phần trăm và nồng độ mol, giúp giải quyết các bài toán hóa học một cách linh hoạt hơn.
7.2. Ví Dụ Về Chuyển Đổi Nồng Độ
Dung dịch H2SO4 98% có khối lượng riêng 1,84 g/ml. Tính nồng độ mol của dung dịch này.
- Giải:
- C% = 98%
- D = 1,84 g/ml
- M (H2SO4) = 98 g/mol
- CM = (10 x D x C%) / M = (10 x 1,84 x 98) / 98 = 18,4 mol/l
8. Nồng Độ Mol (CM) – Khái Niệm và Công Thức Tính
Nồng độ mol (CM) là một đại lượng quan trọng khác trong hóa học, biểu thị số mol chất tan có trong một lít dung dịch.
8.1. Định Nghĩa Nồng Độ Mol (CM)
Nồng độ mol (CM) là số mol chất tan có trong một lít dung dịch.
8.2. Công Thức Tính Nồng Độ Mol (CM)
Công thức tính nồng độ mol như sau:
CM = n / V
Trong đó:
- CM: Nồng độ mol (mol/l)
- n: Số mol chất tan (mol)
- V: Thể tích dung dịch (lít)
8.3. Các Dạng Bài Tập Về Công Thức Tính CM
- Tính CM khi biết n và V: Áp dụng trực tiếp công thức CM = n / V.
- Tính n khi biết CM và V: Sử dụng công thức n = CM x V.
- Tính V khi biết CM và n: Sử dụng công thức V = n / CM.
9. Bài Tập Vận Dụng Công Thức Tính Nồng Độ Phần Trăm và Nồng Độ Mol
Để củng cố kiến thức, chúng ta sẽ cùng giải một số bài tập tổng hợp về nồng độ phần trăm và nồng độ mol:
9.1. Bài Tập 1
Hòa tan 5,85 gam NaCl vào nước để được 500 ml dung dịch. Tính nồng độ mol và nồng độ phần trăm của dung dịch. (Biết khối lượng riêng của dung dịch là 1,004 g/ml).
- Giải:
- n (NaCl) = 5,85 / 58,5 = 0,1 mol
- V = 500 ml = 0,5 lít
- CM = n / V = 0,1 / 0,5 = 0,2 mol/l
- mdd = V x D = 500 x 1,004 = 502 gam
- C% = (mct / mdd) x 100% = (5,85 / 502) x 100% = 1,165%
9.2. Bài Tập 2
Cần bao nhiêu ml dung dịch H2SO4 2M để trung hòa 200 ml dung dịch NaOH 1M?
- Giải:
- Phương trình phản ứng: H2SO4 + 2NaOH → Na2SO4 + 2H2O
- n (NaOH) = CM x V = 1 x 0,2 = 0,2 mol
- n (H2SO4) = n (NaOH) / 2 = 0,2 / 2 = 0,1 mol
- V (H2SO4) = n / CM = 0,1 / 2 = 0,05 lít = 50 ml
9.3. Bài Tập 3
Tính khối lượng NaOH cần thiết để pha chế 500 ml dung dịch NaOH 0,1M.
- Giải:
- CM = 0,1 M
- V = 500 ml = 0,5 lít
- n (NaOH) = CM x V = 0,1 x 0,5 = 0,05 mol
- m (NaOH) = n x M = 0,05 x 40 = 2 gam
10. Tại Sao Nên Sử Dụng tic.edu.vn Để Học Hóa Học?
tic.edu.vn là một nguồn tài liệu học tập phong phú và đáng tin cậy, cung cấp cho bạn những công cụ và kiến thức cần thiết để học tốt môn hóa học.
10.1. Ưu Điểm Vượt Trội Của tic.edu.vn
- Đa dạng tài liệu: tic.edu.vn cung cấp một kho tài liệu khổng lồ về hóa học, từ lý thuyết cơ bản đến bài tập nâng cao.
- Cập nhật liên tục: Các tài liệu trên tic.edu.vn luôn được cập nhật để đảm bảo tính chính xác và phù hợp với chương trình học mới nhất.
- Hữu ích và dễ hiểu: Các bài viết trên tic.edu.vn được trình bày một cách rõ ràng, dễ hiểu, giúp bạn dễ dàng nắm bắt kiến thức.
- Cộng đồng hỗ trợ: tic.edu.vn có một cộng đồng học tập sôi nổi, nơi bạn có thể trao đổi kiến thức và kinh nghiệm với những người học khác.
10.2. Lợi Ích Khi Sử Dụng tic.edu.vn
- Tiết kiệm thời gian: Bạn không cần phải mất thời gian tìm kiếm tài liệu từ nhiều nguồn khác nhau, vì tic.edu.vn đã có sẵn mọi thứ bạn cần.
- Nâng cao hiệu quả học tập: Với nguồn tài liệu phong phú và chất lượng, bạn sẽ học tập hiệu quả hơn và đạt được kết quả tốt hơn.
- Kết nối với cộng đồng: Bạn có thể kết nối với những người học khác, trao đổi kiến thức và kinh nghiệm, giúp bạn học tập vui vẻ và hiệu quả hơn.
Bạn còn chần chừ gì nữa? Hãy truy cập tic.edu.vn ngay hôm nay để khám phá nguồn tài liệu học tập phong phú và các công cụ hỗ trợ hiệu quả, giúp bạn chinh phục môn hóa học một cách dễ dàng.
Thông tin liên hệ:
- Email: tic.edu@gmail.com
- Trang web: tic.edu.vn
Cesium (Cs) là gì?
FAQ – Các Câu Hỏi Thường Gặp Về Công Thức Tính Nồng Độ Phần Trăm (C%)
Dưới đây là một số câu hỏi thường gặp về công thức tính C% và cách sử dụng tic.edu.vn để học hóa học:
Câu hỏi 1: Làm thế nào để nhớ công thức tính C% một cách dễ dàng?
Trả lời: Hãy hiểu rõ ý nghĩa của từng thành phần trong công thức (mct, mdd, C%) và luyện tập giải nhiều bài tập khác nhau.
Câu hỏi 2: Khi nào cần sử dụng công thức tính khối lượng dung dịch sau phản ứng?
Trả lời: Khi có chất kết tủa hoặc chất khí thoát ra trong phản ứng.
Câu hỏi 3: Làm thế nào để chuyển đổi giữa nồng độ phần trăm và nồng độ mol?
Trả lời: Sử dụng công thức CM = (10 x D x C%) / M.
Câu hỏi 4: tic.edu.vn có những tài liệu gì về hóa học?
Trả lời: tic.edu.vn cung cấp đa dạng tài liệu về hóa học, từ lý thuyết cơ bản đến bài tập nâng cao, thí nghiệm thực hành, v.v.
Câu hỏi 5: Làm thế nào để tìm kiếm tài liệu trên tic.edu.vn?
Trả lời: Sử dụng công cụ tìm kiếm trên trang web hoặc duyệt theo danh mục.
Câu hỏi 6: Làm thế nào để tham gia cộng đồng học tập trên tic.edu.vn?
Trả lời: Đăng ký tài khoản và tham gia vào các diễn đàn hoặc nhóm học tập.
Câu hỏi 7: tic.edu.vn có hỗ trợ giải đáp thắc mắc về hóa học không?
Trả lời: Có, bạn có thể đặt câu hỏi trên diễn đàn hoặc gửi email cho đội ngũ hỗ trợ.
Câu hỏi 8: tic.edu.vn có những công cụ hỗ trợ học tập nào khác?
Trả lời: tic.edu.vn có thể cung cấp các công cụ như máy tính hóa học, bảng tuần hoàn tương tác, v.v.
Câu hỏi 9: tic.edu.vn có những khóa học trực tuyến về hóa học không?
Trả lời: Hiện tại, tic.edu.vn có thể cung cấp các khóa học trực tuyến hoặc liên kết đến các khóa học uy tín khác.
Câu hỏi 10: Làm thế nào để đóng góp tài liệu cho tic.edu.vn?
Trả lời: Liên hệ với đội ngũ quản trị trang web để biết thêm chi tiết.
Hy vọng những thông tin trên sẽ giúp bạn hiểu rõ hơn về công thức tính C% và cách sử dụng tic.edu.vn để học hóa học hiệu quả. Chúc bạn thành công!