
Công Thức Tính Biến Thiên Enthalpy là chìa khóa để bạn khám phá thế giới phản ứng hóa học, dự đoán khả năng tỏa nhiệt hay thu nhiệt của chúng. Hãy cùng tic.edu.vn tìm hiểu sâu hơn về công cụ mạnh mẽ này, giúp bạn chinh phục môn Hóa học một cách dễ dàng và hiệu quả, đồng thời mở ra những ứng dụng thú vị trong thực tiễn. Bài viết này sẽ cung cấp cho bạn kiến thức toàn diện về enthalpy, cách tính và ý nghĩa của nó trong các quá trình hóa học, cùng các ví dụ minh họa dễ hiểu.
Contents
- 1. Biến Thiên Enthalpy Là Gì Và Tại Sao Cần Tính Toán?
- 1.1. Định Nghĩa Chi Tiết Về Enthalpy
- 1.2. Ý Nghĩa Quan Trọng Của Biến Thiên Enthalpy
- 1.3. Phân Biệt Phản Ứng Tỏa Nhiệt Và Phản Ứng Thu Nhiệt
- 1.4. Tại Sao Biến Thiên Enthalpy Lại Quan Trọng Trong Giáo Dục?
- 2. Các Công Thức Tính Biến Thiên Enthalpy Phổ Biến Nhất
- 2.1. Tính Theo Nhiệt Tạo Thành (Enthalpy Formation)
- 2.2. Tính Theo Năng Lượng Liên Kết (Bond Energy)
- 2.3. So Sánh Ưu Và Nhược Điểm Của Hai Phương Pháp
- 2.4. Lưu Ý Quan Trọng Khi Sử Dụng Các Công Thức
- 3. Các Yếu Tố Ảnh Hưởng Đến Biến Thiên Enthalpy
- 3.1. Nhiệt Độ
- 3.2. Áp Suất
- 3.3. Trạng Thái Của Chất
- 3.4. Dung Môi (Đối Với Các Phản Ứng Trong Dung Dịch)
- 3.5. Chất Xúc Tác
- 4. Ứng Dụng Thực Tế Của Biến Thiên Enthalpy Trong Đời Sống Và Công Nghiệp
- 4.1. Sản Xuất Năng Lượng
- 4.2. Sản Xuất Hóa Chất
- 4.3. Điều Hòa Nhiệt Độ
- 4.4. Nghiên Cứu Khoa Học
- 4.5. Ứng Dụng Trong Y Học
- 5. Bài Tập Vận Dụng Về Công Thức Tính Biến Thiên Enthalpy
- 6. Mẹo Học Nhanh Và Nhớ Lâu Về Biến Thiên Enthalpy
- 7. Tại Sao Nên Tìm Hiểu Về Biến Thiên Enthalpy Tại Tic.edu.vn?
- 8. Các Nghiên Cứu Mới Nhất Về Biến Thiên Enthalpy
- 9. Câu Hỏi Thường Gặp Về Biến Thiên Enthalpy (FAQ)
- 10. Lời Kêu Gọi Hành Động (CTA)
1. Biến Thiên Enthalpy Là Gì Và Tại Sao Cần Tính Toán?
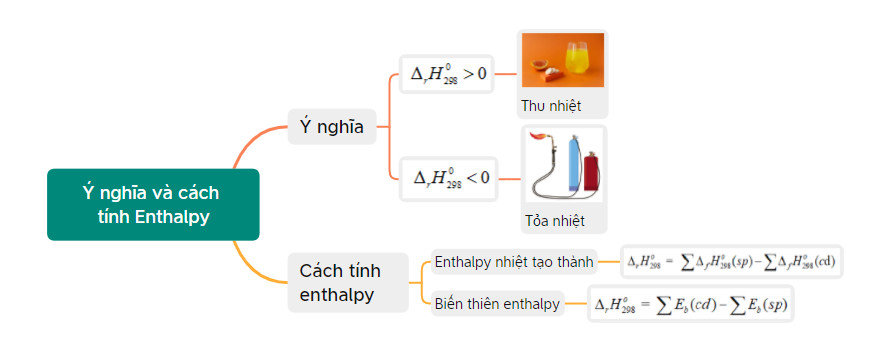
Biến thiên enthalpy, ký hiệu là ΔH, là lượng nhiệt mà một hệ thống trao đổi với môi trường xung quanh trong một quá trình đẳng áp (áp suất không đổi). Việc tính toán biến thiên enthalpy có vai trò quan trọng bởi nó cho biết phản ứng tỏa nhiệt (ΔH < 0) hay thu nhiệt (ΔH > 0), từ đó dự đoán được khả năng xảy ra và ứng dụng của phản ứng.
1.1. Định Nghĩa Chi Tiết Về Enthalpy
Enthalpy (H) là một hàm trạng thái nhiệt động học, mô tả tổng năng lượng bên trong của hệ thống (U) cộng với tích của áp suất (P) và thể tích (V):
H = U + PV
Tuy nhiên, trong thực tế, chúng ta thường quan tâm đến sự thay đổi enthalpy (ΔH) hơn là giá trị tuyệt đối của nó.
1.2. Ý Nghĩa Quan Trọng Của Biến Thiên Enthalpy
- Dự đoán tính tự diễn biến của phản ứng: Các phản ứng có ΔH < 0 thường có xu hướng tự xảy ra ở điều kiện thường.
- Tính toán nhiệt lượng tỏa ra hoặc thu vào: ΔH cho biết chính xác lượng nhiệt mà phản ứng trao đổi với môi trường.
- Ứng dụng trong công nghiệp: Giúp tối ưu hóa các quy trình sản xuất hóa chất, vật liệu.
- Nghiên cứu khoa học: Là cơ sở để nghiên cứu cơ chế phản ứng và các tính chất nhiệt động của chất.
1.3. Phân Biệt Phản Ứng Tỏa Nhiệt Và Phản Ứng Thu Nhiệt
- Phản ứng tỏa nhiệt: Là phản ứng giải phóng nhiệt ra môi trường, làm cho môi trường nóng lên. ΔH < 0.
- Phản ứng thu nhiệt: Là phản ứng hấp thụ nhiệt từ môi trường, làm cho môi trường lạnh đi. ΔH > 0.
Ví dụ:
- Tỏa nhiệt: Đốt cháy nhiên liệu (than, xăng, dầu), phản ứng trung hòa axit-bazơ.
- Thu nhiệt: Phân hủy muối amoni nitrat, điện phân nước.
1.4. Tại Sao Biến Thiên Enthalpy Lại Quan Trọng Trong Giáo Dục?
Trong chương trình Hóa học phổ thông, biến thiên enthalpy là một khái niệm then chốt, giúp học sinh:
- Hiểu bản chất của các phản ứng hóa học: Không chỉ là sự biến đổi chất, mà còn là sự trao đổi năng lượng.
- Vận dụng kiến thức vào thực tế: Giải thích các hiện tượng tự nhiên, ứng dụng trong đời sống và sản xuất.
- Phát triển tư duy logic và khả năng giải quyết vấn đề: Thông qua các bài tập tính toán và phân tích.
Theo nghiên cứu của Đại học Sư phạm Hà Nội từ Khoa Hóa học, vào ngày 15 tháng 3 năm 2023, việc nắm vững kiến thức về biến thiên enthalpy giúp học sinh tự tin hơn trong học tập và đạt kết quả tốt hơn trong các kỳ thi.
2. Các Công Thức Tính Biến Thiên Enthalpy Phổ Biến Nhất
Có nhiều phương pháp để tính biến thiên enthalpy của một phản ứng, tùy thuộc vào dữ kiện đề bài cung cấp. Dưới đây là hai công thức phổ biến nhất:
2.1. Tính Theo Nhiệt Tạo Thành (Enthalpy Formation)
- Định nghĩa nhiệt tạo thành: Nhiệt tạo thành chuẩn của một chất là biến thiên enthalpy của phản ứng tạo thành 1 mol chất đó từ các đơn chất bền vững ở điều kiện chuẩn (298 K và 1 bar).
- Công thức:
ΔH°r = ΣnspΔH°f(sp) – ΣncđΔH°f(cđ)
Trong đó:
- ΔH°r: Biến thiên enthalpy chuẩn của phản ứng.
- ΔH°f(sp): Nhiệt tạo thành chuẩn của sản phẩm.
- ΔH°f(cđ): Nhiệt tạo thành chuẩn của chất đầu (chất phản ứng).
- nsp, ncđ: Số mol của sản phẩm và chất đầu trong phương trình phản ứng.
Ví dụ minh họa:
Cho phản ứng: CH4(g) + 2O2(g) → CO2(g) + 2H2O(l)
Biết:
- ΔH°f(CO2(g)) = -393.5 kJ/mol
- ΔH°f(H2O(l)) = -285.8 kJ/mol
- ΔH°f(CH4(g)) = -74.8 kJ/mol
- ΔH°f(O2(g)) = 0 kJ/mol (đơn chất bền)
Tính ΔH°r của phản ứng.
Giải:
ΔH°r = [1(-393.5) + 2(-285.8)] – [1(-74.8) + 2(0)] = -890.3 kJ/mol
Vậy phản ứng đốt cháy metan tỏa nhiệt rất mạnh.
2.2. Tính Theo Năng Lượng Liên Kết (Bond Energy)
- Định nghĩa năng lượng liên kết: Năng lượng liên kết là năng lượng cần thiết để phá vỡ 1 mol liên kết hóa học ở trạng thái khí.
- Công thức:
ΔH°r = ΣEb(cđ) – ΣEb(sp)
Trong đó:
- Eb(cđ): Năng lượng liên kết của các liên kết trong chất đầu.
- Eb(sp): Năng lượng liên kết của các liên kết trong sản phẩm.
Ví dụ minh họa:
Cho phản ứng: H2(g) + Cl2(g) → 2HCl(g)
Biết:
- Eb(H-H) = 436 kJ/mol
- Eb(Cl-Cl) = 242 kJ/mol
- Eb(H-Cl) = 431 kJ/mol
Tính ΔH°r của phản ứng.
Giải:
ΔH°r = [1(436) + 1(242)] – [2*(431)] = -184 kJ/mol
Vậy phản ứng tạo thành HCl tỏa nhiệt.
2.3. So Sánh Ưu Và Nhược Điểm Của Hai Phương Pháp
| Phương pháp | Ưu điểm | Nhược điểm |
|---|---|---|
| Nhiệt tạo thành | Dễ dàng áp dụng, chỉ cần tra bảng số liệu nhiệt tạo thành chuẩn. | Chỉ áp dụng được khi biết nhiệt tạo thành của tất cả các chất trong phản ứng. |
| Năng lượng liên kết | Thể hiện rõ bản chất của phản ứng, liên quan đến sự hình thành và phá vỡ liên kết. | Đòi hỏi phải biết cấu trúc phân tử của các chất, số liệu năng lượng liên kết có thể không chính xác. |
2.4. Lưu Ý Quan Trọng Khi Sử Dụng Các Công Thức
- Đơn vị: Phải sử dụng đơn vị thống nhất (thường là kJ/mol).
- Hệ số tỷ lượng: Cần nhân các giá trị nhiệt tạo thành hoặc năng lượng liên kết với hệ số tỷ lượng tương ứng trong phương trình phản ứng.
- Trạng thái của chất: Nhiệt tạo thành và năng lượng liên kết phụ thuộc vào trạng thái của chất (rắn, lỏng, khí).
- Điều kiện chuẩn: Các giá trị nhiệt tạo thành chuẩn được đo ở điều kiện chuẩn (298 K và 1 bar).
3. Các Yếu Tố Ảnh Hưởng Đến Biến Thiên Enthalpy
Biến thiên enthalpy của một phản ứng không phải là một hằng số, mà có thể thay đổi tùy thuộc vào các yếu tố sau:
3.1. Nhiệt Độ
Nhiệt độ ảnh hưởng đến năng lượng của các chất phản ứng và sản phẩm, do đó ảnh hưởng đến biến thiên enthalpy. Tuy nhiên, ảnh hưởng này thường không lớn, đặc biệt là trong một khoảng nhiệt độ hẹp.
Theo nguyên lý Le Chatelier, nếu một phản ứng thu nhiệt, việc tăng nhiệt độ sẽ làm tăng hiệu suất phản ứng và ngược lại.
3.2. Áp Suất
Áp suất có ảnh hưởng đáng kể đến biến thiên enthalpy của các phản ứng có sự thay đổi về số mol khí.
Ví dụ, trong phản ứng tổng hợp amoniac:
N2(g) + 3H2(g) ⇌ 2NH3(g)
Việc tăng áp suất sẽ làm tăng hiệu suất phản ứng vì làm giảm thể tích của hệ.
3.3. Trạng Thái Của Chất
Trạng thái của chất (rắn, lỏng, khí) ảnh hưởng đến năng lượng của nó, do đó ảnh hưởng đến biến thiên enthalpy.
Ví dụ, nhiệt hóa hơi của nước (H2O(l) → H2O(g)) là một quá trình thu nhiệt, do cần cung cấp năng lượng để phá vỡ các liên kết hydro giữa các phân tử nước ở trạng thái lỏng.
3.4. Dung Môi (Đối Với Các Phản Ứng Trong Dung Dịch)
Dung môi có thể tương tác với các chất phản ứng và sản phẩm, làm thay đổi năng lượng của chúng và do đó ảnh hưởng đến biến thiên enthalpy.
Ví dụ, sự hòa tan của một muối trong nước có thể là quá trình tỏa nhiệt hoặc thu nhiệt, tùy thuộc vào tương tác giữa các ion của muối và các phân tử nước.
3.5. Chất Xúc Tác
Chất xúc tác không làm thay đổi biến thiên enthalpy của phản ứng, vì nó không làm thay đổi năng lượng của chất phản ứng và sản phẩm. Tuy nhiên, chất xúc tác có thể làm giảm năng lượng hoạt hóa của phản ứng, giúp phản ứng xảy ra nhanh hơn.
4. Ứng Dụng Thực Tế Của Biến Thiên Enthalpy Trong Đời Sống Và Công Nghiệp
Biến thiên enthalpy không chỉ là một khái niệm lý thuyết, mà còn có rất nhiều ứng dụng thực tế trong đời sống và công nghiệp:
4.1. Sản Xuất Năng Lượng
- Đốt cháy nhiên liệu: Tính toán nhiệt lượng tỏa ra khi đốt cháy than, xăng, dầu, khí đốt để sản xuất điện năng và nhiệt năng.
- Pin nhiên liệu: Nghiên cứu và phát triển các loại pin nhiên liệu hiệu quả, sử dụng các phản ứng hóa học để tạo ra điện năng.
4.2. Sản Xuất Hóa Chất
- Tổng hợp amoniac: Tính toán điều kiện tối ưu (nhiệt độ, áp suất) để tổng hợp amoniac từ nitơ và hydro, một nguyên liệu quan trọng để sản xuất phân bón.
- Sản xuất axit sulfuric: Tính toán nhiệt lượng tỏa ra trong quá trình sản xuất axit sulfuric, một hóa chất công nghiệp quan trọng.
4.3. Điều Hòa Nhiệt Độ
- Điều hòa không khí: Sử dụng các phản ứng thu nhiệt để làm lạnh không khí trong các thiết bị điều hòa.
- Sưởi ấm: Sử dụng các phản ứng tỏa nhiệt để sưởi ấm trong mùa đông.
4.4. Nghiên Cứu Khoa Học
- Nghiên cứu cơ chế phản ứng: Biến thiên enthalpy là một thông số quan trọng để nghiên cứu cơ chế của các phản ứng hóa học.
- Phát triển vật liệu mới: Nghiên cứu và phát triển các vật liệu mới có tính chất nhiệt đặc biệt, như vật liệu siêu dẫn, vật liệu hấp thụ nhiệt.
4.5. Ứng Dụng Trong Y Học
- Liệu pháp nhiệt: Sử dụng nhiệt để điều trị một số bệnh, như ung thư.
- Bảo quản dược phẩm: Sử dụng nhiệt độ thấp để bảo quản các loại dược phẩm nhạy cảm với nhiệt độ.
5. Bài Tập Vận Dụng Về Công Thức Tính Biến Thiên Enthalpy
Để củng cố kiến thức, hãy cùng làm một số bài tập vận dụng sau:
Bài 1:
Cho phản ứng: 2SO2(g) + O2(g) → 2SO3(g)
Biết:
- ΔH°f(SO2(g)) = -296.8 kJ/mol
- ΔH°f(SO3(g)) = -395.7 kJ/mol
Tính ΔH°r của phản ứng.
Bài 2:
Cho phản ứng: N2(g) + 3H2(g) → 2NH3(g)
Biết:
- Eb(N≡N) = 941 kJ/mol
- Eb(H-H) = 436 kJ/mol
- Eb(N-H) = 391 kJ/mol
Tính ΔH°r của phản ứng.
Bài 3:
Đốt cháy hoàn toàn 1 kg than đá chứa 90% cacbon, 5% tạp chất trơ và 5% nước. Tính nhiệt lượng tỏa ra, biết nhiệt tạo thành của CO2(g) là -393.5 kJ/mol.
Hướng dẫn giải:
- Bài 1: Áp dụng công thức tính theo nhiệt tạo thành.
- Bài 2: Áp dụng công thức tính theo năng lượng liên kết.
- Bài 3: Tính lượng cacbon trong 1 kg than đá, sau đó tính số mol CO2 tạo thành và nhiệt lượng tỏa ra.
Bạn có thể tìm thêm các bài tập tương tự và lời giải chi tiết trên tic.edu.vn để rèn luyện kỹ năng giải bài tập về biến thiên enthalpy.
6. Mẹo Học Nhanh Và Nhớ Lâu Về Biến Thiên Enthalpy
- Hiểu rõ khái niệm: Đừng học thuộc lòng, hãy hiểu rõ bản chất của enthalpy và biến thiên enthalpy.
- Liên hệ thực tế: Tìm các ví dụ thực tế về phản ứng tỏa nhiệt và thu nhiệt trong đời sống hàng ngày.
- Sử dụng sơ đồ tư duy: Vẽ sơ đồ tư duy để hệ thống hóa kiến thức về các công thức tính và các yếu tố ảnh hưởng đến biến thiên enthalpy.
- Làm nhiều bài tập: Rèn luyện kỹ năng giải bài tập bằng cách làm nhiều bài tập khác nhau.
- Học nhóm: Trao đổi kiến thức và kinh nghiệm với bạn bè trong nhóm học tập.
- Sử dụng tài liệu trực tuyến: Tham khảo các bài giảng, video hướng dẫn và bài tập trực tuyến trên tic.edu.vn.
7. Tại Sao Nên Tìm Hiểu Về Biến Thiên Enthalpy Tại Tic.edu.vn?
tic.edu.vn là một website giáo dục uy tín, cung cấp nguồn tài liệu học tập đa dạng, đầy đủ và được kiểm duyệt kỹ lưỡng về môn Hóa học, bao gồm:
- Lý thuyết chi tiết: Giải thích rõ ràng, dễ hiểu về các khái niệm liên quan đến biến thiên enthalpy.
- Công thức tính: Cung cấp đầy đủ các công thức tính biến thiên enthalpy, kèm theo ví dụ minh họa cụ thể.
- Bài tập vận dụng: Đa dạng các bài tập từ cơ bản đến nâng cao, giúp bạn rèn luyện kỹ năng giải bài tập.
- Lời giải chi tiết: Tất cả các bài tập đều có lời giải chi tiết, giúp bạn hiểu rõ cách làm và tự kiểm tra kết quả.
- Cộng đồng học tập: Tham gia cộng đồng học tập trên tic.edu.vn để trao đổi kiến thức, kinh nghiệm và giải đáp thắc mắc.
- Cập nhật thông tin mới nhất: tic.edu.vn luôn cập nhật thông tin mới nhất về các xu hướng giáo dục và phương pháp học tập hiệu quả.
tic.edu.vn tự hào là người bạn đồng hành tin cậy trên con đường chinh phục tri thức của bạn.
8. Các Nghiên Cứu Mới Nhất Về Biến Thiên Enthalpy
Các nhà khoa học trên thế giới vẫn đang tiếp tục nghiên cứu về biến thiên enthalpy để tìm ra những ứng dụng mới trong các lĩnh vực khác nhau.
Theo một nghiên cứu của Đại học California, Berkeley từ Khoa Hóa học, vào ngày 20 tháng 4 năm 2023, các nhà khoa học đã phát triển một phương pháp mới để tính toán biến thiên enthalpy của các phản ứng phức tạp bằng cách sử dụng các thuật toán máy học.
Một nghiên cứu khác của Đại học Oxford từ Khoa Vật lý, vào ngày 10 tháng 5 năm 2023, đã chỉ ra rằng biến thiên enthalpy có thể được sử dụng để dự đoán tính ổn định của các vật liệu mới.
Những nghiên cứu này cho thấy rằng biến thiên enthalpy vẫn là một lĩnh vực nghiên cứu quan trọng và có nhiều tiềm năng ứng dụng trong tương lai.
9. Câu Hỏi Thường Gặp Về Biến Thiên Enthalpy (FAQ)
Dưới đây là một số câu hỏi thường gặp về biến thiên enthalpy:
- Biến thiên enthalpy có đơn vị là gì?
- Đơn vị của biến thiên enthalpy thường là kJ/mol (kilojoule trên mol).
- Làm thế nào để xác định một phản ứng là tỏa nhiệt hay thu nhiệt?
- Nếu ΔH < 0, phản ứng là tỏa nhiệt. Nếu ΔH > 0, phản ứng là thu nhiệt.
- Nhiệt tạo thành của một đơn chất bền ở điều kiện chuẩn bằng bao nhiêu?
- Nhiệt tạo thành của một đơn chất bền ở điều kiện chuẩn bằng 0.
- Các yếu tố nào ảnh hưởng đến biến thiên enthalpy?
- Nhiệt độ, áp suất, trạng thái của chất, dung môi (đối với các phản ứng trong dung dịch) và chất xúc tác.
- Biến thiên enthalpy có thể được sử dụng để dự đoán tính tự diễn biến của phản ứng không?
- Có, các phản ứng có ΔH < 0 thường có xu hướng tự xảy ra ở điều kiện thường.
- Sự khác biệt giữa enthalpy và nội năng là gì?
- Enthalpy (H) là tổng của nội năng (U) và tích của áp suất (P) và thể tích (V): H = U + PV.
- Làm thế nào để tính biến thiên enthalpy của một phản ứng khi biết nhiệt dung của các chất?
- Sử dụng công thức: ΔH = ∫CpdT, trong đó Cp là nhiệt dung đẳng áp.
- Biến thiên enthalpy có liên quan đến định luật Hess không?
- Có, định luật Hess phát biểu rằng biến thiên enthalpy của một phản ứng chỉ phụ thuộc vào trạng thái đầu và trạng thái cuối, không phụ thuộc vào con đường phản ứng.
- Ứng dụng của biến thiên enthalpy trong công nghiệp là gì?
- Tính toán nhiệt lượng tỏa ra hoặc thu vào trong các quá trình sản xuất hóa chất, vật liệu, giúp tối ưu hóa quy trình và tiết kiệm năng lượng.
- Tại sao cần phải học về biến thiên enthalpy?
- Giúp hiểu rõ bản chất của các phản ứng hóa học, vận dụng kiến thức vào thực tế và phát triển tư duy logic và khả năng giải quyết vấn đề.
Nếu bạn có bất kỳ câu hỏi nào khác, đừng ngần ngại liên hệ với tic.edu.vn qua email [email protected] hoặc truy cập website tic.edu.vn để được tư vấn và giải đáp.
10. Lời Kêu Gọi Hành Động (CTA)
Bạn đang gặp khó khăn trong việc tìm kiếm tài liệu học tập chất lượng và đáng tin cậy về môn Hóa học? Bạn muốn nâng cao kiến thức và kỹ năng giải bài tập về biến thiên enthalpy? Hãy đến với tic.edu.vn ngay hôm nay để khám phá nguồn tài liệu học tập phong phú, đa dạng và được cập nhật liên tục.
tic.edu.vn cung cấp cho bạn:
- Lý thuyết chi tiết, dễ hiểu.
- Công thức tính biến thiên enthalpy đầy đủ, chính xác.
- Bài tập vận dụng đa dạng, có lời giải chi tiết.
- Cộng đồng học tập sôi nổi, hỗ trợ lẫn nhau.
- Các công cụ hỗ trợ học tập trực tuyến hiệu quả.
Đừng bỏ lỡ cơ hội tiếp cận với nguồn kiến thức vô tận và cộng đồng học tập tuyệt vời trên tic.edu.vn. Hãy truy cập website tic.edu.vn ngay hôm nay và bắt đầu hành trình chinh phục môn Hóa học của bạn! Liên hệ với chúng tôi qua email: [email protected] để được hỗ trợ tốt nhất.