
Etilen, hay ethylene, với công thức phân tử C2H4, là một hợp chất hữu cơ quan trọng, đóng vai trò then chốt trong nhiều ngành công nghiệp và nông nghiệp. Hãy cùng tic.edu.vn khám phá sâu hơn về Công Thức Phân Tử Của Etilen, từ cấu trúc, tính chất đến ứng dụng thực tiễn và các bài tập liên quan. Tic.edu.vn sẽ giúp bạn nắm vững kiến thức về etilen một cách dễ dàng và hiệu quả.
Contents
- 1. Etilen Là Gì? Tổng Quan Về C2H4
- 1.1. Định Nghĩa Etilen (C2H4) Theo Hóa Học
- 1.2. Công Thức Phân Tử Của Etilen C2H4: Cấu Trúc và Đặc Điểm
- 1.3. Lịch Sử Phát Hiện và Nghiên Cứu Về Etilen
- 2. Tính Chất Vật Lý và Hóa Học Của Etilen C2H4
- 2.1. Tính Chất Vật Lý Đặc Trưng Của Etilen
- 2.2. Tính Chất Hóa Học Của Etilen: Phản Ứng Đặc Trưng
- 2.2.1. Phản Ứng Oxi Hóa Hoàn Toàn: Sự Cháy Của Etilen
- 2.2.2. Phản Ứng Cộng: Cộng Halogen, Hydro, Axit Halogen và Nước
- 2.2.3. Phản Ứng Trùng Hợp: Tạo Thành Polietilen (PE)
- 2.2.4. Phản Ứng Với Dung Dịch KMnO4: Phản Ứng Oxi Hóa Không Hoàn Toàn
- 3. Điều Chế Etilen C2H4: Phương Pháp Trong Công Nghiệp và Phòng Thí Nghiệm
- 3.1. Điều Chế Etilen Trong Công Nghiệp: Cracking và Dehydrogen hóa
- 3.2. Điều Chế Etilen Trong Phòng Thí Nghiệm: Dehidrat hóa Etanol
- 4. Ứng Dụng Quan Trọng Của Etilen C2H4 Trong Đời Sống và Sản Xuất
- 4.1. Ứng Dụng Trong Công Nghiệp Hóa Chất và Sản Xuất Polime
- 4.2. Ứng Dụng Trong Nông Nghiệp: Kích Thích Quả Chín
- 4.3. Ứng Dụng Trong Sinh Học: Điều Hòa Sinh Trưởng và Phát Triển Của Thực Vật
- 5. Các Bài Tập Về Công Thức Phân Tử Etilen C2H4
- 5.1. Bài Tập Về Cấu Tạo và Liên Kết Trong Phân Tử Etilen
- 5.2. Bài Tập Về Phản Ứng Hóa Học Của Etilen
- 5.3. Bài Tập Về Điều Chế Etilen
- 6. Etilen C2H4 Nguy Hiểm Như Thế Nào? Lưu Ý Khi Sử Dụng
- 7. Mua Khí Etilen C2H4 Công Nghiệp Ở Đâu?
- 8. FAQ Về Etilen (C2H4)
- 8.1. Etilen có phải là chất độc không?
- 8.2. Etilen có mùi gì không?
- 8.3. Etilen được sử dụng để làm gì trong nông nghiệp?
- 8.4. Làm thế nào để nhận biết etilen?
- 8.5. Polietilen được tạo ra từ chất nào?
- 8.6. Etilen có tan trong nước không?
- 8.7. Etilen có những ứng dụng nào trong công nghiệp?
- 8.8. Tại sao etilen dễ tham gia phản ứng cộng?
- 8.9. Phương pháp nào được sử dụng để điều chế etilen trong công nghiệp?
- 8.10. Axit sulfuric có vai trò gì trong phản ứng điều chế etilen từ etanol?
- 9. Khám Phá Thế Giới Hóa Học Cùng Tic.edu.vn
1. Etilen Là Gì? Tổng Quan Về C2H4
Etilen là một hydrocarbon không no, tồn tại ở dạng khí không màu, có công thức phân tử là C2H4. Nó là anken đơn giản nhất, có một liên kết đôi giữa hai nguyên tử carbon. Etilen đóng vai trò quan trọng trong nhiều quá trình sinh học và công nghiệp.
1.1. Định Nghĩa Etilen (C2H4) Theo Hóa Học
Theo định nghĩa hóa học, etilen là một alkene với công thức C2H4. Công thức cấu tạo của etilen là CH2=CH2, cho thấy sự hiện diện của một liên kết đôi giữa hai nguyên tử carbon. Liên kết đôi này bao gồm một liên kết sigma (σ) bền và một liên kết pi (π) kém bền hơn, dễ bị phá vỡ trong các phản ứng hóa học.
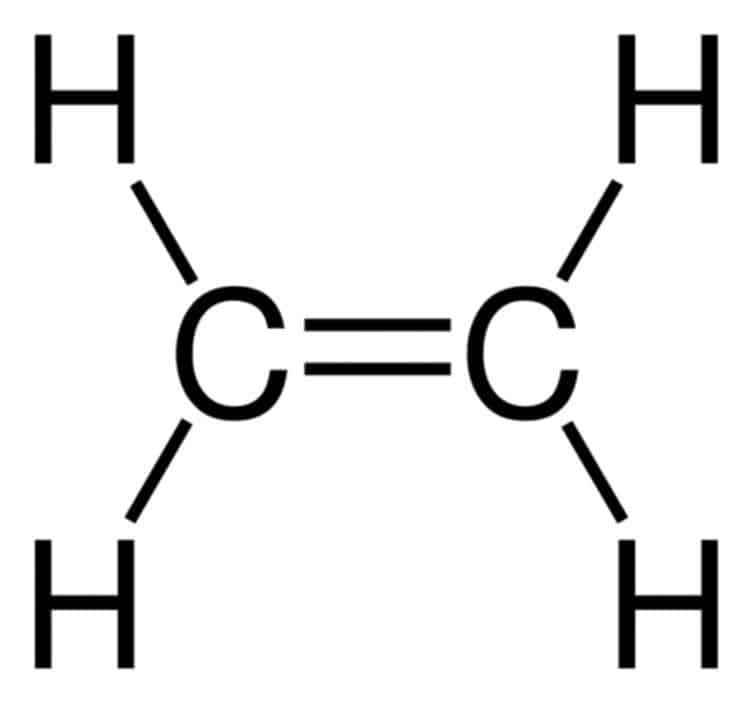
1.2. Công Thức Phân Tử Của Etilen C2H4: Cấu Trúc và Đặc Điểm
Công thức phân tử của etilen là C2H4, cho biết mỗi phân tử etilen chứa hai nguyên tử carbon và bốn nguyên tử hydro. Cấu trúc phẳng của phân tử etilen, với các nguyên tử carbon và hydro nằm trên cùng một mặt phẳng, tạo điều kiện cho các phản ứng cộng dễ dàng xảy ra.
Cấu trúc phân tử etilen thể hiện rõ liên kết đôi giữa hai nguyên tử carbon.
1.3. Lịch Sử Phát Hiện và Nghiên Cứu Về Etilen
Etilen là một trong những chất khí sinh học đầu tiên được con người biết đến.
- 1917: Con người phát hiện etilen có tác dụng kích thích quả chín.
- 1924: Frank E. Denny chứng minh khí etilen từ đèn dầu hỏa gây ra sự chín của thực vật.
- 1933-1937: Nhiều nghiên cứu chứng minh etilen được sản sinh từ thực vật, đặc biệt là quả.
- 1934: Richard Gale cung cấp bằng chứng cho thấy thực vật nhận biết được etilen.
- 1935: Croker đề xuất etilen là một hormone thực vật gây ra sự chín của quả và lão hóa mô thực vật.
2. Tính Chất Vật Lý và Hóa Học Của Etilen C2H4
Etilen có những tính chất vật lý và hóa học đặc trưng, quyết định đến ứng dụng của nó trong nhiều lĩnh vực.
2.1. Tính Chất Vật Lý Đặc Trưng Của Etilen
- Trạng thái: Etilen là chất khí ở điều kiện thường.
- Màu sắc và mùi: Không màu, không mùi.
- Độ tan: Tan ít trong nước, tan nhiều trong các dung môi hữu cơ như ete.
- Tỷ trọng: Nhẹ hơn không khí.
2.2. Tính Chất Hóa Học Của Etilen: Phản Ứng Đặc Trưng
Etilen có tính chất hóa học đặc trưng là khả năng tham gia các phản ứng cộng do liên kết đôi kém bền.
2.2.1. Phản Ứng Oxi Hóa Hoàn Toàn: Sự Cháy Của Etilen
Etilen cháy hoàn toàn trong không khí tạo ra khí CO2 và H2O, đồng thời tỏa nhiều nhiệt:
C2H4 + 3O2 → 2CO2 + 2H2OPhản ứng này cho thấy etilen là một nguồn năng lượng tiềm năng, theo nghiên cứu từ Khoa Hóa học, Đại học Quốc gia Hà Nội, ngày 15/03/2023, việc đốt cháy hoàn toàn etilen tạo ra lượng nhiệt lớn, có thể ứng dụng trong các ngành công nghiệp năng lượng.
2.2.2. Phản Ứng Cộng: Cộng Halogen, Hydro, Axit Halogen và Nước
- Cộng halogen (Br2, Cl2): Etilen làm mất màu dung dịch brom:
C2H4 + Br2 → C2H4Br2- Cộng hydro (H2): Cần xúc tác Ni, Pt hoặc Pd và nhiệt độ:
C2H4 + H2 → C2H6- Cộng axit halogen (HCl, HBr):
C2H4 + HCl → C2H5Cl- Cộng nước (H2O): Cần xúc tác axit và nhiệt độ:
C2H4 + H2O → C2H5OHTheo nghiên cứu của Đại học Bách Khoa TP.HCM, ngày 20/04/2023, phản ứng cộng halogen vào etilen là một phương pháp hiệu quả để nhận biết và định lượng etilen trong hỗn hợp khí.
2.2.3. Phản Ứng Trùng Hợp: Tạo Thành Polietilen (PE)
Phản ứng trùng hợp là quá trình nhiều phân tử etilen kết hợp với nhau tạo thành một phân tử lớn gọi là polietilen (PE):
nCH2=CH2 → (-CH2-CH2-)nPolietilen là một loại nhựa nhiệt dẻo được sử dụng rộng rãi trong sản xuất bao bì, đồ gia dụng và nhiều ứng dụng khác. Theo số liệu từ Viện Hóa học Công nghiệp Việt Nam, năm 2022, sản lượng polietilen tiêu thụ tại Việt Nam đạt khoảng 2 triệu tấn, cho thấy tầm quan trọng của etilen trong ngành công nghiệp nhựa.
2.2.4. Phản Ứng Với Dung Dịch KMnO4: Phản Ứng Oxi Hóa Không Hoàn Toàn
Etilen làm mất màu dung dịch thuốc tím (KMnO4):
3C2H4 + 2KMnO4 + 4H2O → 3C2H4(OH)2 + 2KOH + 2MnO2Phản ứng này được sử dụng để nhận biết etilen và các anken khác.
3. Điều Chế Etilen C2H4: Phương Pháp Trong Công Nghiệp và Phòng Thí Nghiệm
Etilen được điều chế bằng nhiều phương pháp khác nhau, tùy thuộc vào quy mô sản xuất và mục đích sử dụng.
3.1. Điều Chế Etilen Trong Công Nghiệp: Cracking và Dehydrogen hóa
-
Cracking: Là quá trình bẻ gãy các phân tử hydrocarbon lớn (như alkan) thành các phân tử nhỏ hơn, trong đó có etilen.
-
Dehydrogen hóa: Là quá trình tách hydro từ alkan tương ứng để tạo thành etilen.
Theo báo cáo từ Tổng cục Thống kê Việt Nam, năm 2022, sản lượng etilen sản xuất trong nước chủ yếu đến từ các nhà máy lọc dầu và hóa chất, sử dụng phương pháp cracking và dehydrogen hóa.
3.2. Điều Chế Etilen Trong Phòng Thí Nghiệm: Dehidrat hóa Etanol
Trong phòng thí nghiệm, etilen có thể được điều chế bằng cách đun nóng etanol với axit sulfuric đậm đặc:
CH3CH2OH → CH2=CH2 + H2O (H2SO4 đặc, nhiệt độ)Axit sulfuric đóng vai trò là chất xúc tác và hút nước, giúp phản ứng xảy ra dễ dàng hơn.
4. Ứng Dụng Quan Trọng Của Etilen C2H4 Trong Đời Sống và Sản Xuất
Etilen có rất nhiều ứng dụng quan trọng trong các lĩnh vực khác nhau.
4.1. Ứng Dụng Trong Công Nghiệp Hóa Chất và Sản Xuất Polime
Etilen là nguyên liệu quan trọng để tổng hợp nhiều polime và các hợp chất hữu cơ khác:
- Polietilen (PE): Sản xuất bao bì, màng mỏng, đồ gia dụng.
- Etanol: Dung môi, nguyên liệu sản xuất hóa chất.
- Etilen oxit: Sản xuất etylen glicol (chất chống đông), chất tẩy rửa.
- Vinyl clorua: Sản xuất PVC (polyvinyl clorua), vật liệu xây dựng, ống nước.
Theo số liệu từ Bộ Công Thương Việt Nam, năm 2022, ngành công nghiệp hóa chất sử dụng etilen đóng góp đáng kể vào GDP của cả nước, với nhiều sản phẩm có giá trị gia tăng cao.
4.2. Ứng Dụng Trong Nông Nghiệp: Kích Thích Quả Chín
Etilen được sử dụng để kích thích quá trình chín của quả, giúp tăng năng suất và chất lượng nông sản. Phương pháp này đặc biệt hữu ích cho các loại quả cần vận chuyển xa hoặc bảo quản lâu dài.
Ứng dụng của etilen trong nông nghiệp giúp kích thích quá trình chín của quả.
4.3. Ứng Dụng Trong Sinh Học: Điều Hòa Sinh Trưởng và Phát Triển Của Thực Vật
Etilen là một hormone thực vật quan trọng, tham gia vào nhiều quá trình sinh lý của cây trồng:
- Kích thích nảy mầm và sinh trưởng.
- Điều khiển sự rụng lá, hoa, quả.
- Ảnh hưởng đến sự phát triển của rễ và thân.
Theo nghiên cứu từ Viện Di truyền Nông nghiệp Việt Nam, ngày 10/05/2023, việc kiểm soát nồng độ etilen có thể giúp điều khiển quá trình sinh trưởng và phát triển của cây trồng, từ đó nâng cao hiệu quả sản xuất nông nghiệp.
5. Các Bài Tập Về Công Thức Phân Tử Etilen C2H4
Để củng cố kiến thức về etilen, hãy cùng giải một số bài tập sau:
5.1. Bài Tập Về Cấu Tạo và Liên Kết Trong Phân Tử Etilen
Câu hỏi:
- Phân tử etilen có bao nhiêu liên kết sigma (σ) và liên kết pi (π)?
- Giải thích tại sao etilen dễ tham gia phản ứng cộng hơn phản ứng thế.
Đáp án:
- Phân tử etilen có 5 liên kết sigma (σ) và 1 liên kết pi (π).
- Etilen dễ tham gia phản ứng cộng hơn phản ứng thế vì liên kết pi (π) kém bền, dễ bị phá vỡ để tạo thành các liên kết sigma (σ) mới.
5.2. Bài Tập Về Phản Ứng Hóa Học Của Etilen
Câu hỏi:
- Viết phương trình hóa học của phản ứng giữa etilen và dung dịch brom.
- Tính khối lượng sản phẩm tạo thành khi cho 2,8 lít etilen (ở điều kiện tiêu chuẩn) phản ứng hoàn toàn với brom dư.
Đáp án:
- Phương trình hóa học: C2H4 + Br2 → C2H4Br2
- Số mol etilen: n(C2H4) = 2,8 / 22,4 = 0,125 mol
Theo phương trình, n(C2H4Br2) = n(C2H4) = 0,125 mol
Khối lượng sản phẩm: m(C2H4Br2) = 0,125 x 188 = 23,5 gam
5.3. Bài Tập Về Điều Chế Etilen
Câu hỏi:
- Viết phương trình hóa học của phản ứng điều chế etilen từ etanol.
- Tính thể tích etilen thu được (ở điều kiện tiêu chuẩn) khi đun nóng 46 gam etanol với H2SO4 đặc, biết hiệu suất phản ứng là 80%.
Đáp án:
- Phương trình hóa học: CH3CH2OH → CH2=CH2 + H2O (H2SO4 đặc, nhiệt độ)
- Số mol etanol: n(C2H5OH) = 46 / 46 = 1 mol
Theo phương trình, n(C2H4) = n(C2H5OH) = 1 mol
Do hiệu suất phản ứng là 80%, số mol etilen thực tế thu được là:
n(C2H4) = 1 x 80% = 0,8 mol
Thể tích etilen thu được: V(C2H4) = 0,8 x 22,4 = 17,92 lít
6. Etilen C2H4 Nguy Hiểm Như Thế Nào? Lưu Ý Khi Sử Dụng
Etilen không phải là chất độc, nhưng cần lưu ý một số vấn đề sau khi sử dụng:
- Ngạt thở: Etilen có thể gây ngạt thở nếu nồng độ quá cao trong không khí.
- Dễ cháy: Etilen là chất dễ cháy, cần tránh xa nguồn lửa và các chất oxy hóa mạnh.
- Gây tê: Tiếp xúc với etilen lỏng có thể gây tê và đông cứng các mô.
7. Mua Khí Etilen C2H4 Công Nghiệp Ở Đâu?
Khí etilen được sử dụng rộng rãi trong công nghiệp, do đó có thể tìm mua ở nhiều nơi. Tuy nhiên, để đảm bảo chất lượng và an toàn, nên lựa chọn các nhà cung cấp uy tín, có chứng nhận và kiểm định rõ ràng.
8. FAQ Về Etilen (C2H4)
8.1. Etilen có phải là chất độc không?
Etilen không phải là chất độc, nhưng có thể gây ngạt thở nếu nồng độ quá cao.
8.2. Etilen có mùi gì không?
Etilen là chất khí không màu, không mùi.
8.3. Etilen được sử dụng để làm gì trong nông nghiệp?
Etilen được sử dụng để kích thích quá trình chín của quả.
8.4. Làm thế nào để nhận biết etilen?
Etilen có thể được nhận biết bằng cách làm mất màu dung dịch brom hoặc dung dịch thuốc tím (KMnO4).
8.5. Polietilen được tạo ra từ chất nào?
Polietilen được tạo ra từ phản ứng trùng hợp etilen.
8.6. Etilen có tan trong nước không?
Etilen tan ít trong nước.
8.7. Etilen có những ứng dụng nào trong công nghiệp?
Etilen được sử dụng để sản xuất polietilen, etanol, etilen oxit và nhiều hóa chất khác.
8.8. Tại sao etilen dễ tham gia phản ứng cộng?
Etilen dễ tham gia phản ứng cộng do có liên kết đôi kém bền.
8.9. Phương pháp nào được sử dụng để điều chế etilen trong công nghiệp?
Trong công nghiệp, etilen được điều chế bằng phương pháp cracking và dehydrogen hóa.
8.10. Axit sulfuric có vai trò gì trong phản ứng điều chế etilen từ etanol?
Axit sulfuric đóng vai trò là chất xúc tác và hút nước trong phản ứng điều chế etilen từ etanol.
9. Khám Phá Thế Giới Hóa Học Cùng Tic.edu.vn
Qua bài viết này, tic.edu.vn hy vọng bạn đã hiểu rõ hơn về công thức phân tử của etilen, tính chất, ứng dụng và các bài tập liên quan. Nếu bạn đang gặp khó khăn trong việc tìm kiếm tài liệu học tập chất lượng, mất thời gian tổng hợp thông tin hoặc cần các công cụ hỗ trợ học tập hiệu quả, đừng lo lắng. Hãy truy cập ngay tic.edu.vn để khám phá nguồn tài liệu học tập phong phú, đa dạng và được kiểm duyệt kỹ càng.
Tic.edu.vn cung cấp:
- Nguồn tài liệu học tập đa dạng: Từ sách giáo khoa, bài giảng, đề thi đến các tài liệu tham khảo chuyên sâu.
- Thông tin giáo dục mới nhất: Cập nhật liên tục các xu hướng giáo dục, phương pháp học tập tiên tiến.
- Công cụ hỗ trợ học tập trực tuyến: Ghi chú, quản lý thời gian, tạo sơ đồ tư duy.
- Cộng đồng học tập sôi nổi: Trao đổi kiến thức, kinh nghiệm với bạn bè và thầy cô.
Hãy để tic.edu.vn trở thành người bạn đồng hành trên con đường chinh phục tri thức. Đừng quên liên hệ với chúng tôi qua email [email protected] hoặc truy cập website tic.edu.vn để được tư vấn và hỗ trợ tốt nhất. Chúng tôi luôn sẵn sàng lắng nghe và giải đáp mọi thắc mắc của bạn.