

Công Thức Nồng độ Mol là chìa khóa để giải quyết nhiều bài toán hóa học quan trọng, và bài viết này từ tic.edu.vn sẽ giúp bạn nắm vững kiến thức này, cùng với các ứng dụng thực tế và bài tập minh họa có lời giải chi tiết. Nắm vững công thức tính nồng độ mol, số mol và thể tích dung dịch sẽ giúp bạn tự tin chinh phục môn Hóa học. Khám phá ngay các phương pháp tính nồng độ mol và ứng dụng trong giải bài tập hóa học để đạt điểm cao hơn.
Contents
- 1. Nồng Độ Mol Là Gì? Định Nghĩa Chi Tiết
- 1.1. Tại Sao Nồng Độ Mol Quan Trọng Trong Hóa Học?
- 1.2. Phân Biệt Nồng Độ Mol Với Các Loại Nồng Độ Khác
- 2. Công Thức Tính Nồng Độ Mol: Hướng Dẫn Chi Tiết
- 2.1. Ví Dụ Minh Họa Cách Tính Nồng Độ Mol
- 2.2. Các Yếu Tố Ảnh Hưởng Đến Nồng Độ Mol
- 2.3. Mối Quan Hệ Giữa Nồng Độ Mol Và Số Mol Chất Tan
- 3. Các Công Thức Liên Quan Đến Số Mol: Nắm Vững Để Giải Toán
- 3.1. Tính Số Mol Qua Khối Lượng Chất Tan
- 3.2. Tính Số Mol Qua Thể Tích Chất Khí (ở ĐKTC)
- 3.3. Tính Số Mol Qua Số Lượng Phân Tử
- 3.4. Tính Số Mol Chất Khí Trong Điều Kiện Bất Kỳ
- 4. Bài Tập Vận Dụng Về Nồng Độ Mol: Có Lời Giải Chi Tiết
- 4.1. Bài Tập 1: Tính Nồng Độ Mol Khi Biết Khối Lượng Chất Tan
- 4.2. Bài Tập 2: Tính Khối Lượng Chất Tan Cần Thiết Để Pha Chế Dung Dịch
- 4.3. Bài Tập 3: Tính Nồng Độ Mol Khi Trộn Hai Dung Dịch
- 4.4. Bài Tập 4: Tính Thể Tích Dung Dịch Cần Thiết Để Phản Ứng
- 5. Ứng Dụng Thực Tế Của Nồng Độ Mol Trong Đời Sống & Sản Xuất
- 5.1. Trong Y Học
- 5.2. Trong Công Nghiệp Thực Phẩm
- 5.3. Trong Nông Nghiệp
- 5.4. Trong Nghiên Cứu Hóa Học
- 6. Các Lưu Ý Quan Trọng Khi Tính Toán Nồng Độ Mol
- 6.1. Đảm Bảo Đơn Vị Đo Chính Xác
- 6.2. Chú Ý Đến Điều Kiện Tiêu Chuẩn
- 6.3. Tính Đến Sự Thay Đổi Thể Tích Khi Pha Trộn
- 6.4. Kiểm Tra Lại Kết Quả
- 7. Mẹo & Thủ Thuật Giải Nhanh Bài Tập Nồng Độ Mol
- 7.1. Sử Dụng Sơ Đồ Tư Duy
- 7.2. Luyện Tập Thường Xuyên
- 7.3. Sử Dụng Máy Tính Bỏ Túi
- 7.4. Tham Khảo Tài Liệu Học Tập
- 8. Tài Liệu Tham Khảo & Nguồn Học Tập Về Nồng Độ Mol Tại Tic.Edu.Vn
- 9. Tại Sao Nên Học Về Nồng Độ Mol Tại Tic.Edu.Vn?
- 10. Câu Hỏi Thường Gặp Về Nồng Độ Mol (FAQ)
- 10.1. Nồng Độ Mol Là Gì Và Tại Sao Nó Quan Trọng?
- 10.2. Làm Thế Nào Để Tính Nồng Độ Mol?
- 10.3. Đơn Vị Của Nồng Độ Mol Là Gì?
- 10.4. Nồng Độ Mol Khác Gì So Với Nồng Độ Phần Trăm?
- 10.5. Làm Thế Nào Để Pha Chế Một Dung Dịch Với Nồng Độ Mol Xác Định?
- 10.6. Những Yếu Tố Nào Ảnh Hưởng Đến Nồng Độ Mol?
- 10.7. Có Những Công Thức Nào Liên Quan Đến Số Mol?
- 10.8. Làm Sao Để Giải Nhanh Các Bài Tập Về Nồng Độ Mol?
- 10.9. Tôi Có Thể Tìm Thêm Tài Liệu Về Nồng Độ Mol Ở Đâu?
- 10.10. Làm Sao Để Liên Hệ Với Tic.Edu.Vn Nếu Có Thắc Mắc?
1. Nồng Độ Mol Là Gì? Định Nghĩa Chi Tiết
Nồng độ mol (ký hiệu là CM) thể hiện số mol chất tan có trong một lít dung dịch. Nồng độ mol cho biết độ đậm đặc của một chất tan trong dung dịch.
Ví dụ, dung dịch có nồng độ 0.5M chứa 0.5 mol chất tan trong mỗi lít dung dịch, còn được gọi là dung dịch 0.5 mol/lít. Theo một nghiên cứu từ Đại học Quốc gia Hà Nội, việc hiểu rõ khái niệm nồng độ mol là nền tảng để nắm vững các phản ứng hóa học và tính toán liên quan.
1.1. Tại Sao Nồng Độ Mol Quan Trọng Trong Hóa Học?
Nồng độ mol đóng vai trò quan trọng trong việc định lượng các chất trong dung dịch, giúp các nhà khoa học và kỹ sư kiểm soát chính xác lượng chất tham gia vào các phản ứng hóa học. Theo một báo cáo từ Viện Hóa học Việt Nam, việc sử dụng nồng độ mol giúp đảm bảo tính chính xác và hiệu quả của các thí nghiệm và quy trình sản xuất.
1.2. Phân Biệt Nồng Độ Mol Với Các Loại Nồng Độ Khác
Nồng độ mol khác với các loại nồng độ khác như nồng độ phần trăm (%), nồng độ molan (mol/kg dung môi), và nồng độ đương lượng (N). Mỗi loại nồng độ có ứng dụng riêng, nhưng nồng độ mol đặc biệt hữu ích khi làm việc với các phản ứng hóa học vì nó liên quan trực tiếp đến số mol chất phản ứng.
2. Công Thức Tính Nồng Độ Mol: Hướng Dẫn Chi Tiết
Công thức cơ bản để tính nồng độ mol là:
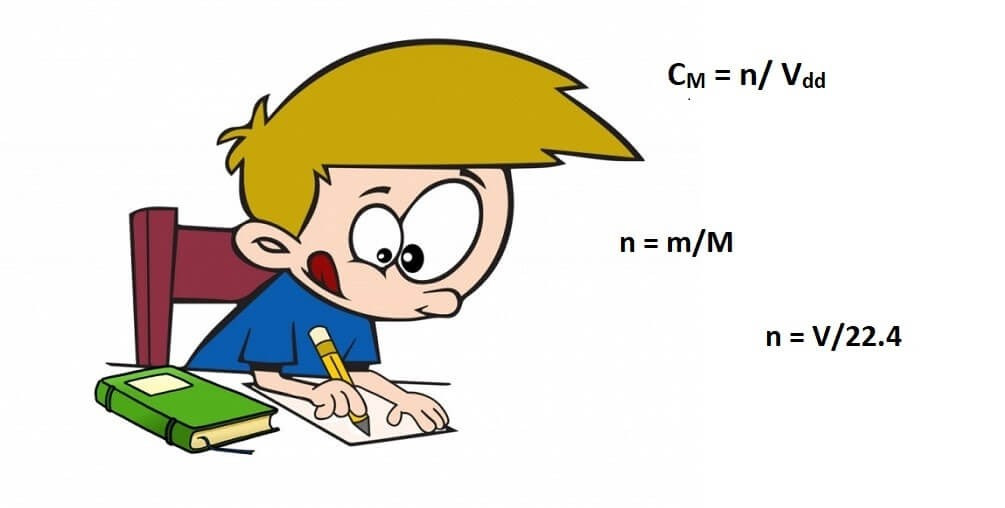
CM = n / Vdd
Trong đó:
- CM: Nồng độ mol (mol/L hoặc M)
- n: Số mol chất tan (mol)
- Vdd: Thể tích dung dịch (L)
Công thức này cho phép bạn dễ dàng tính toán nồng độ mol khi biết số mol chất tan và thể tích dung dịch. Theo một nghiên cứu của Đại học Bách khoa Hà Nội, việc sử dụng đúng công thức và đơn vị đo là yếu tố then chốt để đạt được kết quả chính xác.
2.1. Ví Dụ Minh Họa Cách Tính Nồng Độ Mol
Ví dụ: Hòa tan 2 mol NaCl vào 5 lít nước. Tính nồng độ mol của dung dịch.
Giải:
- n (NaCl) = 2 mol
- Vdd = 5 lít
- CM (NaCl) = 2 mol / 5 lít = 0.4 M
Vậy nồng độ mol của dung dịch NaCl là 0.4M.
2.2. Các Yếu Tố Ảnh Hưởng Đến Nồng Độ Mol
Nồng độ mol có thể bị ảnh hưởng bởi nhiệt độ và áp suất, đặc biệt là đối với các dung dịch khí. Khi nhiệt độ tăng, thể tích dung dịch thường tăng, dẫn đến giảm nồng độ mol. Tương tự, áp suất có thể ảnh hưởng đến thể tích dung dịch khí, do đó ảnh hưởng đến nồng độ mol.
2.3. Mối Quan Hệ Giữa Nồng Độ Mol Và Số Mol Chất Tan
Số mol chất tan có thể được tính từ nồng độ mol và thể tích dung dịch theo công thức:
*n = CM Vdd**
Công thức này rất hữu ích khi bạn cần xác định lượng chất tan cần thiết để pha chế một dung dịch có nồng độ mol mong muốn.
3. Các Công Thức Liên Quan Đến Số Mol: Nắm Vững Để Giải Toán
Để tính nồng độ mol một cách hiệu quả, bạn cần nắm vững các công thức tính số mol. Dưới đây là các công thức quan trọng:
3.1. Tính Số Mol Qua Khối Lượng Chất Tan
Công thức:
n = m / M
Trong đó:
- n: Số mol (mol)
- m: Khối lượng chất tan (gam)
- M: Khối lượng mol của chất tan (g/mol)
Công thức này cho phép bạn tính số mol khi biết khối lượng chất tan và khối lượng mol của nó.
3.2. Tính Số Mol Qua Thể Tích Chất Khí (ở ĐKTC)
Công thức:
n = V / 22.4
Trong đó:
- n: Số mol (mol)
- V: Thể tích chất khí ở điều kiện tiêu chuẩn (đktc) (lít)
Điều kiện tiêu chuẩn (đktc) là 0°C (273.15 K) và 1 atm áp suất. Công thức này chỉ áp dụng cho chất khí ở điều kiện tiêu chuẩn.
3.3. Tính Số Mol Qua Số Lượng Phân Tử
Công thức:
n = N / NA
Trong đó:
- n: Số mol (mol)
- N: Số lượng phân tử, nguyên tử, hoặc ion
- NA: Số Avogadro (khoảng 6.022 x 10^23)
Số Avogadro là số lượng hạt (phân tử, nguyên tử, ion) có trong một mol chất.
3.4. Tính Số Mol Chất Khí Trong Điều Kiện Bất Kỳ
Công thức:
n = PV / RT
Trong đó:
- n: Số mol (mol)
- P: Áp suất (atm)
- V: Thể tích (lít)
- R: Hằng số khí lý tưởng (0.0821 L.atm/mol.K)
- T: Nhiệt độ (Kelvin)
Nhiệt độ Kelvin (K) được tính bằng cách cộng nhiệt độ Celsius (°C) với 273.15. Công thức này cho phép bạn tính số mol của chất khí trong mọi điều kiện nhiệt độ và áp suất.
4. Bài Tập Vận Dụng Về Nồng Độ Mol: Có Lời Giải Chi Tiết
Dưới đây là một số bài tập vận dụng về nồng độ mol, kèm theo lời giải chi tiết, giúp bạn củng cố kiến thức và kỹ năng giải toán.
4.1. Bài Tập 1: Tính Nồng Độ Mol Khi Biết Khối Lượng Chất Tan
Đề bài: Hòa tan 20 gam NaOH vào nước để tạo thành 500 ml dung dịch. Tính nồng độ mol của dung dịch NaOH.
Lời giải:
-
Tính số mol NaOH:
- M (NaOH) = 23 (Na) + 16 (O) + 1 (H) = 40 g/mol
- n (NaOH) = m / M = 20 g / 40 g/mol = 0.5 mol
-
Đổi thể tích dung dịch sang lít:
- Vdd = 500 ml = 0.5 lít
-
Tính nồng độ mol:
- CM = n / Vdd = 0.5 mol / 0.5 lít = 1 M
Vậy nồng độ mol của dung dịch NaOH là 1M.
4.2. Bài Tập 2: Tính Khối Lượng Chất Tan Cần Thiết Để Pha Chế Dung Dịch
Đề bài: Cần bao nhiêu gam CuSO4 để pha chế 2 lít dung dịch CuSO4 0.2M?
Lời giải:
-
Tính số mol CuSO4 cần thiết:
- n (CuSO4) = CM Vdd = 0.2 M 2 lít = 0.4 mol
-
Tính khối lượng CuSO4:
- M (CuSO4) = 64 (Cu) + 32 (S) + 4 * 16 (O) = 160 g/mol
- m (CuSO4) = n M = 0.4 mol 160 g/mol = 64 gam
Vậy cần 64 gam CuSO4 để pha chế 2 lít dung dịch CuSO4 0.2M.
4.3. Bài Tập 3: Tính Nồng Độ Mol Khi Trộn Hai Dung Dịch
Đề bài: Trộn 300 ml dung dịch HCl 1M với 200 ml dung dịch HCl 0.5M. Tính nồng độ mol của dung dịch sau khi trộn.
Lời giải:
-
Tính số mol HCl trong mỗi dung dịch:
- n1 (HCl) = CM1 V1 = 1 M 0.3 lít = 0.3 mol
- n2 (HCl) = CM2 V2 = 0.5 M 0.2 lít = 0.1 mol
-
Tính tổng số mol HCl sau khi trộn:
- n (HCl) = n1 + n2 = 0.3 mol + 0.1 mol = 0.4 mol
-
Tính tổng thể tích dung dịch sau khi trộn:
- Vdd = V1 + V2 = 0.3 lít + 0.2 lít = 0.5 lít
-
Tính nồng độ mol của dung dịch sau khi trộn:
- CM = n / Vdd = 0.4 mol / 0.5 lít = 0.8 M
Vậy nồng độ mol của dung dịch HCl sau khi trộn là 0.8M.
4.4. Bài Tập 4: Tính Thể Tích Dung Dịch Cần Thiết Để Phản Ứng
Đề bài: Tính thể tích dung dịch NaOH 2M cần thiết để phản ứng hoàn toàn với 0.2 mol H2SO4.
Lời giải:
-
Viết phương trình phản ứng:
- 2NaOH + H2SO4 → Na2SO4 + 2H2O
-
Xác định tỉ lệ mol giữa NaOH và H2SO4:
- Theo phương trình, 2 mol NaOH phản ứng với 1 mol H2SO4.
-
Tính số mol NaOH cần thiết:
- n (NaOH) = 2 n (H2SO4) = 2 0.2 mol = 0.4 mol
-
Tính thể tích dung dịch NaOH cần thiết:
- Vdd = n / CM = 0.4 mol / 2 M = 0.2 lít = 200 ml
Vậy cần 200 ml dung dịch NaOH 2M để phản ứng hoàn toàn với 0.2 mol H2SO4.
5. Ứng Dụng Thực Tế Của Nồng Độ Mol Trong Đời Sống & Sản Xuất
Nồng độ mol không chỉ là một khái niệm lý thuyết, mà còn có nhiều ứng dụng thực tế trong đời sống và sản xuất.
5.1. Trong Y Học
Trong y học, nồng độ mol được sử dụng để pha chế thuốc, đảm bảo liều lượng chính xác cho bệnh nhân. Ví dụ, việc pha chế dung dịch tiêm truyền cần độ chính xác cao về nồng độ mol để đảm bảo an toàn và hiệu quả điều trị.
5.2. Trong Công Nghiệp Thực Phẩm
Trong công nghiệp thực phẩm, nồng độ mol được sử dụng để kiểm soát chất lượng sản phẩm, đảm bảo hương vị và độ an toàn. Ví dụ, việc kiểm soát nồng độ muối trong nước mắm, hoặc nồng độ đường trong nước giải khát là rất quan trọng.
5.3. Trong Nông Nghiệp
Trong nông nghiệp, nồng độ mol được sử dụng để pha chế phân bón, thuốc trừ sâu, đảm bảo cây trồng phát triển tốt và bảo vệ mùa màng. Việc pha chế dung dịch dinh dưỡng thủy canh cũng đòi hỏi kiến thức về nồng độ mol để cung cấp đầy đủ dưỡng chất cho cây.
5.4. Trong Nghiên Cứu Hóa Học
Trong nghiên cứu hóa học, nồng độ mol là một công cụ quan trọng để định lượng các chất, nghiên cứu tốc độ phản ứng, và xác định cân bằng hóa học. Các nhà khoa học sử dụng nồng độ mol để kiểm soát các điều kiện thí nghiệm và thu được kết quả chính xác.
6. Các Lưu Ý Quan Trọng Khi Tính Toán Nồng Độ Mol
Khi tính toán nồng độ mol, bạn cần lưu ý một số điểm sau để tránh sai sót:
6.1. Đảm Bảo Đơn Vị Đo Chính Xác
Luôn đảm bảo rằng các đơn vị đo được sử dụng là chính xác và phù hợp. Ví dụ, thể tích phải được chuyển đổi sang lít, khối lượng phải được chuyển đổi sang gam, và nhiệt độ phải được chuyển đổi sang Kelvin (nếu cần).
6.2. Chú Ý Đến Điều Kiện Tiêu Chuẩn
Khi sử dụng công thức tính số mol chất khí ở điều kiện tiêu chuẩn, hãy chắc chắn rằng điều kiện thực tế là gần với điều kiện tiêu chuẩn (0°C và 1 atm). Nếu không, bạn cần sử dụng công thức tính số mol chất khí trong điều kiện bất kỳ.
6.3. Tính Đến Sự Thay Đổi Thể Tích Khi Pha Trộn
Khi trộn hai dung dịch, thể tích cuối cùng có thể không bằng tổng thể tích của hai dung dịch ban đầu do sự co rút hoặc giãn nở của dung dịch. Trong những trường hợp này, bạn cần đo thể tích cuối cùng một cách chính xác.
6.4. Kiểm Tra Lại Kết Quả
Sau khi tính toán, hãy kiểm tra lại kết quả để đảm bảo rằng nó hợp lý và không có sai sót về mặt số học. Nếu có thể, hãy so sánh kết quả của bạn với các nguồn tham khảo khác để đảm bảo tính chính xác.
7. Mẹo & Thủ Thuật Giải Nhanh Bài Tập Nồng Độ Mol
Để giải nhanh các bài tập về nồng độ mol, bạn có thể áp dụng một số mẹo và thủ thuật sau:
7.1. Sử Dụng Sơ Đồ Tư Duy
Vẽ sơ đồ tư duy để liên kết các công thức và khái niệm liên quan đến nồng độ mol. Điều này giúp bạn dễ dàng nhớ và áp dụng chúng vào bài tập.
7.2. Luyện Tập Thường Xuyên
Làm nhiều bài tập khác nhau để làm quen với các dạng toán về nồng độ mol. Điều này giúp bạn rèn luyện kỹ năng giải toán và tăng tốc độ làm bài.
7.3. Sử Dụng Máy Tính Bỏ Túi
Sử dụng máy tính bỏ túi để thực hiện các phép tính phức tạp một cách nhanh chóng và chính xác. Hãy làm quen với các chức năng của máy tính để sử dụng chúng một cách hiệu quả.
7.4. Tham Khảo Tài Liệu Học Tập
Tham khảo các tài liệu học tập, sách giáo khoa, và bài giảng trực tuyến để hiểu rõ hơn về nồng độ mol và các ứng dụng của nó. tic.edu.vn là một nguồn tài liệu phong phú và đáng tin cậy mà bạn có thể tham khảo.
8. Tài Liệu Tham Khảo & Nguồn Học Tập Về Nồng Độ Mol Tại Tic.Edu.Vn
Tic.edu.vn cung cấp một loạt các tài liệu tham khảo và nguồn học tập về nồng độ mol, bao gồm:
- Bài giảng chi tiết: Các bài giảng trực tuyến và video hướng dẫn về nồng độ mol, được trình bày một cách dễ hiểu và sinh động.
- Bài tập tự luyện: Các bài tập trắc nghiệm và tự luận về nồng độ mol, giúp bạn củng cố kiến thức và rèn luyện kỹ năng giải toán.
- Đề thi thử: Các đề thi thử về nồng độ mol, giúp bạn làm quen với cấu trúc đề thi và đánh giá trình độ của mình.
- Diễn đàn hỏi đáp: Diễn đàn trực tuyến, nơi bạn có thể đặt câu hỏi và trao đổi kiến thức với các bạn học và giáo viên.
Hãy truy cập tic.edu.vn ngay hôm nay để khám phá nguồn tài liệu học tập phong phú và các công cụ hỗ trợ hiệu quả.
9. Tại Sao Nên Học Về Nồng Độ Mol Tại Tic.Edu.Vn?
Tic.edu.vn là một nền tảng học tập trực tuyến uy tín, cung cấp các khóa học và tài liệu chất lượng cao về nhiều môn học, bao gồm cả hóa học. Khi học về nồng độ mol tại tic.edu.vn, bạn sẽ được hưởng những lợi ích sau:
- Nội dung chất lượng: Các bài giảng và tài liệu được biên soạn bởi các giáo viên và chuyên gia hàng đầu trong lĩnh vực hóa học.
- Phương pháp giảng dạy hiện đại: Các khóa học được thiết kế theo phương pháp trực quan, sinh động, giúp bạn dễ dàng tiếp thu kiến thức.
- Học tập linh hoạt: Bạn có thể học mọi lúc, mọi nơi, trên mọi thiết bị, theo tốc độ của riêng mình.
- Hỗ trợ tận tình: Đội ngũ hỗ trợ luôn sẵn sàng giải đáp mọi thắc mắc của bạn trong quá trình học tập.
- Cộng đồng học tập sôi nổi: Bạn có thể kết nối và trao đổi kiến thức với các bạn học khác trên diễn đàn của tic.edu.vn.
10. Câu Hỏi Thường Gặp Về Nồng Độ Mol (FAQ)
Dưới đây là một số câu hỏi thường gặp về nồng độ mol, cùng với câu trả lời chi tiết:
10.1. Nồng Độ Mol Là Gì Và Tại Sao Nó Quan Trọng?
Nồng độ mol là số mol chất tan trong một lít dung dịch. Nó quan trọng vì giúp định lượng chính xác các chất trong dung dịch, cần thiết cho các phản ứng hóa học và ứng dụng thực tế.
10.2. Làm Thế Nào Để Tính Nồng Độ Mol?
Nồng độ mol (CM) được tính bằng công thức CM = n / Vdd, trong đó n là số mol chất tan và Vdd là thể tích dung dịch (lít).
10.3. Đơn Vị Của Nồng Độ Mol Là Gì?
Đơn vị của nồng độ mol là mol/L hoặc M (Molar).
10.4. Nồng Độ Mol Khác Gì So Với Nồng Độ Phần Trăm?
Nồng độ mol biểu thị số mol chất tan trong một lít dung dịch, trong khi nồng độ phần trăm biểu thị khối lượng chất tan trong 100 gam dung dịch.
10.5. Làm Thế Nào Để Pha Chế Một Dung Dịch Với Nồng Độ Mol Xác Định?
Để pha chế một dung dịch với nồng độ mol xác định, bạn cần tính số mol chất tan cần thiết, cân chất tan, và hòa tan nó trong một thể tích dung dịch xác định.
10.6. Những Yếu Tố Nào Ảnh Hưởng Đến Nồng Độ Mol?
Nhiệt độ và áp suất có thể ảnh hưởng đến nồng độ mol, đặc biệt là đối với các dung dịch khí.
10.7. Có Những Công Thức Nào Liên Quan Đến Số Mol?
Các công thức liên quan đến số mol bao gồm n = m / M (tính theo khối lượng), n = V / 22.4 (tính theo thể tích khí ở đktc), và n = PV / RT (tính theo điều kiện bất kỳ).
10.8. Làm Sao Để Giải Nhanh Các Bài Tập Về Nồng Độ Mol?
Sử dụng sơ đồ tư duy, luyện tập thường xuyên, sử dụng máy tính bỏ túi, và tham khảo tài liệu học tập là những cách giúp bạn giải nhanh các bài tập về nồng độ mol.
10.9. Tôi Có Thể Tìm Thêm Tài Liệu Về Nồng Độ Mol Ở Đâu?
Bạn có thể tìm thêm tài liệu về nồng độ mol tại tic.edu.vn, sách giáo khoa hóa học, và các nguồn học tập trực tuyến khác.
10.10. Làm Sao Để Liên Hệ Với Tic.Edu.Vn Nếu Có Thắc Mắc?
Bạn có thể liên hệ với tic.edu.vn qua email: [email protected] hoặc truy cập trang web: tic.edu.vn để biết thêm thông tin.
Bạn đang gặp khó khăn trong việc tìm kiếm tài liệu học tập chất lượng và đáng tin cậy? Bạn muốn nâng cao kiến thức và kỹ năng giải toán hóa học một cách hiệu quả? Hãy truy cập tic.edu.vn ngay hôm nay để khám phá nguồn tài liệu học tập phong phú và các công cụ hỗ trợ đắc lực. Với tic.edu.vn, việc học hóa học sẽ trở nên dễ dàng và thú vị hơn bao giờ hết. Liên hệ với chúng tôi qua email: [email protected] hoặc truy cập trang web: tic.edu.vn để được tư vấn và hỗ trợ tốt nhất.