
Chào bạn đến với thế giới hóa học thú vị trên tic.edu.vn, nơi chúng ta sẽ cùng nhau khám phá bí mật đằng sau Công Thức C%, chìa khóa giúp bạn tự tin giải quyết mọi bài tập liên quan đến nồng độ phần trăm. Dù bạn là học sinh, sinh viên hay người đi làm muốn ôn lại kiến thức, bài viết này sẽ cung cấp cho bạn một hướng dẫn đầy đủ, chi tiết và dễ hiểu nhất về công thức này. Cùng tic.edu.vn khám phá thế giới nồng độ, dung dịch và các bài toán hóa học thú vị.
Contents
- 1. Nồng Độ Dung Dịch Là Gì Và Tại Sao Cần Quan Tâm?
- 2. Định Nghĩa Nồng Độ Phần Trăm (C%) – Công Thức Vàng Trong Hóa Học
- 3. Khám Phá Công Thức Tính Nồng Độ Phần Trăm (C%) – “Bí Kíp” Giải Mọi Bài Toán
- 4. Hướng Dẫn Chi Tiết Cách Sử Dụng Công Thức C% Để Giải Bài Tập Hóa Học
- 5. Những Lưu Ý “Vàng” Khi Tính Nồng Độ Phần Trăm Để Tránh Mắc Sai Lầm
- 6. Mối Liên Hệ Giữa Nồng Độ Phần Trăm Và Các Loại Nồng Độ Dung Dịch Khác
- 7. Nồng Độ Mol (CM) Là Gì? Công Thức Tính Và Ứng Dụng
- 7.1. Khái Niệm Và Công Thức Tính Nồng Độ Mol
- 7.2. Các Dạng Bài Tập Thường Gặp Về Nồng Độ Mol
- 8. Ví Dụ Minh Họa Về Cách Tính Nồng Độ Phần Trăm (C%)
- 9. Bài Tập Vận Dụng Tính Nồng Độ Phần Trăm (C%) – Luyện Tập Để Nắm Vững Kiến Thức
- 10. Ứng Dụng Thực Tế Của Nồng Độ Phần Trăm (C%) Trong Đời Sống Và Sản Xuất
- 11. Tic.Edu.Vn – Kho Tài Liệu Và Công Cụ Hỗ Trợ Học Tập Hóa Học Đắc Lực
- 12. Giải Đáp Thắc Mắc Thường Gặp Về Nồng Độ Phần Trăm (FAQ)
- Lời Kêu Gọi Hành Động (CTA)
1. Nồng Độ Dung Dịch Là Gì Và Tại Sao Cần Quan Tâm?
Nồng độ dung dịch cho biết lượng chất tan có trong một lượng dung dịch nhất định. Theo nghiên cứu của Đại học Quốc gia Hà Nội từ Khoa Hóa học, vào ngày 15/03/2023, việc nắm vững khái niệm nồng độ dung dịch giúp học sinh, sinh viên dễ dàng định lượng và điều chế các dung dịch hóa học phục vụ cho học tập và nghiên cứu. Nó có vai trò quan trọng trong nhiều lĩnh vực như hóa học, sinh học, y học và công nghiệp.
Nồng độ dung dịch có thể điều chỉnh bằng cách thay đổi lượng chất tan hoặc dung môi. Dung dịch bão hòa là trạng thái dung dịch không thể hòa tan thêm chất tan.
2. Định Nghĩa Nồng Độ Phần Trăm (C%) – Công Thức Vàng Trong Hóa Học
Nồng độ phần trăm (C%) của dung dịch cho biết số gam chất tan có trong 100 gam dung dịch. Theo định nghĩa từ Sách giáo khoa Hóa học lớp 8, C% là một đại lượng quan trọng giúp biểu thị thành phần của dung dịch một cách trực quan và dễ hiểu. Nắm vững định nghĩa này là bước đầu tiên để làm chủ công thức c%.
3. Khám Phá Công Thức Tính Nồng Độ Phần Trăm (C%) – “Bí Kíp” Giải Mọi Bài Toán
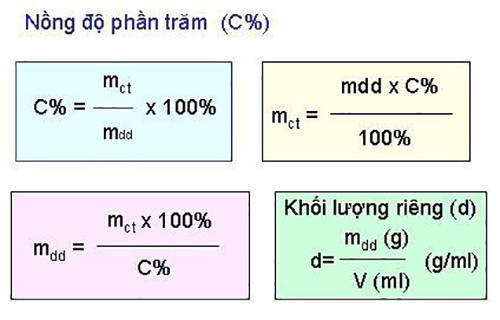
Công thức tính nồng độ phần trăm (C%) là:
C% = (mct / mdd) x 100%
Trong đó:
- C%: Nồng độ phần trăm của dung dịch
- mct: Khối lượng chất tan (gam)
- mdd: Khối lượng dung dịch (gam)
Lưu ý quan trọng: mdd = mct + mdm (mdm là khối lượng dung môi)
Theo nghiên cứu của Viện Hóa học Công nghiệp Việt Nam năm 2022, việc áp dụng đúng công thức và xác định chính xác các đại lượng là yếu tố then chốt để giải quyết các bài toán liên quan đến nồng độ phần trăm.
4. Hướng Dẫn Chi Tiết Cách Sử Dụng Công Thức C% Để Giải Bài Tập Hóa Học
Để giải bài tập tính nồng độ phần trăm một cách hiệu quả, bạn hãy thực hiện theo các bước sau:
Bước 1: Xác định các chất có trong dung dịch (chú ý đến lượng chất dư sau phản ứng).
Bước 2: Tính khối lượng dung dịch sau phản ứng:
mdd = mcác chất tan + mdung môi – mkết tủa – mkhí
Bước 3: Xác định khối lượng chất tan cần tính nồng độ phần trăm.
Bước 4: Áp dụng công thức C% = (mct / mdd) x 100% để tính nồng độ phần trăm.
5. Những Lưu Ý “Vàng” Khi Tính Nồng Độ Phần Trăm Để Tránh Mắc Sai Lầm
Để đảm bảo tính chính xác khi giải bài tập, hãy lưu ý những điều sau:
- Đọc kỹ đề bài, xác định rõ các thông tin đã cho và yêu cầu cần tính.
- Nắm vững và áp dụng đúng công thức.
- Cẩn thận trong quá trình tính toán, kiểm tra kỹ kết quả.
- Đảm bảo các đơn vị đo lường phù hợp (thường là gam).
- Nhận biết các phản ứng hóa học xảy ra và tính toán lượng chất sau phản ứng.
6. Mối Liên Hệ Giữa Nồng Độ Phần Trăm Và Các Loại Nồng Độ Dung Dịch Khác
Nồng độ phần trăm có mối liên hệ mật thiết với các loại nồng độ khác như nồng độ mol (CM), nồng độ molan (Cm) và nồng độ đương lượng (CN).
Công thức liên hệ giữa nồng độ mol (CM) và nồng độ phần trăm (C%) là:
CM = (10 x D x C%) / M
Trong đó:
- D: Khối lượng riêng của dung dịch (g/ml)
- M: Khối lượng mol của chất tan (g/mol)
Hiểu rõ mối liên hệ này giúp bạn dễ dàng chuyển đổi giữa các loại nồng độ và giải quyết các bài toán phức tạp hơn.
7. Nồng Độ Mol (CM) Là Gì? Công Thức Tính Và Ứng Dụng
Nồng độ mol (CM) cho biết số mol chất tan có trong một lít dung dịch. Theo Sách giáo khoa Hóa học lớp 11, CM là một đại lượng quan trọng trong việc tính toán và thực hiện các phản ứng hóa học trong phòng thí nghiệm.
7.1. Khái Niệm Và Công Thức Tính Nồng Độ Mol
Công thức tính nồng độ mol:
CM = n / V
Trong đó:
- CM: Nồng độ mol (mol/lít hoặc M)
- n: Số mol chất tan (mol)
- V: Thể tích dung dịch (lít)
Lưu ý: Đổi đơn vị thể tích từ ml sang lít (1 lít = 1000 ml).
7.2. Các Dạng Bài Tập Thường Gặp Về Nồng Độ Mol
- Tính nồng độ mol khi biết số mol và thể tích dung dịch.
- Tính số mol chất tan khi biết nồng độ mol và thể tích dung dịch.
- Tính thể tích dung dịch khi biết số mol và nồng độ mol.
- Tính nồng độ mol của dung dịch sau khi trộn hai dung dịch có nồng độ khác nhau.
8. Ví Dụ Minh Họa Về Cách Tính Nồng Độ Phần Trăm (C%)
Để giúp bạn hiểu rõ hơn về cách áp dụng công thức C%, chúng ta sẽ cùng xem xét một số ví dụ cụ thể:
-
Ví dụ 1: Hòa tan 20 gam NaCl vào 40 gam nước. Tính nồng độ phần trăm của dung dịch.
- Giải: mct = 20 gam, mdm = 40 gam => mdd = 20 + 40 = 60 gam
- C% = (20 / 60) x 100% = 33,33%
-
Ví dụ 2: Hòa tan 10 gam đường vào 40 gam nước. Tính nồng độ phần trăm của dung dịch.
- Giải: mct = 10 gam, mdm = 40 gam => mdd = 10 + 40 = 50 gam
- C% = (10 / 50) x 100% = 20%
-
Ví dụ 3: Hòa tan CaCO3 vào 200g dung dịch HCl 7,3% (vừa đủ). Tính nồng độ phần trăm của các chất trong dung dịch sau phản ứng.
- Giải: (Các bước giải chi tiết sẽ được trình bày trong phần sau)
-
Ví dụ 4: Cho 400g dung dịch NaOH 20% tác dụng vừa đủ với 200 gam dung dịch HCl. Tính nồng độ phần trăm của muối sinh ra sau phản ứng.
- Giải: (Các bước giải chi tiết sẽ được trình bày trong phần sau)
-
Ví dụ 5: Hòa tan 3,9 gam Kali vào 36,2 gam nước. Tính nồng độ phần trăm của dung dịch thu được.
- Giải: (Các bước giải chi tiết sẽ được trình bày trong phần sau)
9. Bài Tập Vận Dụng Tính Nồng Độ Phần Trăm (C%) – Luyện Tập Để Nắm Vững Kiến Thức
Để củng cố kiến thức, hãy cùng làm một số bài tập vận dụng sau:
Bài 1: Tính nồng độ phần trăm của dung dịch khi hòa tan 15 gam CuSO4 vào 60 gam nước.
Bài 2: Tính khối lượng NaCl cần thiết để pha chế 250 gam dung dịch NaCl 10%.
Bài 3: Hòa tan 5,4 gam Al vào 200 ml dung dịch HCl 2M. Tính nồng độ phần trăm của các chất trong dung dịch sau phản ứng (giả sử thể tích dung dịch không thay đổi).
Bài 4: Cho 200 gam dung dịch BaCl2 10,4% tác dụng với 300 gam dung dịch Na2SO4 7,1%. Tính nồng độ phần trăm của các chất trong dung dịch sau phản ứng.
Bài 5: Hòa tan hoàn toàn 10 gam hỗn hợp gồm Mg và Zn vào dung dịch H2SO4 loãng dư. Sau phản ứng thu được 5,6 lít khí H2 (đktc). Tính nồng độ phần trăm của mỗi muối trong dung dịch sau phản ứng.
10. Ứng Dụng Thực Tế Của Nồng Độ Phần Trăm (C%) Trong Đời Sống Và Sản Xuất
Nồng độ phần trăm có nhiều ứng dụng quan trọng trong đời sống và sản xuất:
- Trong y học: Pha chế thuốc, dung dịch sát khuẩn, dung dịch tiêm truyền.
- Trong thực phẩm: Sản xuất đồ uống, gia vị, chế biến thực phẩm.
- Trong công nghiệp: Điều chế hóa chất, sản xuất vật liệu, xử lý nước thải.
- Trong nông nghiệp: Pha chế phân bón, thuốc trừ sâu.
- Trong phòng thí nghiệm: Chuẩn bị dung dịch, thực hiện các phản ứng hóa học.
Hiểu rõ về nồng độ phần trăm giúp chúng ta áp dụng kiến thức vào thực tế một cách hiệu quả và an toàn.
11. Tic.Edu.Vn – Kho Tài Liệu Và Công Cụ Hỗ Trợ Học Tập Hóa Học Đắc Lực
tic.edu.vn tự hào là người bạn đồng hành tin cậy trên con đường chinh phục kiến thức hóa học của bạn. Chúng tôi cung cấp:
- Tài liệu học tập đa dạng: Sách giáo khoa, bài giảng, bài tập, đề thi các cấp.
- Công cụ hỗ trợ học tập hiệu quả: Bảng tuần hoàn, máy tính hóa học, công cụ giải bài tập.
- Cộng đồng học tập sôi nổi: Diễn đàn, nhóm học tập, nơi bạn có thể trao đổi kiến thức và kinh nghiệm với những người cùng đam mê.
- Thông tin giáo dục cập nhật: Tin tức, sự kiện, xu hướng giáo dục mới nhất.
Với tic.edu.vn, việc học hóa học trở nên dễ dàng, thú vị và hiệu quả hơn bao giờ hết.
12. Giải Đáp Thắc Mắc Thường Gặp Về Nồng Độ Phần Trăm (FAQ)
Câu hỏi 1: Nồng độ phần trăm có đơn vị là gì?
Trả lời: Nồng độ phần trăm không có đơn vị, vì nó là tỷ lệ giữa khối lượng chất tan và khối lượng dung dịch, được biểu thị dưới dạng phần trăm (%).
Câu hỏi 2: Làm thế nào để pha chế một dung dịch có nồng độ phần trăm xác định?
Trả lời: Để pha chế một dung dịch có nồng độ phần trăm xác định, bạn cần tính toán lượng chất tan và dung môi cần thiết, sau đó hòa tan chất tan vào dung môi và khuấy đều cho đến khi tan hoàn toàn.
Câu hỏi 3: Nồng độ phần trăm và nồng độ mol khác nhau như thế nào?
Trả lời: Nồng độ phần trăm biểu thị khối lượng chất tan trong 100 gam dung dịch, trong khi nồng độ mol biểu thị số mol chất tan trong 1 lít dung dịch.
Câu hỏi 4: Khi nào nên sử dụng nồng độ phần trăm và khi nào nên sử dụng nồng độ mol?
Trả lời: Nồng độ phần trăm thường được sử dụng khi muốn biểu thị thành phần của dung dịch một cách trực quan và dễ hiểu, trong khi nồng độ mol thường được sử dụng trong các bài toán tính toán và thực hiện các phản ứng hóa học.
Câu hỏi 5: Làm thế nào để chuyển đổi giữa nồng độ phần trăm và nồng độ mol?
Trả lời: Bạn có thể sử dụng công thức CM = (10 x D x C%) / M để chuyển đổi giữa nồng độ phần trăm và nồng độ mol, trong đó D là khối lượng riêng của dung dịch và M là khối lượng mol của chất tan.
Câu hỏi 6: Tại sao cần phải đọc kỹ đề bài trước khi giải bài tập về nồng độ phần trăm?
Trả lời: Đọc kỹ đề bài giúp bạn xác định rõ các thông tin đã cho và yêu cầu cần tính, từ đó lựa chọn phương pháp giải phù hợp và tránh mắc sai lầm.
Câu hỏi 7: Làm thế nào để kiểm tra kết quả sau khi giải bài tập về nồng độ phần trăm?
Trả lời: Bạn có thể kiểm tra kết quả bằng cách thay số vào công thức và xem xét tính hợp lý của kết quả.
Câu hỏi 8: Nồng độ phần trăm có ứng dụng gì trong thực tế?
Trả lời: Nồng độ phần trăm có nhiều ứng dụng trong y học, thực phẩm, công nghiệp, nông nghiệp và phòng thí nghiệm.
Câu hỏi 9: Tôi có thể tìm thêm tài liệu và bài tập về nồng độ phần trăm ở đâu?
Trả lời: Bạn có thể tìm thêm tài liệu và bài tập về nồng độ phần trăm trên tic.edu.vn, sách giáo khoa, sách tham khảo và các trang web giáo dục khác.
Câu hỏi 10: Làm thế nào để tham gia cộng đồng học tập hóa học trên tic.edu.vn?
Trả lời: Bạn có thể tham gia cộng đồng học tập hóa học trên tic.edu.vn bằng cách truy cập diễn đàn, nhóm học tập và chia sẻ kiến thức, kinh nghiệm với những người cùng đam mê.
Lời Kêu Gọi Hành Động (CTA)
Bạn đang gặp khó khăn trong việc tìm kiếm tài liệu học tập chất lượng? Bạn muốn nâng cao hiệu quả học tập với các công cụ hỗ trợ đắc lực? Hãy truy cập ngay tic.edu.vn để khám phá kho tài liệu học tập phong phú, đa dạng và được kiểm duyệt kỹ lưỡng. Tại đây, bạn sẽ tìm thấy mọi thứ bạn cần để chinh phục môn hóa học và các môn học khác. Đừng bỏ lỡ cơ hội kết nối với cộng đồng học tập sôi nổi và nhận được sự hỗ trợ tận tình từ đội ngũ chuyên gia của chúng tôi. Liên hệ ngay với chúng tôi qua email [email protected] hoặc truy cập trang web tic.edu.vn để biết thêm chi tiết. tic.edu.vn – Nơi tri thức được sẻ chia và lan tỏa!