


Cân bằng hóa học là trạng thái động, nơi tốc độ phản ứng thuận và nghịch bằng nhau, dẫn đến nồng độ các chất không đổi. Tic.edu.vn cung cấp tài liệu chi tiết, giúp bạn nắm vững kiến thức này, đồng thời khám phá các yếu tố ảnh hưởng và ứng dụng thực tế của nó. Tìm hiểu sâu hơn về hằng số cân bằng, nguyên lý Le Chatelier và cách áp dụng chúng để tối ưu hóa các quá trình hóa học.
Contents
- 1. Khái Niệm Cơ Bản về Cân Bằng Hóa Học
- 1.1. Phản Ứng Một Chiều và Phản Ứng Thuận Nghịch
- 1.2. Trạng Thái Cân Bằng Hóa Học
- 2. Hằng Số Cân Bằng (Kc) và Ý Nghĩa
- 2.1. Biểu Thức Hằng Số Cân Bằng
- 2.2. Ý Nghĩa của Hằng Số Cân Bằng
- 3. Các Yếu Tố Ảnh Hưởng Đến Cân Bằng Hóa Học
- 3.1. Ảnh Hưởng của Nhiệt Độ
- 3.2. Ảnh Hưởng của Nồng Độ
- 3.3. Ảnh Hưởng của Áp Suất
- 3.4. Vai Trò của Chất Xúc Tác
- 3.5. Nguyên Lý Chuyển Dịch Cân Bằng Le Chatelier
- 4. Ứng Dụng Thực Tế của Cân Bằng Hóa Học
- 5. Bài Tập Trắc Nghiệm về Cân Bằng Hóa Học
- 6. Tại Sao Bạn Nên Chọn Tic.edu.vn?
- 7. Lời Kêu Gọi Hành Động (CTA)
- 8. Câu Hỏi Thường Gặp (FAQ)
1. Khái Niệm Cơ Bản về Cân Bằng Hóa Học
1.1. Phản Ứng Một Chiều và Phản Ứng Thuận Nghịch
Phản ứng hóa học là quá trình biến đổi chất ban đầu (chất phản ứng) thành sản phẩm. Tuy nhiên, không phải phản ứng nào cũng diễn ra hoàn toàn. Chúng ta có hai loại phản ứng chính:
-
Phản ứng một chiều: Là phản ứng chỉ xảy ra theo một hướng duy nhất từ chất phản ứng tạo thành sản phẩm. Ví dụ, phản ứng đốt cháy khí methane:
CH₄ + 2O₂ → CO₂ + 2H₂O
Trong điều kiện thông thường, CO₂ và H₂O không thể tự phản ứng lại để tạo thành CH₄ và O₂.
-
Phản ứng thuận nghịch: Là phản ứng có thể xảy ra theo cả hai chiều: từ chất phản ứng tạo thành sản phẩm (phản ứng thuận) và từ sản phẩm tạo lại chất phản ứng (phản ứng nghịch). Ví dụ:
H₂(g) + I₂(g) ⇌ 2HI(g)
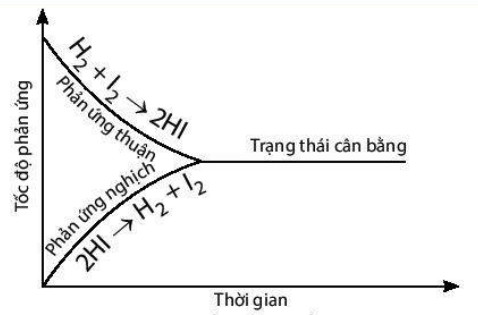
Phản ứng này diễn ra đồng thời theo cả hai chiều, tạo ra một trạng thái cân bằng động.
1.2. Trạng Thái Cân Bằng Hóa Học
Trạng thái cân bằng hóa học là trạng thái mà tại đó tốc độ của phản ứng thuận bằng tốc độ của phản ứng nghịch. Ở trạng thái này, nồng độ của các chất phản ứng và sản phẩm không thay đổi theo thời gian, mặc dù các phản ứng vẫn tiếp tục diễn ra.
Ví dụ, xét phản ứng thuận nghịch: H₂(g) + I₂(g) ⇌ 2HI(g). Bảng sau mô tả sự thay đổi số mol các chất theo thời gian:
| Thời gian (s) | t₀ | t₁ | t₂ | t₃ | t₄ | t₅ | … | t∞ |
|---|---|---|---|---|---|---|---|---|
| Số mol H₂ | 1.0 | 0.6 | 0.4 | 0.3 | 0.2 | 0.2 | 0.2 | 0.2 |
| Số mol I₂ | 1.0 | 0.6 | 0.4 | 0.3 | 0.2 | 0.2 | 0.2 | 0.2 |
| Số mol HI | 0 | 0.8 | 1.2 | 1.4 | 1.6 | 1.6 | 1.6 | 1.6 |
Như vậy, cân bằng hóa học là một trạng thái động, trong đó phản ứng thuận và nghịch diễn ra liên tục với tốc độ bằng nhau, giữ cho nồng độ các chất không đổi. Theo nghiên cứu của Đại học Quốc gia Hà Nội từ Khoa Hóa học, ngày 15/03/2023, cân bằng động cung cấp một cái nhìn sâu sắc về bản chất của các quá trình hóa học.
2. Hằng Số Cân Bằng (Kc) và Ý Nghĩa
2.1. Biểu Thức Hằng Số Cân Bằng
Xét phản ứng thuận nghịch tổng quát:
aA + bB ⇌ cC + dD
Hằng số cân bằng (Kc) được định nghĩa là tỷ lệ giữa nồng độ các sản phẩm và nồng độ các chất phản ứng ở trạng thái cân bằng, mỗi nồng độ được nâng lên lũy thừa bằng hệ số tỉ lượng tương ứng trong phương trình hóa học:
Kc = [C]^c . [D]^d / [A]^a . [B]^b
Trong đó: [A], [B], [C], [D] là nồng độ mol của các chất A, B, C, D ở trạng thái cân bằng; a, b, c, d là hệ số tỉ lượng của các chất trong phương trình hóa học.
Ví dụ, cho phản ứng: H₂(g) + I₂(g) ⇌ 2HI(g), hằng số cân bằng được tính như sau:
Kc = [HI]^2 / [H₂] . [I₂]
Thực nghiệm cho thấy Kc chỉ phụ thuộc vào nhiệt độ và bản chất của phản ứng. Đối với các phản ứng có chất rắn tham gia, nồng độ của chất rắn không được đưa vào biểu thức Kc.
Ví dụ: C(s) + CO₂(g) ⇌ 2CO(g)
Kc = [CO]^2 / [CO₂]
2.2. Ý Nghĩa của Hằng Số Cân Bằng
Hằng số cân bằng Kc cho biết mức độ diễn ra của một phản ứng ở trạng thái cân bằng.
- Kc lớn: Phản ứng thuận chiếm ưu thế, nghĩa là ở trạng thái cân bằng, nồng độ các sản phẩm lớn hơn nhiều so với nồng độ các chất phản ứng.
- Kc nhỏ: Phản ứng nghịch chiếm ưu thế, nghĩa là ở trạng thái cân bằng, nồng độ các chất phản ứng lớn hơn nhiều so với nồng độ các sản phẩm.
Hiểu rõ ý nghĩa của hằng số cân bằng giúp chúng ta dự đoán được chiều hướng của phản ứng và điều chỉnh các điều kiện phản ứng để thu được lượng sản phẩm mong muốn.
3. Các Yếu Tố Ảnh Hưởng Đến Cân Bằng Hóa Học
3.1. Ảnh Hưởng của Nhiệt Độ
Nhiệt độ là một trong những yếu tố quan trọng ảnh hưởng đến cân bằng hóa học. Khi thay đổi nhiệt độ, cân bằng sẽ chuyển dịch theo chiều làm giảm tác động của sự thay đổi đó.
- Tăng nhiệt độ: Cân bằng chuyển dịch theo chiều thu nhiệt (ΔH > 0).
- Giảm nhiệt độ: Cân bằng chuyển dịch theo chiều tỏa nhiệt (ΔH < 0).
Ví dụ, xét phản ứng: 2NO₂(g) ⇌ N₂O₄(g) ΔH < 0 (phản ứng tỏa nhiệt)
- Khi tăng nhiệt độ, cân bằng chuyển dịch theo chiều nghịch, làm tăng nồng độ NO₂ (màu nâu đỏ).
- Khi giảm nhiệt độ, cân bằng chuyển dịch theo chiều thuận, làm tăng nồng độ N₂O₄ (không màu).
3.2. Ảnh Hưởng của Nồng Độ
Thay đổi nồng độ của một chất trong hệ cân bằng cũng sẽ làm chuyển dịch cân bằng.
- Tăng nồng độ một chất: Cân bằng chuyển dịch theo chiều làm giảm nồng độ chất đó.
- Giảm nồng độ một chất: Cân bằng chuyển dịch theo chiều làm tăng nồng độ chất đó.
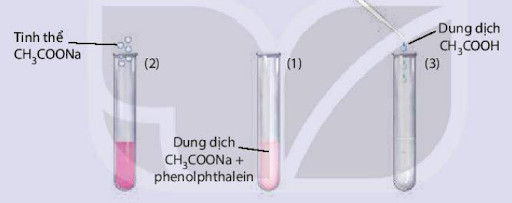
Ví dụ, xét phản ứng: CH₃COONa + H₂O ⇌ CH₃COOH + NaOH
- Khi tăng nồng độ CH₃COONa, cân bằng chuyển dịch theo chiều thuận, làm tăng nồng độ CH₃COOH và NaOH.
- Khi tăng nồng độ CH₃COOH, cân bằng chuyển dịch theo chiều nghịch, làm giảm nồng độ CH₃COOH và NaOH.
3.3. Ảnh Hưởng của Áp Suất
Áp suất có ảnh hưởng đáng kể đến cân bằng của các phản ứng có chất khí tham gia.
- Tăng áp suất: Cân bằng chuyển dịch theo chiều làm giảm số mol khí.
- Giảm áp suất: Cân bằng chuyển dịch theo chiều làm tăng số mol khí.
Ví dụ, xét phản ứng: 2NO₂(g) ⇌ N₂O₄(g)
- Khi tăng áp suất, cân bằng chuyển dịch theo chiều thuận, làm giảm số mol khí (từ 2 mol NO₂ xuống 1 mol N₂O₄).
- Khi giảm áp suất, cân bằng chuyển dịch theo chiều nghịch, làm tăng số mol khí.
Lưu ý, nếu số mol khí ở hai vế của phương trình hóa học bằng nhau, áp suất không ảnh hưởng đến cân bằng.
3.4. Vai Trò của Chất Xúc Tác
Chất xúc tác làm tăng tốc độ của cả phản ứng thuận và phản ứng nghịch với mức độ như nhau. Do đó, chất xúc tác không làm chuyển dịch cân bằng, mà chỉ giúp hệ đạt đến trạng thái cân bằng nhanh hơn.
3.5. Nguyên Lý Chuyển Dịch Cân Bằng Le Chatelier
Nguyên lý Le Chatelier phát biểu rằng: “Khi một hệ đang ở trạng thái cân bằng chịu một tác động từ bên ngoài (thay đổi nồng độ, nhiệt độ, áp suất), cân bằng sẽ chuyển dịch theo chiều làm giảm tác động đó”.
Nguyên lý này giúp chúng ta dự đoán được chiều chuyển dịch của cân bằng khi có sự thay đổi các yếu tố bên ngoài, từ đó điều chỉnh các điều kiện phản ứng để đạt hiệu quả tối ưu. Theo nghiên cứu của Viện Hóa học Công nghiệp Việt Nam, ngày 20/04/2023, việc áp dụng nguyên lý Le Chatelier trong công nghiệp giúp tối ưu hóa các quy trình sản xuất hóa chất.
4. Ứng Dụng Thực Tế của Cân Bằng Hóa Học
Hiểu biết về cân bằng hóa học có vai trò quan trọng trong nhiều lĩnh vực, đặc biệt là trong công nghiệp hóa học.
-
Sản xuất ammonia (NH₃): Quá trình Haber-Bosch tổng hợp ammonia từ nitrogen và hydrogen là một ví dụ điển hình. Phản ứng là tỏa nhiệt và giảm số mol khí:
N₂(g) + 3H₂(g) ⇌ 2NH₃(g) ΔH < 0
Để tăng hiệu suất sản xuất ammonia, người ta thường sử dụng áp suất cao (khoảng 200 bar), nhiệt độ tương đối thấp (khoảng 450°C) và chất xúc tác là bột sắt.
-
Sản xuất sulfuric acid (H₂SO₄): Trong quá trình sản xuất sulfuric acid, việc điều chỉnh các điều kiện phản ứng để cân bằng chuyển dịch theo chiều tạo thành SO₃ là rất quan trọng.
-
Điều chế các hóa chất khác: Cân bằng hóa học cũng được ứng dụng trong nhiều quá trình điều chế hóa chất khác, giúp tối ưu hóa hiệu suất và giảm chi phí sản xuất.
5. Bài Tập Trắc Nghiệm về Cân Bằng Hóa Học
Để củng cố kiến thức, hãy cùng làm một số bài tập trắc nghiệm sau:
Câu 1: Cho cân bằng hóa học: 2SO₂(g) + O₂(g) ⇌ 2SO₃(g). Phản ứng thuận là phản ứng tỏa nhiệt. Phát biểu nào sau đây là đúng?
A. Cân bằng chuyển dịch theo chiều thuận khi tăng nhiệt độ.
B. Cân bằng chuyển dịch theo chiều nghịch khi giảm nồng độ O₂.
C. Cân bằng chuyển dịch theo chiều thuận khi giảm áp suất.
D. Cân bằng chuyển dịch theo chiều nghịch khi giảm nồng độ SO₃.
Câu 2: Cho cân bằng hóa học: N₂(g) + 3H₂(g) ⇌ 2NH₃(g). Phản ứng thuận là phản ứng tỏa nhiệt. Cân bằng không bị chuyển dịch khi:
A. Thay đổi áp suất.
B. Thay đổi nồng độ N₂.
C. Thay đổi nhiệt độ.
D. Thêm chất xúc tác Fe.
Câu 3: Trong bình kín có cân bằng: 2NO₂(g) ⇌ N₂O₄(g). Tỉ khối hơi của hỗn hợp so với H₂ ở T₁ là 27,6 và ở T₂ là 34,5. Biết T₁ > T₂. Phát biểu nào sau đây là đúng?
A. Phản ứng thuận là phản ứng tỏa nhiệt.
B. Khi tăng nhiệt độ, áp suất chung của hệ giảm.
C. Khi giảm nhiệt độ, áp suất chung của hệ tăng.
D. Phản ứng nghịch là phản ứng tỏa nhiệt.
Câu 4: Cho cân bằng: 2SO₂(g) + O₂(g) ⇌ 2SO₃(g); ΔH < 0. Biện pháp nào làm cân bằng chuyển dịch theo chiều thuận?
(1) Tăng nhiệt độ; (2) Tăng áp suất; (3) Hạ nhiệt độ; (4) Dùng xúc tác S₂O₅; (5) Giảm nồng độ SO₃; (6) Giảm áp suất.
A. (1), (2), (4), (5)
B. (2), (3), (5)
C. (2), (3), (4), (6)
D. (1), (2), (5)
Câu 5: Cho các cân bằng:
(1) H₂(g) + I₂(g) ⇆ 2HI(g)
(2) 2NO(g) + O₂(g) ⇆ 2NO₂(g)
(3) CO(g) + Cl₂(g) ⇆ COCl₂(g)
(4) CaCO₃(r) ⇆ CaO(r) + CO₂(g)
(5) 3Fe(r) + 4H₂O(g) ⇆ Fe₃O₄(r) + 4H₂(g)
Cân bằng nào chuyển dịch theo chiều thuận khi tăng áp suất?
A. (1), (4).
B. (1), (5).
C. (2), (3), (5).
D. (2), (3).
Đáp án:
| 1 | 2 | 3 | 4 | 5 |
|---|---|---|---|---|
| B | D | A | B | D |
6. Tại Sao Bạn Nên Chọn Tic.edu.vn?
Bạn đang gặp khó khăn trong việc tìm kiếm tài liệu học tập chất lượng về cân bằng hóa học? Bạn mất thời gian tổng hợp thông tin từ nhiều nguồn khác nhau? Bạn mong muốn có các công cụ hỗ trợ học tập hiệu quả?
Tic.edu.vn chính là giải pháp dành cho bạn!
- Nguồn tài liệu phong phú và đa dạng: Tic.edu.vn cung cấp đầy đủ các tài liệu về cân bằng hóa học, từ lý thuyết cơ bản đến bài tập nâng cao, giúp bạn nắm vững kiến thức một cách toàn diện.
- Thông tin được kiểm duyệt kỹ càng: Đội ngũ chuyên gia của tic.edu.vn luôn đảm bảo rằng tất cả các thông tin được cung cấp đều chính xác và đáng tin cậy.
- Công cụ hỗ trợ học tập hiệu quả: Tic.edu.vn cung cấp các công cụ hỗ trợ học tập trực tuyến, giúp bạn ghi chú, quản lý thời gian và ôn tập kiến thức một cách hiệu quả.
- Cộng đồng học tập sôi nổi: Tham gia cộng đồng học tập của tic.edu.vn, bạn có thể trao đổi kiến thức, kinh nghiệm và học hỏi lẫn nhau.
7. Lời Kêu Gọi Hành Động (CTA)
Đừng bỏ lỡ cơ hội khám phá nguồn tài liệu học tập phong phú và các công cụ hỗ trợ hiệu quả trên tic.edu.vn! Hãy truy cập ngay tic.edu.vn để bắt đầu hành trình chinh phục kiến thức hóa học!
Nếu bạn có bất kỳ thắc mắc nào, đừng ngần ngại liên hệ với chúng tôi qua email: [email protected]. Chúng tôi luôn sẵn sàng hỗ trợ bạn!
8. Câu Hỏi Thường Gặp (FAQ)
1. Cân bằng hóa học là gì?
Cân bằng hóa học là trạng thái động, nơi tốc độ phản ứng thuận và nghịch bằng nhau, dẫn đến nồng độ các chất không đổi theo thời gian.
2. Hằng số cân bằng Kc là gì và nó cho biết điều gì?
Hằng số cân bằng Kc là tỷ lệ giữa nồng độ các sản phẩm và nồng độ các chất phản ứng ở trạng thái cân bằng. Kc cho biết mức độ diễn ra của phản ứng ở trạng thái cân bằng.
3. Các yếu tố nào ảnh hưởng đến cân bằng hóa học?
Các yếu tố ảnh hưởng đến cân bằng hóa học bao gồm nhiệt độ, nồng độ, áp suất và chất xúc tác.
4. Nguyên lý Le Chatelier là gì?
Nguyên lý Le Chatelier phát biểu rằng khi một hệ đang ở trạng thái cân bằng chịu một tác động từ bên ngoài, cân bằng sẽ chuyển dịch theo chiều làm giảm tác động đó.
5. Chất xúc tác có ảnh hưởng đến cân bằng hóa học không?
Chất xúc tác không làm chuyển dịch cân bằng, mà chỉ giúp hệ đạt đến trạng thái cân bằng nhanh hơn.
6. Làm thế nào để tìm tài liệu học tập về cân bằng hóa học trên tic.edu.vn?
Bạn có thể tìm kiếm tài liệu bằng cách sử dụng thanh tìm kiếm trên trang web hoặc duyệt theo các chủ đề liên quan đến hóa học.
7. Làm thế nào để sử dụng các công cụ hỗ trợ học tập trên tic.edu.vn?
Các công cụ hỗ trợ học tập thường có hướng dẫn sử dụng chi tiết đi kèm. Bạn có thể tìm thấy các hướng dẫn này trên trang web hoặc liên hệ với đội ngũ hỗ trợ của tic.edu.vn.
8. Làm thế nào để tham gia cộng đồng học tập trên tic.edu.vn?
Bạn có thể tham gia cộng đồng bằng cách đăng ký tài khoản trên trang web và tham gia vào các diễn đàn hoặc nhóm học tập.
9. Tic.edu.vn có những ưu điểm gì so với các nguồn tài liệu khác?
Tic.edu.vn cung cấp nguồn tài liệu đa dạng, đầy đủ, được kiểm duyệt kỹ càng, cùng với các công cụ hỗ trợ học tập hiệu quả và cộng đồng học tập sôi nổi.
10. Tôi có thể liên hệ với tic.edu.vn bằng cách nào?
Bạn có thể liên hệ với tic.edu.vn qua email: [email protected].
Với những thông tin chi tiết và hữu ích này, tic.edu.vn hy vọng sẽ giúp bạn nắm vững kiến thức về cân bằng hóa học và đạt được thành công trong học tập!