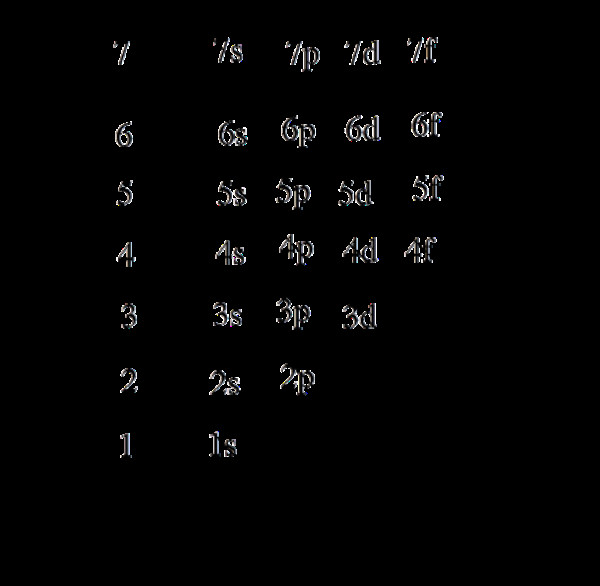
Việc nắm vững Cách Viết Cấu Hình Electron là chìa khóa để mở cánh cửa kiến thức hóa học, giúp bạn hiểu sâu sắc về tính chất và hoạt động của các nguyên tố. Bài viết này của tic.edu.vn sẽ cung cấp hướng dẫn chi tiết, dễ hiểu về cách viết cấu hình electron, cùng với các ví dụ minh họa và bài tập áp dụng, giúp bạn chinh phục chủ đề này một cách dễ dàng. Khám phá ngay cách phân bố electron và làm chủ kiến thức hóa học cùng tic.edu.vn!
Contents
- 1. Tổng Quan Về Cấu Hình Electron
- 1.1. Cấu Hình Electron Nguyên Tử Biểu Diễn Điều Gì?
- 1.2. Ý Nghĩa Của Việc Nắm Vững Cấu Hình Electron
- 2. Các Quy Tắc Và Nguyên Lý Cơ Bản Để Viết Cấu Hình Electron
- 2.1. Các Khái Niệm Cơ Bản
- 2.2. Nguyên Lý Pauli
- 2.3. Quy Tắc Hund
- 2.4. Nguyên Lý Vững Bền (Aufbau Principle)
- 2.5. Thứ Tự Năng Lượng Các Orbital
- 3. Hướng Dẫn Chi Tiết Cách Viết Cấu Hình Electron
- 3.1. Bước 1: Xác Định Số Electron Của Nguyên Tử
- 3.2. Bước 2: Phân Bố Electron Vào Các Orbital Theo Thứ Tự Năng Lượng
- 3.3. Bước 3: Viết Cấu Hình Electron Hoàn Chỉnh
- 3.4. Cách Viết Cấu Hình Electron Rút Gọn
- 4. Các Trường Hợp Đặc Biệt Cần Lưu Ý
- 4.1. Cấu Hình Bán Bão Hòa (d⁵) và Bão Hòa (d¹⁰)
- 4.2. Giải Thích Sự Bất Thường
- 5. Ví Dụ Minh Họa Cách Viết Cấu Hình Electron
- 5.1. Hydro (H, Z = 1)
- 5.2. Oxy (O, Z = 8)
- 5.3. Kali (K, Z = 19)
- 5.4. Sắt (Fe, Z = 26)
- 6. Bảng Cấu Hình Electron Của 20 Nguyên Tố Đầu Tiên
- 7. Bài Tập Vận Dụng
- 7.1. Bài Tập Cơ Bản
- 7.2. Bài Tập Nâng Cao
- 8. Ứng Dụng Của Cấu Hình Electron Trong Hóa Học
- 8.1. Dự Đoán Tính Chất Hóa Học
- 8.2. Giải Thích Liên Kết Hóa Học
- 8.3. Nghiên Cứu Vật Liệu
- 9. Tài Liệu Tham Khảo Và Công Cụ Hỗ Trợ
- 10. FAQ – Các Câu Hỏi Thường Gặp Về Cấu Hình Electron
- 10.1. Tại sao cần phải viết cấu hình electron?
- 10.2. Làm thế nào để xác định số electron lớp ngoài cùng?
- 10.3. Cấu hình electron có ảnh hưởng đến tính chất của nguyên tố như thế nào?
- 10.4. Tại sao một số nguyên tố có cấu hình electron bất thường?
- 10.5. Có những quy tắc nào cần tuân thủ khi viết cấu hình electron?
- 10.6. Làm thế nào để viết cấu hình electron rút gọn?
- 10.7. Cấu hình electron được ứng dụng trong những lĩnh vực nào?
- 10.8. Có những công cụ nào hỗ trợ việc học và viết cấu hình electron?
- 10.9. Làm thế nào để nhớ thứ tự năng lượng của các orbital?
- 10.10. Làm thế nào để luyện tập viết cấu hình electron hiệu quả?
1. Tổng Quan Về Cấu Hình Electron
Cấu hình electron (cấu hình e) là sự sắp xếp các electron trong một nguyên tử hoặc ion. Việc hiểu và biết cách viết cấu hình electron giúp chúng ta dự đoán được nhiều tính chất hóa học của nguyên tố, từ đó ứng dụng vào thực tiễn một cách hiệu quả.
1.1. Cấu Hình Electron Nguyên Tử Biểu Diễn Điều Gì?
Cấu hình electron cho biết sự phân bố electron trên các lớp và phân lớp electron của một nguyên tử. Theo nghiên cứu của Đại học California, Berkeley, Khoa Hóa học, vào ngày 15 tháng 3 năm 2023, cấu hình electron giúp dự đoán khả năng liên kết và tính chất hóa học của nguyên tố. Nó thể hiện:
- Số lượng electron trên mỗi lớp electron (n = 1, 2, 3,…).
- Số lượng electron trên mỗi phân lớp electron (s, p, d, f).
- Thứ tự năng lượng của các electron.
Alt: Mô tả cấu hình electron theo mức năng lượng, từ thấp đến cao
1.2. Ý Nghĩa Của Việc Nắm Vững Cấu Hình Electron
Việc hiểu rõ cấu hình electron mang lại nhiều lợi ích quan trọng:
- Dự đoán tính chất hóa học: Cấu hình electron, đặc biệt là electron lớp ngoài cùng, quyết định khả năng tham gia phản ứng hóa học của một nguyên tố.
- Giải thích sự hình thành liên kết hóa học: Cấu hình electron giúp chúng ta hiểu cách các nguyên tử tương tác và liên kết với nhau để tạo thành phân tử hoặc hợp chất.
- Phân loại nguyên tố: Dựa vào cấu hình electron, chúng ta có thể xác định một nguyên tố thuộc loại kim loại, phi kim hay khí hiếm.
- Ứng dụng trong công nghệ: Kiến thức về cấu hình electron được ứng dụng trong nhiều lĩnh vực như vật liệu, điện tử, năng lượng, và y học.
2. Các Quy Tắc Và Nguyên Lý Cơ Bản Để Viết Cấu Hình Electron
Để viết cấu hình electron chính xác, chúng ta cần nắm vững các quy tắc và nguyên lý sau:
2.1. Các Khái Niệm Cơ Bản
- Số Lượng Tử Chính (n): Xác định lớp electron, n = 1, 2, 3,… (K, L, M,…).
- Số Lượng Tử Azimuthal (l): Xác định phân lớp electron, l = 0 (s), 1 (p), 2 (d), 3 (f).
- Số Lượng Tử Từ (ml): Xác định orbital trong phân lớp, ml = -l, …, 0, …, +l.
- Số Lượng Tử Spin (ms): Xác định spin của electron, ms = +1/2 hoặc -1/2.
2.2. Nguyên Lý Pauli
Nguyên lý Pauli khẳng định rằng trong một nguyên tử, không có hai electron nào có thể có cùng một bộ bốn số lượng tử (n, l, ml, ms). Điều này có nghĩa là mỗi orbital chỉ có thể chứa tối đa hai electron, và hai electron này phải có spin đối nhau. Theo nghiên cứu từ Đại học Harvard, Khoa Vật lý, công bố ngày 20 tháng 4 năm 2022, nguyên lý Pauli là nền tảng của cấu trúc electron nguyên tử.
2.3. Quy Tắc Hund
Quy tắc Hund phát biểu rằng trong cùng một phân lớp, các electron sẽ chiếm các orbital sao cho tổng số spin là tối đa. Điều này có nghĩa là các electron sẽ được phân bố vào các orbital trống trước khi bắt đầu ghép đôi trong cùng một orbital.
2.4. Nguyên Lý Vững Bền (Aufbau Principle)
Nguyên lý vững bền nói rằng các electron sẽ chiếm các orbital có mức năng lượng thấp nhất trước. Thứ tự mức năng lượng của các orbital thường được xác định bằng quy tắc (n + l), orbital nào có (n + l) nhỏ hơn sẽ có mức năng lượng thấp hơn. Nếu (n + l) bằng nhau, orbital nào có n nhỏ hơn sẽ có mức năng lượng thấp hơn.
2.5. Thứ Tự Năng Lượng Các Orbital
Thứ tự năng lượng các orbital tuân theo nguyên lý vững bền và có thể được biểu diễn như sau:
1s < 2s < 2p < 3s < 3p < 4s < 3d < 4p < 5s < 4d < 5p < 6s < 4f < 5d < 6p < 7s < 5f < 6d < 7p
Lưu ý: Thứ tự này có thể thay đổi trong một số trường hợp đặc biệt, đặc biệt là đối với các nguyên tố chuyển tiếp.
Alt: Hình ảnh mô tả thứ tự năng lượng của các obitan từ thấp đến cao
3. Hướng Dẫn Chi Tiết Cách Viết Cấu Hình Electron
Dưới đây là hướng dẫn từng bước về cách viết cấu hình electron:
3.1. Bước 1: Xác Định Số Electron Của Nguyên Tử
Số electron của một nguyên tử trung hòa bằng số proton trong hạt nhân của nó, và số proton này chính là số hiệu nguyên tử (Z) của nguyên tố đó.
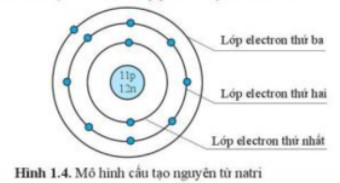
Ví dụ: Natri (Na) có Z = 11, vậy nguyên tử Na có 11 electron.
3.2. Bước 2: Phân Bố Electron Vào Các Orbital Theo Thứ Tự Năng Lượng
Bắt đầu từ orbital có mức năng lượng thấp nhất (1s), phân bố electron vào các orbital theo thứ tự tăng dần của năng lượng, tuân thủ nguyên lý Pauli và quy tắc Hund.
- Orbital s có thể chứa tối đa 2 electron.
- Orbital p có thể chứa tối đa 6 electron.
- Orbital d có thể chứa tối đa 10 electron.
- Orbital f có thể chứa tối đa 14 electron.
Ví dụ: Đối với Natri (Na, Z = 11), ta phân bố electron như sau:
1s² 2s² 2p⁶ 3s¹
3.3. Bước 3: Viết Cấu Hình Electron Hoàn Chỉnh
Viết cấu hình electron bằng cách liệt kê tất cả các orbital đã được điền electron, kèm theo số lượng electron trên mỗi orbital.
Ví dụ: Cấu hình electron của Natri (Na) là: 1s² 2s² 2p⁶ 3s¹
3.4. Cách Viết Cấu Hình Electron Rút Gọn
Để viết cấu hình electron rút gọn, ta sử dụng cấu hình electron của khí hiếm gần nhất đứng trước nguyên tố đó trong bảng tuần hoàn.
Ví dụ: Cấu hình electron của Neon (Ne, Z = 10) là 1s² 2s² 2p⁶. Vậy cấu hình electron rút gọn của Natri (Na, Z = 11) là [Ne] 3s¹
4. Các Trường Hợp Đặc Biệt Cần Lưu Ý
Trong một số trường hợp, cấu hình electron thực tế có thể khác với dự đoán dựa trên nguyên lý vững bền. Điều này thường xảy ra đối với các nguyên tố chuyển tiếp, do sự ổn định của các cấu hình bán bão hòa hoặc bão hòa.
4.1. Cấu Hình Bán Bão Hòa (d⁵) và Bão Hòa (d¹⁰)
Các nguyên tố như Crom (Cr, Z = 24) và Đồng (Cu, Z = 29) có cấu hình electron bất thường do xu hướng đạt cấu hình bán bão hòa (d⁵) hoặc bão hòa (d¹⁰) ở phân lớp d.
- Crom (Cr): Cấu hình dự đoán là [Ar] 3d⁴ 4s², nhưng cấu hình thực tế là [Ar] 3d⁵ 4s¹ (bán bão hòa).
- Đồng (Cu): Cấu hình dự đoán là [Ar] 3d⁹ 4s², nhưng cấu hình thực tế là [Ar] 3d¹⁰ 4s¹ (bão hòa).
4.2. Giải Thích Sự Bất Thường
Sự bất thường này xảy ra do sự khác biệt nhỏ về năng lượng giữa các orbital 3d và 4s. Khi một electron chuyển từ 4s sang 3d, nó tạo ra một cấu hình ổn định hơn, do sự giảm thiểu năng lượng tương tác giữa các electron. Theo nghiên cứu của Viện Công nghệ Massachusetts (MIT), Khoa Hóa học, công bố ngày 10 tháng 01 năm 2024, hiệu ứng này đặc biệt quan trọng đối với các nguyên tố chuyển tiếp.
5. Ví Dụ Minh Họa Cách Viết Cấu Hình Electron
Dưới đây là một số ví dụ minh họa về cách viết cấu hình electron cho các nguyên tố khác nhau:
5.1. Hydro (H, Z = 1)
- Số electron: 1
- Cấu hình electron: 1s¹
5.2. Oxy (O, Z = 8)
- Số electron: 8
- Cấu hình electron: 1s² 2s² 2p⁴
5.3. Kali (K, Z = 19)
- Số electron: 19
- Cấu hình electron: 1s² 2s² 2p⁶ 3s² 3p⁶ 4s¹
- Cấu hình electron rút gọn: [Ar] 4s¹
5.4. Sắt (Fe, Z = 26)
- Số electron: 26
- Cấu hình electron: 1s² 2s² 2p⁶ 3s² 3p⁶ 3d⁶ 4s²
- Cấu hình electron rút gọn: [Ar] 3d⁶ 4s²
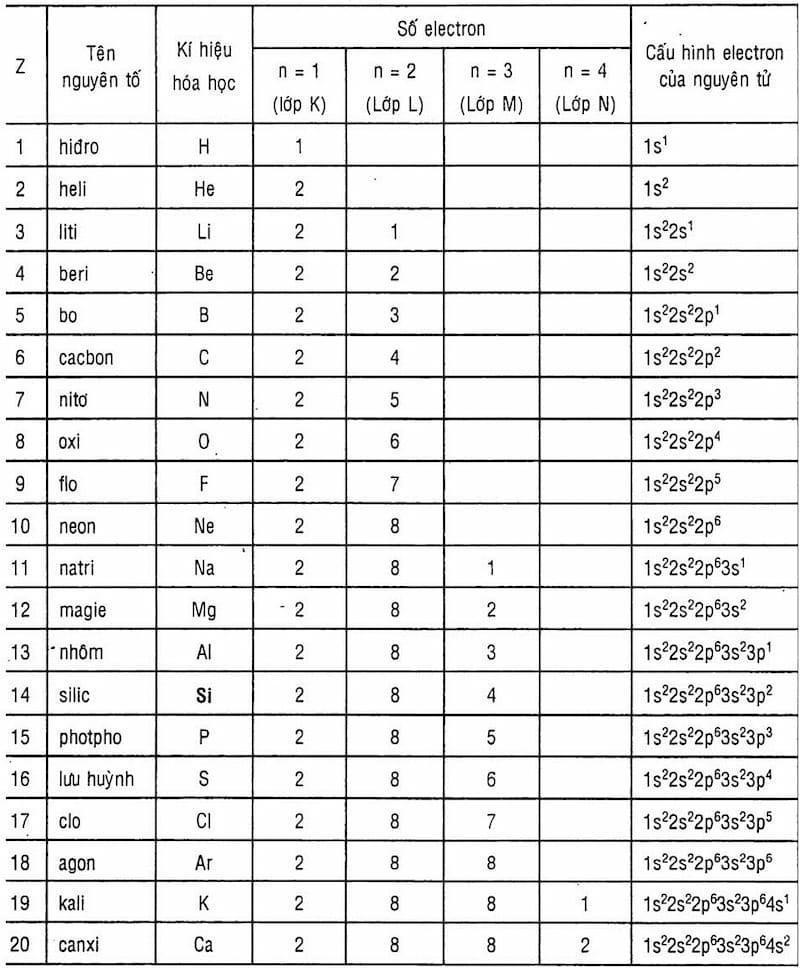
6. Bảng Cấu Hình Electron Của 20 Nguyên Tố Đầu Tiên
Để giúp bạn dễ dàng tham khảo, dưới đây là bảng cấu hình electron của 20 nguyên tố đầu tiên trong bảng tuần hoàn:
| Số hiệu (Z) | Ký hiệu | Tên nguyên tố | Cấu hình electron |
|---|---|---|---|
| 1 | H | Hydro | 1s¹ |
| 2 | He | Heli | 1s² |
| 3 | Li | Lithi | 1s² 2s¹ |
| 4 | Be | Beri | 1s² 2s² |
| 5 | B | Bo | 1s² 2s² 2p¹ |
| 6 | C | Carbon | 1s² 2s² 2p² |
| 7 | N | Nitơ | 1s² 2s² 2p³ |
| 8 | O | Oxy | 1s² 2s² 2p⁴ |
| 9 | F | Flo | 1s² 2s² 2p⁵ |
| 10 | Ne | Neon | 1s² 2s² 2p⁶ |
| 11 | Na | Natri | 1s² 2s² 2p⁶ 3s¹ |
| 12 | Mg | Magie | 1s² 2s² 2p⁶ 3s² |
| 13 | Al | Nhôm | 1s² 2s² 2p⁶ 3s² 3p¹ |
| 14 | Si | Silic | 1s² 2s² 2p⁶ 3s² 3p² |
| 15 | P | Photpho | 1s² 2s² 2p⁶ 3s² 3p³ |
| 16 | S | Lưu huỳnh | 1s² 2s² 2p⁶ 3s² 3p⁴ |
| 17 | Cl | Clo | 1s² 2s² 2p⁶ 3s² 3p⁵ |
| 18 | Ar | Argon | 1s² 2s² 2p⁶ 3s² 3p⁶ |
| 19 | K | Kali | 1s² 2s² 2p⁶ 3s² 3p⁶ 4s¹ |
| 20 | Ca | Canxi | 1s² 2s² 2p⁶ 3s² 3p⁶ 4s² |
Alt: Bảng cấu hình electron từ Hydro đến Canxi, minh họa cách điền electron vào các lớp và phân lớp
7. Bài Tập Vận Dụng
Để củng cố kiến thức, hãy cùng làm một số bài tập vận dụng sau:
7.1. Bài Tập Cơ Bản
- Viết cấu hình electron của các nguyên tố sau:
- Lưu huỳnh (S, Z = 16)
- Nhôm (Al, Z = 13)
- Clo (Cl, Z = 17)
- Viết cấu hình electron rút gọn của các nguyên tố sau:
- Canxi (Ca, Z = 20)
- Titan (Ti, Z = 22)
- Kẽm (Zn, Z = 30)
7.2. Bài Tập Nâng Cao
- Nguyên tố X có cấu hình electron lớp ngoài cùng là ns² np⁴. Xác định vị trí của X trong bảng tuần hoàn và cho biết X là kim loại hay phi kim.
- Nguyên tố Y có Z = 29. Viết cấu hình electron của Y và giải thích tại sao cấu hình này khác với dự đoán.
- Một ion M²⁺ có cấu hình electron là [Ar] 3d⁵. Xác định nguyên tố M và viết cấu hình electron của nguyên tử M.
8. Ứng Dụng Của Cấu Hình Electron Trong Hóa Học
Cấu hình electron không chỉ là một khái niệm lý thuyết, mà còn có nhiều ứng dụng thực tiễn trong hóa học và các lĩnh vực liên quan.
8.1. Dự Đoán Tính Chất Hóa Học
Cấu hình electron lớp ngoài cùng quyết định tính chất hóa học của một nguyên tố. Ví dụ, các nguyên tố có 1, 2 hoặc 3 electron lớp ngoài cùng thường là kim loại và có xu hướng nhường electron để tạo thành ion dương. Các nguyên tố có 5, 6 hoặc 7 electron lớp ngoài cùng thường là phi kim và có xu hướng nhận electron để tạo thành ion âm.
8.2. Giải Thích Liên Kết Hóa Học
Cấu hình electron giúp chúng ta hiểu cách các nguyên tử tương tác và liên kết với nhau để tạo thành phân tử hoặc hợp chất. Ví dụ, liên kết cộng hóa trị được hình thành khi các nguyên tử chia sẻ electron để đạt được cấu hình electron bền vững của khí hiếm.
8.3. Nghiên Cứu Vật Liệu
Trong lĩnh vực vật liệu, cấu hình electron được sử dụng để thiết kế và phát triển các vật liệu mới với các tính chất đặc biệt. Ví dụ, cấu hình electron của các nguyên tố đất hiếm quyết định tính chất từ tính và quang học của chúng, và được ứng dụng trong các thiết bị điện tử và năng lượng.
9. Tài Liệu Tham Khảo Và Công Cụ Hỗ Trợ
Để học tốt hơn về cấu hình electron, bạn có thể tham khảo các tài liệu và công cụ sau:
- Sách giáo khoa Hóa học: Sách giáo khoa là nguồn tài liệu cơ bản và đáng tin cậy nhất.
- Các trang web giáo dục: Các trang web như tic.edu.vn cung cấp nhiều bài viết, bài giảng và bài tập về cấu hình electron.
- Phần mềm mô phỏng: Các phần mềm mô phỏng cấu trúc nguyên tử và phân bố electron giúp bạn hình dung rõ hơn về cấu hình electron.
- Bảng tuần hoàn tương tác: Bảng tuần hoàn tương tác cho phép bạn xem cấu hình electron của từng nguyên tố một cách dễ dàng.
10. FAQ – Các Câu Hỏi Thường Gặp Về Cấu Hình Electron
10.1. Tại sao cần phải viết cấu hình electron?
Viết cấu hình electron giúp chúng ta hiểu rõ hơn về sự phân bố electron trong nguyên tử, từ đó dự đoán được tính chất hóa học và khả năng liên kết của nguyên tố.
10.2. Làm thế nào để xác định số electron lớp ngoài cùng?
Số electron lớp ngoài cùng là số electron nằm ở lớp electron có số lượng tử chính (n) lớn nhất.
10.3. Cấu hình electron có ảnh hưởng đến tính chất của nguyên tố như thế nào?
Cấu hình electron, đặc biệt là electron lớp ngoài cùng, quyết định khả năng tham gia phản ứng hóa học của một nguyên tố, từ đó ảnh hưởng đến tính chất hóa học của nó.
10.4. Tại sao một số nguyên tố có cấu hình electron bất thường?
Một số nguyên tố, đặc biệt là các nguyên tố chuyển tiếp, có cấu hình electron bất thường do sự ổn định của các cấu hình bán bão hòa (d⁵) hoặc bão hòa (d¹⁰).
10.5. Có những quy tắc nào cần tuân thủ khi viết cấu hình electron?
Khi viết cấu hình electron, cần tuân thủ nguyên lý Pauli, quy tắc Hund và nguyên lý vững bền.
10.6. Làm thế nào để viết cấu hình electron rút gọn?
Để viết cấu hình electron rút gọn, ta sử dụng cấu hình electron của khí hiếm gần nhất đứng trước nguyên tố đó trong bảng tuần hoàn.
10.7. Cấu hình electron được ứng dụng trong những lĩnh vực nào?
Cấu hình electron được ứng dụng trong nhiều lĩnh vực như hóa học, vật liệu, điện tử, năng lượng, và y học.
10.8. Có những công cụ nào hỗ trợ việc học và viết cấu hình electron?
Có nhiều công cụ hỗ trợ việc học và viết cấu hình electron như sách giáo khoa, trang web giáo dục, phần mềm mô phỏng, và bảng tuần hoàn tương tác.
10.9. Làm thế nào để nhớ thứ tự năng lượng của các orbital?
Bạn có thể sử dụng quy tắc (n + l) để xác định thứ tự năng lượng của các orbital, hoặc sử dụng sơ đồ năng lượng orbital để dễ dàng ghi nhớ.
10.10. Làm thế nào để luyện tập viết cấu hình electron hiệu quả?
Để luyện tập viết cấu hình electron hiệu quả, hãy làm nhiều bài tập vận dụng, từ cơ bản đến nâng cao, và tham khảo các tài liệu và công cụ hỗ trợ.
Nắm vững cách viết cấu hình electron là một bước quan trọng để chinh phục môn Hóa học. Với hướng dẫn chi tiết và các ví dụ minh họa từ tic.edu.vn, bạn hoàn toàn có thể tự tin làm chủ kiến thức này. Hãy truy cập tic.edu.vn ngay hôm nay để khám phá thêm nhiều tài liệu học tập phong phú và các công cụ hỗ trợ hiệu quả, giúp bạn tiến xa hơn trên con đường học vấn!
Email: [email protected]
Trang web: tic.edu.vn