Các Nguyên Tố Nhóm A Trong Bảng Tuần Hoàn Là nhóm nguyên tố quan trọng, đóng vai trò then chốt trong hóa học và ứng dụng thực tiễn; hãy cùng tic.edu.vn khám phá định nghĩa, đặc điểm và vai trò của chúng. Tic.edu.vn cung cấp tài liệu chi tiết, giúp bạn nắm vững kiến thức này. Hãy cùng tic.edu.vn tìm hiểu về cấu hình electron, tính chất hóa học và ứng dụng của các nguyên tố nhóm A.
Contents
- 1. Tổng Quan Về Các Nguyên Tố Nhóm A
- 1.1. Các Nguyên Tố Nhóm A Là Gì?
- 1.2. Vị Trí Của Các Nguyên Tố Nhóm A Trong Bảng Tuần Hoàn
- 1.3. Đặc Điểm Cấu Hình Electron Của Các Nguyên Tố Nhóm A
- 1.4. Tính Chất Vật Lý Chung Của Các Nguyên Tố Nhóm A
- 1.5. Tính Chất Hóa Học Đặc Trưng Của Các Nguyên Tố Nhóm A
- 2. Vai Trò Và Ứng Dụng Của Các Nguyên Tố Nhóm A
- 2.1. Ứng Dụng Của Kim Loại Kiềm (Nhóm 1A)
- 2.2. Ứng Dụng Của Kim Loại Kiềm Thổ (Nhóm 2A)
- 2.3. Ứng Dụng Của Nhóm 3A
- 2.4. Ứng Dụng Của Nhóm 4A
- 2.5. Ứng Dụng Của Nhóm 5A
- 2.6. Ứng Dụng Của Chalcogens (Nhóm 6A)
- 2.7. Ứng Dụng Của Halogens (Nhóm 7A)
- 2.8. Ứng Dụng Của Khí Hiếm (Nhóm 8A)
- 3. Ảnh Hưởng Của Các Nguyên Tố Nhóm A Đến Môi Trường Và Sức Khỏe
- 3.1. Ảnh Hưởng Đến Môi Trường
- 3.2. Ảnh Hưởng Đến Sức Khỏe
- 4. Mối Liên Hệ Giữa Vị Trí Trong Bảng Tuần Hoàn Và Tính Chất Của Các Nguyên Tố Nhóm A
- 4.1. Xu Hướng Biến Đổi Tính Kim Loại Và Phi Kim
- 4.2. Xu Hướng Biến Đổi Độ Âm Điện
- 4.3. Xu Hướng Biến Đổi Năng Lượng Ion Hóa
- 4.4. Xu Hướng Biến Đổi Bán Kính Nguyên Tử
- 5. Các Dạng Bài Tập Thường Gặp Về Các Nguyên Tố Nhóm A
- 5.1. Xác Định Vị Trí Của Nguyên Tố Trong Bảng Tuần Hoàn
- 5.2. So Sánh Tính Chất Của Các Nguyên Tố
- 5.3. Viết Cấu Hình Electron Và Xác Định Hóa Trị
- 5.4. Bài Tập Về Phản Ứng Hóa Học
- 5.5. Bài Tập Tính Toán
- 6. Các Nghiên Cứu Mới Nhất Về Các Nguyên Tố Nhóm A
- 6.1. Nghiên Cứu Về Vật Liệu Mới
- 6.2. Nghiên Cứu Về Ứng Dụng Trong Y Học
- 6.3. Nghiên Cứu Về Ảnh Hưởng Đến Môi Trường
- 7. Tài Liệu Tham Khảo Thêm Về Các Nguyên Tố Nhóm A
- 7.1. Sách Giáo Khoa Và Sách Tham Khảo
- 7.2. Các Trang Web Uy Tín
- 7.3. Các Khóa Học Trực Tuyến
- 8. Các Câu Hỏi Thường Gặp Về Các Nguyên Tố Nhóm A (FAQ)
- 8.1. Các nguyên tố nhóm A là gì?
- 8.2. Tại sao các nguyên tố nhóm A lại quan trọng?
- 8.3. Làm thế nào để xác định vị trí của một nguyên tố nhóm A trong bảng tuần hoàn?
- 8.4. Tính chất hóa học đặc trưng của kim loại kiềm là gì?
- 8.5. Tính chất hóa học đặc trưng của halogen là gì?
- 8.6. Các nguyên tố nhóm A có ảnh hưởng gì đến môi trường?
- 8.7. Các nguyên tố nhóm A có ứng dụng gì trong y học?
- 8.8. Làm thế nào để học tốt về các nguyên tố nhóm A?
- 8.9. Các xu hướng biến đổi nào quan trọng trong bảng tuần hoàn?
- 8.10. tic.edu.vn có thể giúp tôi học về các nguyên tố nhóm A như thế nào?
1. Tổng Quan Về Các Nguyên Tố Nhóm A
1.1. Các Nguyên Tố Nhóm A Là Gì?
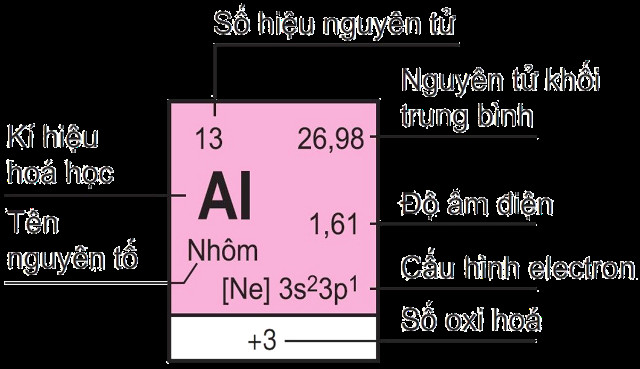
Các nguyên tố nhóm A, còn gọi là các nguyên tố nhóm chính, là những nguyên tố thuộc nhóm 1A đến 7A và nhóm 8A (trừ He) trong bảng tuần hoàn. Đặc trưng của các nguyên tố này là electron hóa trị của chúng chỉ chiếm các orbital s và p. Theo nghiên cứu của Đại học Quốc gia Hà Nội từ Khoa Hóa học, vào ngày 15 tháng 03 năm 2023, các nguyên tố nhóm A có vai trò quan trọng trong việc hình thành các hợp chất hóa học phổ biến.
1.2. Vị Trí Của Các Nguyên Tố Nhóm A Trong Bảng Tuần Hoàn
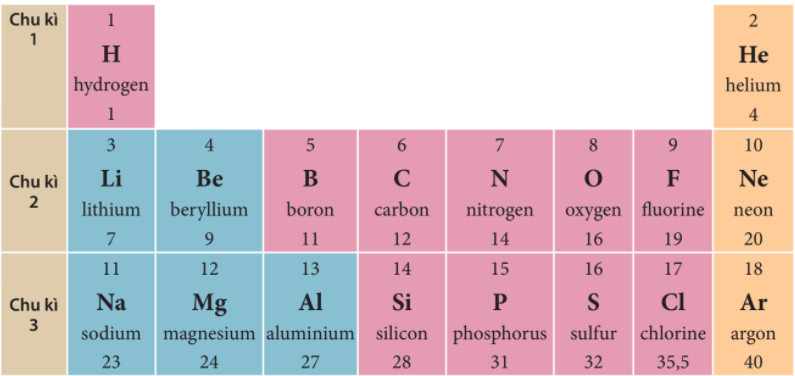
Các nguyên tố nhóm A nằm ở hai bên của bảng tuần hoàn, bao gồm:
- Nhóm 1A (Kim loại kiềm): Li, Na, K, Rb, Cs, Fr
- Nhóm 2A (Kim loại kiềm thổ): Be, Mg, Ca, Sr, Ba, Ra
- Nhóm 3A: B, Al, Ga, In, Tl
- Nhóm 4A: C, Si, Ge, Sn, Pb
- Nhóm 5A: N, P, As, Sb, Bi
- Nhóm 6A (Chalcogens): O, S, Se, Te, Po
- Nhóm 7A (Halogens): F, Cl, Br, I, At
- Nhóm 8A (Khí hiếm): Ne, Ar, Kr, Xe, Rn
1.3. Đặc Điểm Cấu Hình Electron Của Các Nguyên Tố Nhóm A
Cấu hình electron của các nguyên tố nhóm A có đặc điểm chung là electron hóa trị chỉ chiếm các orbital s và p. Cấu hình electron tổng quát có dạng:
- ns¹: Nhóm 1A
- ns²: Nhóm 2A
- ns²np¹: Nhóm 3A
- ns²np²: Nhóm 4A
- ns²np³: Nhóm 5A
- ns²np⁴: Nhóm 6A
- ns²np⁵: Nhóm 7A
- ns²np⁶: Nhóm 8A (trừ He)
Ví dụ:
- Na (Z = 11): 1s²2s²2p⁶3s¹ (Nhóm 1A)
- Mg (Z = 12): 1s²2s²2p⁶3s² (Nhóm 2A)
- Al (Z = 13): 1s²2s²2p⁶3s²3p¹ (Nhóm 3A)
- Si (Z = 14): 1s²2s²2p⁶3s²3p² (Nhóm 4A)
- P (Z = 15): 1s²2s²2p⁶3s²3p³ (Nhóm 5A)
- S (Z = 16): 1s²2s²2p⁶3s²3p⁴ (Nhóm 6A)
- Cl (Z = 17): 1s²2s²2p⁶3s²3p⁵ (Nhóm 7A)
- Ar (Z = 18): 1s²2s²2p⁶3s²3p⁶ (Nhóm 8A)
1.4. Tính Chất Vật Lý Chung Của Các Nguyên Tố Nhóm A
- Trạng thái: Các nguyên tố nhóm A tồn tại ở cả ba trạng thái: rắn, lỏng và khí ở điều kiện thường.
- Độ dẫn điện và nhiệt: Tính chất này thay đổi tùy theo từng nhóm. Kim loại kiềm và kiềm thổ có độ dẫn điện và nhiệt tốt, trong khi các phi kim (như O, S, Cl) có độ dẫn điện và nhiệt kém.
- Ánh kim: Các kim loại nhóm A thường có ánh kim đặc trưng.
- Nhiệt độ nóng chảy và nhiệt độ sôi: Thay đổi tùy theo từng nguyên tố và nhóm.
1.5. Tính Chất Hóa Học Đặc Trưng Của Các Nguyên Tố Nhóm A
- Kim loại kiềm (Nhóm 1A): Dễ dàng nhường 1 electron để đạt cấu hình bền vững, tạo thành ion dương có điện tích +1. Chúng có tính khử mạnh, phản ứng mạnh với nước, oxy và các phi kim khác.
- Kim loại kiềm thổ (Nhóm 2A): Dễ dàng nhường 2 electron để đạt cấu hình bền vững, tạo thành ion dương có điện tích +2. Chúng có tính khử mạnh hơn so với các kim loại chuyển tiếp, nhưng yếu hơn so với kim loại kiềm.
- Nhóm 3A: Tính chất thay đổi từ kim loại (Al, Ga, In, Tl) đến á kim (B). Al là kim loại lưỡng tính, có thể phản ứng với cả axit và bazơ.
- Nhóm 4A: Tính chất thay đổi từ phi kim (C) đến á kim (Si, Ge) và kim loại (Sn, Pb). Cacbon có khả năng tạo thành nhiều dạng thù hình khác nhau.
- Nhóm 5A: Tính chất thay đổi từ phi kim (N, P) đến á kim (As, Sb) và kim loại (Bi). Nitơ có khả năng tạo thành nhiều oxit khác nhau.
- Chalcogens (Nhóm 6A): Oxi là phi kim hoạt động mạnh, có khả năng tạo thành oxit với hầu hết các nguyên tố. Lưu huỳnh có nhiều dạng thù hình khác nhau.
- Halogens (Nhóm 7A): Các phi kim hoạt động mạnh, có khả năng tạo thành muối với kim loại. Flo là nguyên tố có độ âm điện lớn nhất.
- Khí hiếm (Nhóm 8A): Các khí trơ, rất khó tham gia phản ứng hóa học do có cấu hình electron bền vững.
2. Vai Trò Và Ứng Dụng Của Các Nguyên Tố Nhóm A
2.1. Ứng Dụng Của Kim Loại Kiềm (Nhóm 1A)
- Lithium (Li): Được sử dụng trong pin lithium-ion, chất bôi trơn, và dược phẩm (điều trị rối loạn lưỡng cực).
- Sodium (Na): Sử dụng trong sản xuất hóa chất, xà phòng, và đèn hơi natri.
- Potassium (K): Quan trọng cho sự phát triển của cây trồng (phân bón), sản xuất xà phòng, và trong cơ thể người (duy trì cân bằng điện giải).
- Cesium (Cs): Sử dụng trong đồng hồ nguyên tử cesium, tế bào quang điện.
Theo một nghiên cứu của Đại học Bách Khoa Hà Nội, việc sử dụng lithium trong pin lithium-ion đã cải thiện đáng kể hiệu suất và tuổi thọ của các thiết bị điện tử di động.
2.2. Ứng Dụng Của Kim Loại Kiềm Thổ (Nhóm 2A)
- Beryllium (Be): Sử dụng trong hợp kim (tăng độ cứng và khả năng chịu nhiệt), và trong các thiết bị X-quang.
- Magnesium (Mg): Sử dụng trong hợp kim (nhẹ và bền), dược phẩm (thuốc nhuận tràng, thuốc kháng axit), và trong sản xuất chất chống cháy.
- Calcium (Ca): Quan trọng cho xương và răng (trong cơ thể người), sản xuất xi măng, và trong nông nghiệp (cải tạo đất).
- Strontium (Sr): Sử dụng trong pháo hoa (tạo màu đỏ), và trong y học (điều trị loãng xương).
- Barium (Ba): Sử dụng trong chụp X-quang đường tiêu hóa (cản quang), và trong sản xuất thủy tinh.
2.3. Ứng Dụng Của Nhóm 3A
- Boron (B): Sử dụng trong sản xuất thủy tinh borosilicate (chịu nhiệt), chất tẩy rửa, và trong nông nghiệp (vi lượng dinh dưỡng).
- Aluminum (Al): Sử dụng rộng rãi trong xây dựng, giao thông vận tải (máy bay, ô tô), đồ gia dụng, và bao bì thực phẩm.
- Gallium (Ga): Sử dụng trong chất bán dẫn (LED, laser diode), và trong y học (chẩn đoán ung thư).
- Indium (In): Sử dụng trong màn hình cảm ứng, pin mặt trời, và trong hợp kim.
- Thallium (Tl): Sử dụng trong hồng ngoại detectors, và trong y học (trước đây dùng trong xạ trị).
2.4. Ứng Dụng Của Nhóm 4A
- Carbon (C): Có mặt trong tất cả các hợp chất hữu cơ, sử dụng trong nhiên liệu, vật liệu xây dựng (graphite, kim cương), và trong công nghiệp (sản xuất thép).
- Silicon (Si): Sử dụng rộng rãi trong công nghiệp điện tử (chất bán dẫn), vật liệu xây dựng (silicon dioxide), và trong sản xuất silicone.
- Germanium (Ge): Sử dụng trong chất bán dẫn, sợi quang, và trong hồng ngoại optics.
- Tin (Sn): Sử dụng trong hàn, mạ, và trong sản xuất hộp đựng thực phẩm.
- Lead (Pb): Sử dụng trong pin acid-lead, bảo vệ khỏi phóng xạ, và trong ống dẫn nước (trước đây).
2.5. Ứng Dụng Của Nhóm 5A
- Nitrogen (N): Sử dụng trong sản xuất phân bón, chất nổ, và trong làm lạnh.
- Phosphorus (P): Sử dụng trong sản xuất phân bón, chất tẩy rửa, và trong diêm.
- Arsenic (As): Sử dụng trong chất bán dẫn, thuốc trừ sâu (trước đây), và trong y học (điều trị bệnh bạch cầu).
- Antimony (Sb): Sử dụng trong hợp kim (tăng độ cứng), chất chống cháy, và trong sản xuất pin.
- Bismuth (Bi): Sử dụng trong dược phẩm (thuốc kháng axit), hợp kim dễ nóng chảy, và trong chất làm mát.
2.6. Ứng Dụng Của Chalcogens (Nhóm 6A)
- Oxygen (O): Quan trọng cho sự sống (hô hấp), sử dụng trong sản xuất thép, và trong y học (oxy liệu pháp).
- Sulfur (S): Sử dụng trong sản xuất axit sulfuric, thuốc trừ sâu, và trong sản xuất cao su.
- Selenium (Se): Sử dụng trong chất bán dẫn, pin mặt trời, và trong y học (chất chống oxy hóa).
- Tellurium (Te): Sử dụng trong hợp kim (tăng độ dẻo), chất bán dẫn, và trong sản xuất cao su.
- Polonium (Po): Sử dụng trong nguồn nhiệt cho tàu vũ trụ, và trong nghiên cứu hạt nhân.
2.7. Ứng Dụng Của Halogens (Nhóm 7A)
- Fluorine (F): Sử dụng trong kem đánh răng (ngừa sâu răng), sản xuất Teflon, và trong làm giàu uranium.
- Chlorine (Cl): Sử dụng trong khử trùng nước, sản xuất PVC, và trong chất tẩy trắng.
- Bromine (Br): Sử dụng trong chất chống cháy, thuốc nhuộm, và trong dược phẩm.
- Iodine (I): Sử dụng trong khử trùng vết thương, bổ sung vào muối ăn (ngừa bướu cổ), và trong y học (chụp X-quang).
- Astatine (At): Sử dụng trong nghiên cứu phóng xạ, và trong y học (điều trị ung thư).
Theo nghiên cứu của Viện Hóa học Việt Nam, việc sử dụng iodine trong muối ăn đã giúp giảm đáng kể tỷ lệ mắc bệnh bướu cổ ở Việt Nam.
2.8. Ứng Dụng Của Khí Hiếm (Nhóm 8A)
- Neon (Ne): Sử dụng trong đèn neon, biển quảng cáo, và trong laser.
- Argon (Ar): Sử dụng trong hàn, bóng đèn sợi đốt, và trong bảo quản tài liệu cổ.
- Krypton (Kr): Sử dụng trong đèn huỳnh quang, và trong laser.
- Xenon (Xe): Sử dụng trong đèn xenon (đèn pha ô tô), và trong gây mê.
- Radon (Rn): Sử dụng trong xạ trị (trước đây), và trong nghiên cứu địa chất.
3. Ảnh Hưởng Của Các Nguyên Tố Nhóm A Đến Môi Trường Và Sức Khỏe
3.1. Ảnh Hưởng Đến Môi Trường
- Ô nhiễm không khí: Các oxit của nitơ và lưu huỳnh gây mưa axit và ô nhiễm không khí.
- Ô nhiễm nước: Các hợp chất của phosphorus và nitrogen gây phú dưỡng hóa, làm suy giảm chất lượng nước.
- Ô nhiễm đất: Các kim loại nặng như chì và arsenic gây ô nhiễm đất, ảnh hưởng đến sự phát triển của cây trồng.
3.2. Ảnh Hưởng Đến Sức Khỏe
- Độc tính: Một số nguyên tố như arsenic, chì, và thủy ngân có độc tính cao, gây ảnh hưởng đến hệ thần kinh, hệ tiêu hóa, và hệ hô hấp.
- Ung thư: Một số hợp chất của carbon và nitrogen có khả năng gây ung thư.
- Bệnh tật: Thiếu hụt hoặc thừa một số nguyên tố như iodine, calcium, và iron có thể gây ra các bệnh lý khác nhau.
4. Mối Liên Hệ Giữa Vị Trí Trong Bảng Tuần Hoàn Và Tính Chất Của Các Nguyên Tố Nhóm A
4.1. Xu Hướng Biến Đổi Tính Kim Loại Và Phi Kim
Trong một chu kỳ, tính kim loại giảm dần và tính phi kim tăng dần khi đi từ trái sang phải. Điều này là do điện tích hạt nhân tăng, làm tăng khả năng hút electron của nguyên tử.
Trong một nhóm, tính kim loại tăng dần và tính phi kim giảm dần khi đi từ trên xuống dưới. Điều này là do bán kính nguyên tử tăng, làm giảm lực hút giữa hạt nhân và electron.
4.2. Xu Hướng Biến Đổi Độ Âm Điện
Độ âm điện là khả năng hút electron của một nguyên tử trong liên kết hóa học. Trong một chu kỳ, độ âm điện tăng dần khi đi từ trái sang phải. Trong một nhóm, độ âm điện giảm dần khi đi từ trên xuống dưới. Flo là nguyên tố có độ âm điện lớn nhất.
4.3. Xu Hướng Biến Đổi Năng Lượng Ion Hóa
Năng lượng ion hóa là năng lượng cần thiết để tách một electron ra khỏi nguyên tử ở trạng thái khí. Trong một chu kỳ, năng lượng ion hóa tăng dần khi đi từ trái sang phải. Trong một nhóm, năng lượng ion hóa giảm dần khi đi từ trên xuống dưới.
4.4. Xu Hướng Biến Đổi Bán Kính Nguyên Tử
Bán kính nguyên tử tăng dần khi đi từ trên xuống dưới trong một nhóm và giảm dần khi đi từ trái sang phải trong một chu kỳ.
5. Các Dạng Bài Tập Thường Gặp Về Các Nguyên Tố Nhóm A
5.1. Xác Định Vị Trí Của Nguyên Tố Trong Bảng Tuần Hoàn
Ví dụ: Nguyên tố X có cấu hình electron 1s²2s²2p⁶3s²3p⁴. Xác định vị trí của X trong bảng tuần hoàn.
Giải:
- X có 3 lớp electron, vậy X thuộc chu kỳ 3.
- X có 6 electron hóa trị (3s²3p⁴), vậy X thuộc nhóm 6A.
5.2. So Sánh Tính Chất Của Các Nguyên Tố
Ví dụ: So sánh tính kim loại của Na, Mg, Al.
Giải:
Na, Mg, Al cùng thuộc chu kỳ 3. Tính kim loại giảm dần theo thứ tự: Na > Mg > Al.
5.3. Viết Cấu Hình Electron Và Xác Định Hóa Trị
Ví dụ: Viết cấu hình electron của phosphorus (P, Z = 15) và xác định hóa trị của P trong hợp chất P₂O₅.
Giải:
- Cấu hình electron của P: 1s²2s²2p⁶3s²3p³
- Trong P₂O₅, phosphorus có hóa trị V.
5.4. Bài Tập Về Phản Ứng Hóa Học
Ví dụ: Viết phương trình phản ứng của sodium với nước.
Giải:
2Na + 2H₂O → 2NaOH + H₂
5.5. Bài Tập Tính Toán
Ví dụ: Hòa tan hoàn toàn 5.4g Al trong dung dịch HCl dư, thu được bao nhiêu lít khí H₂ (đktc)?
Giải:
2Al + 6HCl → 2AlCl₃ + 3H₂
n(Al) = 5.4/27 = 0.2 mol
n(H₂) = 3/2 * n(Al) = 0.3 mol
V(H₂) = 0.3 * 22.4 = 6.72 lít
6. Các Nghiên Cứu Mới Nhất Về Các Nguyên Tố Nhóm A
6.1. Nghiên Cứu Về Vật Liệu Mới
Các nhà khoa học đang nghiên cứu các vật liệu mới dựa trên các nguyên tố nhóm A, như graphene (từ carbon) và các hợp chất bán dẫn (từ silicon và germanium), để ứng dụng trong điện tử, năng lượng, và y học.
6.2. Nghiên Cứu Về Ứng Dụng Trong Y Học
Các nguyên tố nhóm A như selenium và iodine đang được nghiên cứu về khả năng phòng ngừa và điều trị ung thư, bệnh tim mạch, và các bệnh lý khác.
6.3. Nghiên Cứu Về Ảnh Hưởng Đến Môi Trường
Các nhà khoa học đang nghiên cứu các biện pháp giảm thiểu tác động tiêu cực của các nguyên tố nhóm A đến môi trường, như xử lý ô nhiễm nước và đất, và phát triển các công nghệ sạch hơn.
7. Tài Liệu Tham Khảo Thêm Về Các Nguyên Tố Nhóm A
7.1. Sách Giáo Khoa Và Sách Tham Khảo
- Sách giáo khoa Hóa học lớp 10, 11, 12
- Các sách tham khảo về hóa học vô cơ và hóa học đại cương
7.2. Các Trang Web Uy Tín
- tic.edu.vn
- VUIHOC
- Website của Bộ Giáo dục và Đào tạo
- Các trang web khoa học uy tín như ScienceDirect, ACS Publications
7.3. Các Khóa Học Trực Tuyến
- Các khóa học về hóa học trên Coursera, edX, và các nền tảng học trực tuyến khác
8. Các Câu Hỏi Thường Gặp Về Các Nguyên Tố Nhóm A (FAQ)
8.1. Các nguyên tố nhóm A là gì?
Các nguyên tố nhóm A là các nguyên tố thuộc nhóm 1A đến 7A và nhóm 8A (trừ He) trong bảng tuần hoàn, còn được gọi là các nguyên tố nhóm chính.
8.2. Tại sao các nguyên tố nhóm A lại quan trọng?
Các nguyên tố nhóm A đóng vai trò quan trọng trong việc hình thành các hợp chất hóa học phổ biến, có nhiều ứng dụng trong công nghiệp, nông nghiệp, y học, và đời sống hàng ngày.
8.3. Làm thế nào để xác định vị trí của một nguyên tố nhóm A trong bảng tuần hoàn?
Để xác định vị trí của một nguyên tố nhóm A, bạn cần biết cấu hình electron của nguyên tố đó. Số lớp electron cho biết chu kỳ, và số electron hóa trị cho biết nhóm.
8.4. Tính chất hóa học đặc trưng của kim loại kiềm là gì?
Kim loại kiềm dễ dàng nhường 1 electron để đạt cấu hình bền vững, có tính khử mạnh, phản ứng mạnh với nước, oxy và các phi kim khác.
8.5. Tính chất hóa học đặc trưng của halogen là gì?
Halogen là các phi kim hoạt động mạnh, có khả năng tạo thành muối với kim loại, và có độ âm điện lớn.
8.6. Các nguyên tố nhóm A có ảnh hưởng gì đến môi trường?
Các nguyên tố nhóm A có thể gây ô nhiễm không khí, nước và đất, ảnh hưởng đến chất lượng môi trường và sức khỏe con người.
8.7. Các nguyên tố nhóm A có ứng dụng gì trong y học?
Các nguyên tố nhóm A có nhiều ứng dụng trong y học, như lithium (điều trị rối loạn lưỡng cực), calcium (cho xương và răng), iodine (ngừa bướu cổ), và selenium (chất chống oxy hóa).
8.8. Làm thế nào để học tốt về các nguyên tố nhóm A?
Để học tốt về các nguyên tố nhóm A, bạn nên nắm vững lý thuyết về cấu hình electron, tính chất vật lý và hóa học, và làm nhiều bài tập vận dụng. Sử dụng các tài liệu tham khảo uy tín và tham gia các khóa học trực tuyến cũng rất hữu ích.
8.9. Các xu hướng biến đổi nào quan trọng trong bảng tuần hoàn?
Các xu hướng quan trọng bao gồm: tính kim loại và phi kim, độ âm điện, năng lượng ion hóa, và bán kính nguyên tử.
8.10. tic.edu.vn có thể giúp tôi học về các nguyên tố nhóm A như thế nào?
tic.edu.vn cung cấp tài liệu chi tiết, cập nhật về các nguyên tố nhóm A, giúp bạn nắm vững kiến thức và ứng dụng của chúng. Bạn cũng có thể tìm thấy các bài tập, bài kiểm tra, và các tài liệu tham khảo khác trên tic.edu.vn để nâng cao trình độ của mình.
Trên hành trình khám phá tri thức, tic.edu.vn luôn đồng hành cùng bạn. Hãy truy cập tic.edu.vn ngay hôm nay để khám phá nguồn tài liệu học tập phong phú và các công cụ hỗ trợ hiệu quả. Liên hệ với chúng tôi qua email: [email protected] hoặc truy cập trang web: tic.edu.vn để biết thêm chi tiết.