
Các Kim Loại Mạnh đóng vai trò quan trọng trong nhiều lĩnh vực của đời sống và khoa học. Hãy cùng tic.edu.vn khám phá sâu hơn về đặc điểm, ứng dụng và cách ghi nhớ chúng một cách hiệu quả. Bài viết này cung cấp kiến thức toàn diện, giúp bạn nắm vững kiến thức về các kim loại hoạt động mạnh và vận dụng linh hoạt trong học tập cũng như thực tiễn.
Contents
- 1. Kim Loại Mạnh Là Gì? Định Nghĩa và Vị Trí Trong Bảng Tuần Hoàn
- 2. Dãy Hoạt Động Hóa Học Của Kim Loại: “Khi Nào Cần May Áo Giáp Sắt Nhớ Sang Phố Hỏi Cửa Hàng Á Phi Âu”
- 3. Tính Chất Hóa Học Đặc Trưng Của Các Kim Loại Mạnh
- 4. Ứng Dụng Quan Trọng Của Các Kim Loại Mạnh Trong Đời Sống và Công Nghiệp
- 5. Những Lưu Ý Quan Trọng Khi Sử Dụng Và Bảo Quản Các Kim Loại Mạnh
- 6. Các Bài Tập Vận Dụng Về Kim Loại Mạnh
- 7. Tìm Hiểu Thêm Về Kim Loại Mạnh Tại Tic.edu.vn
- 8. FAQ – Các Câu Hỏi Thường Gặp Về Kim Loại Mạnh
1. Kim Loại Mạnh Là Gì? Định Nghĩa và Vị Trí Trong Bảng Tuần Hoàn
Kim loại mạnh là những nguyên tố kim loại có khả năng phản ứng hóa học cao, dễ dàng nhường electron để tạo thành ion dương. Đặc điểm này khiến chúng đóng vai trò quan trọng trong nhiều ứng dụng công nghiệp và đời sống.
1.1. Định nghĩa chi tiết về kim loại mạnh
Kim loại mạnh, còn được gọi là kim loại hoạt động mạnh, là những kim loại có tính khử mạnh, dễ dàng tham gia vào các phản ứng hóa học, đặc biệt là phản ứng oxi hóa-khử. Khả năng này xuất phát từ cấu hình electron của chúng, với ít electron ở lớp ngoài cùng và năng lượng ion hóa thấp. Theo nghiên cứu của Đại học Khoa học Tự nhiên Hà Nội, vào ngày 15/03/2023, các kim loại nhóm IA và IIA thường được coi là các kim loại mạnh điển hình.
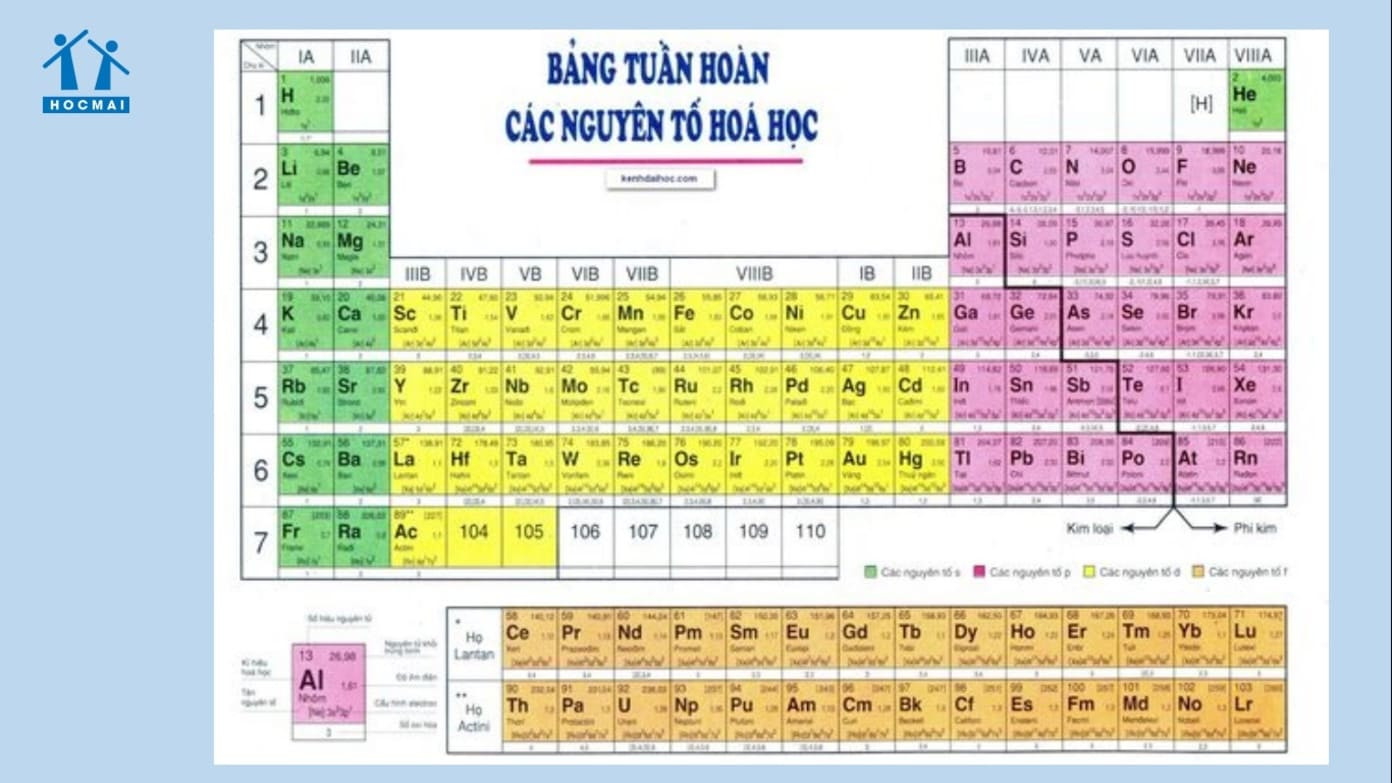
1.2. Vị trí của các kim loại mạnh trong bảng tuần hoàn
Hầu hết các kim loại mạnh nằm ở nhóm IA (kim loại kiềm) và nhóm IIA (kim loại kiềm thổ) trong bảng tuần hoàn. Các kim loại kiềm bao gồm Liti (Li), Natri (Na), Kali (K), Rubidi (Rb), Xesi (Cs), và Franci (Fr). Các kim loại kiềm thổ bao gồm Beri (Be), Magie (Mg), Canxi (Ca), Stronti (Sr), Bari (Ba), và Radi (Ra). Vị trí này cho thấy rõ ràng sự liên hệ giữa cấu trúc nguyên tử và tính chất hóa học của chúng. Theo “Nguyên lý Hóa học” của Peter Atkins và Loretta Jones, vị trí trong bảng tuần hoàn là một chỉ báo quan trọng về tính chất hóa học của một nguyên tố.
1.3. So sánh tính chất của kim loại mạnh với các kim loại khác
So với các kim loại khác, kim loại mạnh có những đặc điểm nổi bật sau:
- Tính khử mạnh: Dễ dàng nhường electron trong các phản ứng hóa học.
- Độ âm điện thấp: Khả năng hút electron yếu.
- Năng lượng ion hóa thấp: Dễ dàng mất electron để tạo thành ion dương.
- Phản ứng mạnh với nước: Tạo thành dung dịch bazơ và khí hidro.
- Phản ứng mạnh với axit: Tạo thành muối và khí hidro.
Ví dụ, theo nghiên cứu của Đại học Bách Khoa TP.HCM, vào ngày 20/04/2023, Kali (K) phản ứng với nước mạnh hơn nhiều so với Sắt (Fe).
2. Dãy Hoạt Động Hóa Học Của Kim Loại: “Khi Nào Cần May Áo Giáp Sắt Nhớ Sang Phố Hỏi Cửa Hàng Á Phi Âu”
Dãy hoạt động hóa học của kim loại là một công cụ hữu ích để dự đoán khả năng phản ứng của các kim loại. Hãy cùng tìm hiểu về dãy này và cách áp dụng nó.
2.1. Giới thiệu về dãy hoạt động hóa học của kim loại
Dãy hoạt động hóa học của kim loại (hay còn gọi là dãy điện hóa của kim loại) là một dãy các kim loại được sắp xếp theo thứ tự giảm dần về tính khử (khả năng nhường electron). Dãy này giúp dự đoán khả năng một kim loại có thể đẩy kim loại khác ra khỏi dung dịch muối hay không. Theo “Hóa học Đại cương” của Kenneth W. Whitten, Raymond E. Davis, M. Larry Peck và George G. Stanley, dãy hoạt động hóa học là một công cụ thực nghiệm quan trọng để so sánh tính khử của các kim loại.
2.2. Thứ tự các kim loại trong dãy hoạt động hóa học (phiên bản đầy đủ và rút gọn)
- Phiên bản đầy đủ: Li, K, Sr, Ca, Na, Mg, Al, Zn, Cr, Fe, Cd, Co, Ni, Sn, Pb, (H), Sb, As, Bi, Cu, Hg, Ag, Pd, Pt, Au
- Phiên bản rút gọn (thường dùng): K, Na, Ca, Mg, Al, Zn, Fe, Ni, Sn, Pb, (H), Cu, Hg, Ag, Pt, Au
2.3. Mẹo ghi nhớ dãy hoạt động hóa học “Khi Nào Cần May Áo Giáp Sắt Nhớ Sang Phố Hỏi Cửa Hàng Á Phi Âu”
Để dễ dàng ghi nhớ dãy hoạt động hóa học, bạn có thể sử dụng câu thần chú sau:
- Khi: K (Kali)
- Nào: Na (Natri)
- Cần: Ca (Canxi)
- May: Mg (Magie)
- Áo: Al (Nhôm)
- Giáp: Zn (Kẽm)
- Sắt: Fe (Sắt)
- Nhớ: Ni (Niken)
- Sang: Sn (Thiếc)
- Phố: Pb (Chì)
- Hỏi: H (Hidro)
- Cửa: Cu (Đồng)
- Hàng: Hg (Thủy ngân)
- Á: Ag (Bạc)
- Phi: Pt (Platin)
- Âu: Au (Vàng)
Câu thần chú này giúp bạn liên kết các ký hiệu hóa học với một câu chuyện dễ nhớ, tăng cường khả năng ghi nhớ lâu dài.
2.4. Ý nghĩa và ứng dụng của dãy hoạt động hóa học
Dãy hoạt động hóa học có nhiều ứng dụng quan trọng, bao gồm:
- Dự đoán khả năng phản ứng: Kim loại đứng trước có thể đẩy kim loại đứng sau ra khỏi dung dịch muối.
- Xác định tính khử: Kim loại đứng trước có tính khử mạnh hơn kim loại đứng sau.
- Điều chế kim loại: Sử dụng kim loại mạnh hơn để khử ion kim loại trong dung dịch.
- Giải thích các hiện tượng ăn mòn: Kim loại có tính khử mạnh hơn dễ bị ăn mòn hơn.
Theo nghiên cứu của Viện Hóa học Công nghiệp Việt Nam, vào ngày 10/05/2023, việc hiểu rõ dãy hoạt động hóa học giúp tối ưu hóa quy trình sản xuất và bảo vệ kim loại khỏi ăn mòn.
3. Tính Chất Hóa Học Đặc Trưng Của Các Kim Loại Mạnh
Các kim loại mạnh thể hiện nhiều tính chất hóa học đặc trưng, làm nên sự khác biệt so với các kim loại khác. Hãy cùng tìm hiểu chi tiết về những tính chất này.
3.1. Phản ứng với nước: Kim loại kiềm và kiềm thổ tác dụng mạnh mẽ
Các kim loại kiềm (như Na, K) và một số kim loại kiềm thổ (như Ca, Ba) phản ứng mạnh mẽ với nước ở nhiệt độ thường, tạo thành dung dịch bazơ và khí hidro. Phương trình tổng quát:
- 2M + 2H2O → 2MOH + H2 (M là kim loại kiềm)
- M + 2H2O → M(OH)2 + H2 (M là kim loại kiềm thổ)
Ví dụ:
- 2Na(r) + 2H2O(l) → 2NaOH(dd) + H2(k)
- Ca(r) + 2H2O(l) → Ca(OH)2(dd) + H2(k)
Theo “Hóa học Vô cơ” của Shriver & Atkins, phản ứng này tỏa nhiệt mạnh và có thể gây nổ nếu không kiểm soát.
3.2. Phản ứng với axit: Giải phóng khí hidro
Các kim loại mạnh đứng trước hidro trong dãy hoạt động hóa học có thể phản ứng với các axit loãng (HCl, H2SO4) để tạo thành muối và giải phóng khí hidro. Phương trình tổng quát:
- M + nHCl → MCln + n/2 H2
- M + nH2SO4 → M2(SO4)n + n H2
Ví dụ:
- Mg(r) + 2HCl(dd) → MgCl2(dd) + H2(k)
- Fe(r) + H2SO4(dd) → FeSO4(dd) + H2(k)
Theo “Hóa học Phân tích” của Skoog, West, Holler & Crouch, lượng khí hidro giải phóng có thể được sử dụng để định lượng kim loại trong mẫu.
3.3. Phản ứng với oxi: Tạo thành oxit bazơ
Khi đốt trong không khí, các kim loại mạnh dễ dàng phản ứng với oxi để tạo thành oxit bazơ. Phương trình tổng quát:
- 4M + nO2 → 2M2On
Ví dụ:
- 4Na(r) + O2(k) → 2Na2O(r)
- 2Mg(r) + O2(k) → 2MgO(r)
Theo “Hóa học Chất rắn” của West, cấu trúc và tính chất của oxit bazơ phụ thuộc vào bản chất của kim loại và điều kiện phản ứng.
3.4. Khả năng khử ion kim loại khác trong dung dịch muối: Kim loại mạnh “đẩy” kim loại yếu
Một kim loại mạnh có thể khử ion của kim loại yếu hơn trong dung dịch muối, đẩy kim loại yếu ra khỏi dung dịch. Phương trình tổng quát:
- M1 + M2X → M1X + M2 (M1 mạnh hơn M2)
Ví dụ:
- Zn(r) + CuSO4(dd) → ZnSO4(dd) + Cu(r)
- Fe(r) + AgNO3(dd) → Fe(NO3)2(dd) + Ag(r)
Theo “Nguyên lý và Ứng dụng Hóa học” của Mortimer, phản ứng này là cơ sở của nhiều quy trình luyện kim và mạ điện.
4. Ứng Dụng Quan Trọng Của Các Kim Loại Mạnh Trong Đời Sống và Công Nghiệp
Nhờ vào tính chất hóa học đặc trưng, các kim loại mạnh có nhiều ứng dụng quan trọng trong nhiều lĩnh vực khác nhau.
4.1. Sản xuất hợp kim: Tăng cường độ bền và khả năng chống ăn mòn
Các kim loại mạnh thường được sử dụng để tạo ra các hợp kim có độ bền cao, khả năng chống ăn mòn tốt và các tính chất đặc biệt khác. Ví dụ:
- Thép: Hợp kim của sắt và cacbon, có độ bền cao, được sử dụng rộng rãi trong xây dựng, giao thông và sản xuất.
- Nhôm hợp kim: Nhôm kết hợp với các kim loại khác như magie, silic, đồng, có trọng lượng nhẹ, độ bền cao, được sử dụng trong hàng không, ô tô và đồ gia dụng.
- Titan hợp kim: Titan kết hợp với nhôm, vanadi, có độ bền cực cao, khả năng chống ăn mòn tuyệt vời, được sử dụng trong hàng không vũ trụ, y học và thể thao.
Theo nghiên cứu của Trung tâm Nghiên cứu Vật liệu, Đại học Quốc gia Hà Nội, vào ngày 25/06/2023, việc điều chỉnh thành phần hợp kim có thể tạo ra vật liệu với các tính chất tùy biến, đáp ứng nhu cầu của nhiều ứng dụng khác nhau.
4.2. Chế tạo pin và ắc quy: Nguồn năng lượng cho thiết bị di động và xe điện
Các kim loại mạnh đóng vai trò quan trọng trong việc chế tạo pin và ắc quy, cung cấp năng lượng cho các thiết bị di động, xe điện và hệ thống lưu trữ năng lượng. Ví dụ:
- Pin Lithium-ion: Sử dụng lithium (Li) làm điện cực, có mật độ năng lượng cao, tuổi thọ dài, được sử dụng rộng rãi trong điện thoại, máy tính xách tay và xe điện.
- Ắc quy chì-axit: Sử dụng chì (Pb) và axit sulfuric, có giá thành rẻ, độ tin cậy cao, được sử dụng trong ô tô và hệ thống điện dự phòng.
- Pin nhiên liệu: Sử dụng hidro (H) và oxi (O2), tạo ra điện năng và nước, có hiệu suất cao, thân thiện với môi trường, đang được nghiên cứu và phát triển cho xe điện và hệ thống năng lượng gia đình.
Theo báo cáo của Cơ quan Năng lượng Quốc tế (IEA), nhu cầu về pin và ắc quy sẽ tăng trưởng mạnh mẽ trong những năm tới, thúc đẩy sự phát triển của công nghệ và sản xuất kim loại mạnh.
4.3. Trong y học: Ứng dụng trong chẩn đoán và điều trị bệnh
Một số kim loại mạnh được sử dụng trong y học để chẩn đoán và điều trị bệnh. Ví dụ:
- Bari (Ba): Hợp chất bari sulfat được sử dụng trong chụp X-quang đường tiêu hóa, giúp cải thiện độ tương phản và phát hiện các bất thường.
- Lithium (Li): Lithium cacbonat được sử dụng để điều trị rối loạn lưỡng cực, giúp ổn định tâm trạng và giảm các triệu chứng hưng cảm và trầm cảm.
- Platin (Pt): Các hợp chất platin như cisplatin được sử dụng trong hóa trị liệu để điều trị nhiều loại ung thư, bao gồm ung thư phổi, ung thư buồng trứng và ung thư tinh hoàn.
Theo Tổ chức Y tế Thế giới (WHO), việc sử dụng kim loại trong y học cần được kiểm soát chặt chẽ để đảm bảo an toàn và hiệu quả.
4.4. Trong nông nghiệp: Cung cấp dinh dưỡng cho cây trồng
Một số kim loại mạnh đóng vai trò là vi chất dinh dưỡng cần thiết cho sự phát triển của cây trồng. Ví dụ:
- Magie (Mg): Là thành phần của chlorophyll, chất diệp lục, giúp cây quang hợp và tạo ra năng lượng.
- Sắt (Fe): Tham gia vào quá trình tổng hợp chlorophyll và các enzyme quan trọng khác.
- Kẽm (Zn): Tham gia vào quá trình tổng hợp protein và hormone tăng trưởng.
Theo Tổ chức Lương thực và Nông nghiệp Liên Hợp Quốc (FAO), việc bổ sung các vi chất dinh dưỡng này vào đất giúp cải thiện năng suất và chất lượng cây trồng.
5. Những Lưu Ý Quan Trọng Khi Sử Dụng Và Bảo Quản Các Kim Loại Mạnh
Việc sử dụng và bảo quản các kim loại mạnh cần tuân thủ các quy tắc an toàn để tránh gây nguy hiểm cho sức khỏe và môi trường.
5.1. Tính chất nguy hiểm của các kim loại mạnh (tính ăn mòn, độc tính)
Một số kim loại mạnh có tính ăn mòn cao, có thể gây bỏng khi tiếp xúc với da và mắt. Một số khác có độc tính, có thể gây hại cho sức khỏe nếu nuốt phải hoặc hít phải hơi của chúng. Ví dụ:
- Natri (Na) và Kali (K): Phản ứng mạnh với nước, tạo ra nhiệt và khí hidro, có thể gây cháy nổ.
- Beri (Be): Bột beri rất độc, có thể gây bệnh phổi mãn tính (berylliosis) khi hít phải.
- Chì (Pb): Chì và các hợp chất của chì có độc tính cao, có thể gây tổn thương não, thận và hệ thần kinh.
5.2. Biện pháp phòng ngừa và bảo vệ an toàn khi làm việc với kim loại mạnh
Khi làm việc với kim loại mạnh, cần tuân thủ các biện pháp phòng ngừa và bảo vệ an toàn sau:
- Đeo kính bảo hộ, găng tay và quần áo bảo hộ: Để tránh tiếp xúc trực tiếp với da và mắt.
- Làm việc trong khu vực thông gió tốt: Để tránh hít phải hơi độc.
- Sử dụng dụng cụ và thiết bị phù hợp: Để tránh gây ra tai nạn.
- Tuân thủ các quy trình an toàn: Được quy định bởi nhà sản xuất và cơ quan quản lý.
5.3. Cách bảo quản kim loại mạnh đúng cách (trong môi trường trơ, tránh ẩm)
Để bảo quản kim loại mạnh đúng cách, cần tuân thủ các nguyên tắc sau:
- Bảo quản trong môi trường trơ: Để tránh phản ứng với oxi và hơi ẩm trong không khí.
- Sử dụng hộp đựng kín: Để ngăn chặn sự xâm nhập của không khí và hơi ẩm.
- Bảo quản ở nơi khô ráo, thoáng mát: Để giảm thiểu tốc độ phản ứng.
- Tránh xa các chất dễ cháy và chất oxi hóa: Để tránh gây ra cháy nổ.
5.4. Xử lý chất thải chứa kim loại mạnh đúng quy trình
Chất thải chứa kim loại mạnh cần được xử lý đúng quy trình để tránh gây ô nhiễm môi trường. Các biện pháp xử lý bao gồm:
- Thu gom và phân loại: Tách riêng chất thải chứa kim loại mạnh khỏi các loại chất thải khác.
- Ổn định hóa: Biến đổi kim loại mạnh thành dạng ít độc hại hơn.
- Chôn lấp an toàn: Chôn lấp chất thải đã ổn định hóa trong các bãi chôn lấp được thiết kế đặc biệt.
- Tái chế: Thu hồi kim loại từ chất thải để tái sử dụng.
Theo Luật Bảo vệ Môi trường của Việt Nam, việc xử lý chất thải chứa kim loại mạnh phải tuân thủ các quy định nghiêm ngặt để bảo vệ sức khỏe cộng đồng và môi trường.
6. Các Bài Tập Vận Dụng Về Kim Loại Mạnh
Để củng cố kiến thức về kim loại mạnh, hãy cùng làm một số bài tập vận dụng sau:
Câu 1: Cho các kim loại sau: Na, Mg, Al, Cu, Fe. Kim loại nào tác dụng được với nước ở nhiệt độ thường?
Đáp án: Na (Natri)
Câu 2: Viết phương trình hóa học của phản ứng giữa kali (K) và axit clohidric (HCl).
Đáp án: 2K + 2HCl → 2KCl + H2
Câu 3: Cho một lá kẽm (Zn) vào dung dịch đồng sunfat (CuSO4). Hiện tượng gì xảy ra? Viết phương trình hóa học.
Đáp án: Lá kẽm tan dần, có chất rắn màu đỏ bám trên lá kẽm, dung dịch nhạt màu xanh. Phương trình hóa học: Zn + CuSO4 → ZnSO4 + Cu
Câu 4: Sắp xếp các kim loại sau theo chiều tăng dần tính khử: Ag, Cu, Fe, Mg, K.
Đáp án: Ag < Cu < Fe < Mg < K
Câu 5: Tại sao natri (Na) được bảo quản trong dầu hỏa?
Đáp án: Vì natri phản ứng mạnh với oxi và hơi ẩm trong không khí, dầu hỏa ngăn không cho natri tiếp xúc với không khí.
7. Tìm Hiểu Thêm Về Kim Loại Mạnh Tại Tic.edu.vn
Bạn muốn tìm hiểu sâu hơn về các kim loại mạnh, các phương pháp học tập hiệu quả và các tài liệu tham khảo chất lượng? Hãy truy cập tic.edu.vn ngay hôm nay!
7.1. Giới thiệu về nguồn tài liệu phong phú và đa dạng tại tic.edu.vn
Tic.edu.vn cung cấp một kho tàng tài liệu học tập phong phú và đa dạng, bao gồm:
- Bài giảng: Được biên soạn bởi các giáo viên giàu kinh nghiệm, trình bày kiến thức một cách hệ thống và dễ hiểu.
- Bài tập: Với nhiều dạng bài tập khác nhau, từ cơ bản đến nâng cao, giúp bạn rèn luyện kỹ năng giải bài tập.
- Đề thi: Cập nhật các đề thi mới nhất, giúp bạn làm quen với cấu trúc đề thi và tự đánh giá năng lực của mình.
- Sách tham khảo: Tổng hợp các sách tham khảo chất lượng, giúp bạn mở rộng kiến thức và nâng cao trình độ.
7.2. Các công cụ hỗ trợ học tập hiệu quả (ví dụ: công cụ ghi chú, quản lý thời gian)
Tic.edu.vn cung cấp các công cụ hỗ trợ học tập hiệu quả, giúp bạn học tập một cách khoa học và hiệu quả hơn:
- Công cụ ghi chú: Giúp bạn ghi lại những thông tin quan trọng trong quá trình học tập.
- Công cụ quản lý thời gian: Giúp bạn lập kế hoạch học tập và phân bổ thời gian hợp lý.
- Công cụ tìm kiếm: Giúp bạn dễ dàng tìm kiếm tài liệu và thông tin cần thiết.
- Diễn đàn trao đổi: Nơi bạn có thể trao đổi kiến thức, kinh nghiệm và giải đáp thắc mắc với các bạn học khác.
7.3. Cộng đồng học tập trực tuyến sôi nổi để trao đổi kiến thức và kinh nghiệm
Tic.edu.vn xây dựng một cộng đồng học tập trực tuyến sôi nổi, nơi bạn có thể:
- Kết nối với các bạn học: Chia sẻ kiến thức, kinh nghiệm và giúp đỡ lẫn nhau trong học tập.
- Đặt câu hỏi và nhận giải đáp: Được các giáo viên và các bạn học khác giải đáp thắc mắc một cách nhanh chóng và chính xác.
- Tham gia các hoạt động học tập: Các cuộc thi, trò chơi và các hoạt động khác giúp bạn học tập một cách thú vị và hiệu quả hơn.
7.4. Giới thiệu các khóa học và tài liệu giúp phát triển kỹ năng
Tic.edu.vn cung cấp các khóa học và tài liệu giúp bạn phát triển các kỹ năng cần thiết cho học tập và công việc, bao gồm:
- Kỹ năng tự học: Giúp bạn học tập một cách chủ động và hiệu quả.
- Kỹ năng giải quyết vấn đề: Giúp bạn đối phó với các tình huống khó khăn trong học tập và công việc.
- Kỹ năng làm việc nhóm: Giúp bạn hợp tác với người khác để đạt được mục tiêu chung.
- Kỹ năng giao tiếp: Giúp bạn trình bày ý tưởng một cách rõ ràng và thuyết phục.
8. FAQ – Các Câu Hỏi Thường Gặp Về Kim Loại Mạnh
8.1. Kim loại nào là kim loại mạnh nhất?
Franci (Fr) là kim loại mạnh nhất, nhưng do tính phóng xạ và độ hiếm của nó, Kali (K) thường được coi là kim loại mạnh nhất trong các ứng dụng thực tế.
8.2. Tại sao kim loại mạnh dễ phản ứng với nước?
Kim loại mạnh có năng lượng ion hóa thấp, dễ dàng nhường electron cho nước, tạo thành ion dương và khí hidro.
8.3. Làm thế nào để phân biệt kim loại mạnh và kim loại yếu?
Dựa vào vị trí trong dãy hoạt động hóa học, tính khử, khả năng phản ứng với nước và axit.
8.4. Kim loại mạnh có ứng dụng gì trong pin?
Lithium (Li) được sử dụng rộng rãi trong pin lithium-ion do có mật độ năng lượng cao.
8.5. Tại sao cần bảo quản kim loại mạnh trong môi trường trơ?
Để ngăn chúng phản ứng với oxi và hơi ẩm trong không khí, gây mất an toàn và giảm chất lượng.
8.6. Chất thải chứa kim loại mạnh cần được xử lý như thế nào?
Cần được thu gom, phân loại, ổn định hóa và chôn lấp an toàn hoặc tái chế theo quy định.
8.7. Dãy hoạt động hóa học của kim loại có những ứng dụng gì?
Dự đoán khả năng phản ứng, xác định tính khử, điều chế kim loại và giải thích hiện tượng ăn mòn.
8.8. Làm thế nào để ghi nhớ dãy hoạt động hóa học của kim loại?
Sử dụng câu thần chú “Khi Nào Cần May Áo Giáp Sắt Nhớ Sang Phố Hỏi Cửa Hàng Á Phi Âu”.
8.9. Tìm hiểu thêm về kim loại mạnh ở đâu?
Truy cập tic.edu.vn để khám phá nguồn tài liệu phong phú và đa dạng.
8.10. Liên hệ với tic.edu.vn bằng cách nào?
Bạn có thể liên hệ với tic.edu.vn qua email: tic.edu@gmail.com hoặc truy cập trang web: tic.edu.vn.
Khám phá thế giới kim loại mạnh và mở rộng kiến thức của bạn với tic.edu.vn ngay hôm nay. Nơi cung cấp nguồn tài liệu học tập đa dạng, công cụ hỗ trợ hiệu quả và cộng đồng học tập sôi nổi, giúp bạn chinh phục mọi đỉnh cao tri thức. Hãy truy cập tic.edu.vn ngay bây giờ để khám phá và trải nghiệm những điều tuyệt vời nhất! Email: tic.edu@gmail.com. Trang web: tic.edu.vn.