C6h5ch2oh + Naoh, một chủ đề quan trọng trong hóa học hữu cơ, thường gặp trong chương trình học phổ thông và đại học. Bài viết này của tic.edu.vn sẽ cung cấp một cái nhìn toàn diện về phản ứng này, từ cơ chế, ứng dụng đến các bài tập liên quan, giúp bạn nắm vững kiến thức và tự tin chinh phục các kỳ thi. Chúng tôi sẽ cùng bạn khám phá sâu hơn về bản chất của phản ứng và những ứng dụng thực tế của nó.
Contents
- 1. Phản Ứng C6H5CH2OH + NaOH Là Gì?
- 1.1. Bản Chất Phản Ứng
- 1.2. Phương Trình Phản Ứng
- 1.3. Cơ Chế Phản Ứng
- 2. Điều Kiện Phản Ứng C6H5CH2OH + NaOH
- 2.1. Dung Môi
- 2.2. Nhiệt Độ
- 2.3. Nồng Độ
- 2.4. Chất Xúc Tác
- 3. Ứng Dụng Phản Ứng C6H5CH2OH + NaOH
- 3.1. Tổng Hợp Hóa Học
- 3.2. Điều Chế Xà Phòng
- 3.3. Chất Khử
- 3.4. Ứng Dụng Trong Phòng Thí Nghiệm
- 4. Ưu Điểm và Hạn Chế Của Phản Ứng C6H5CH2OH + NaOH
- 4.1. Ưu Điểm
- 4.2. Hạn Chế
- 5. Các Yếu Tố Ảnh Hưởng Đến Tốc Độ Phản Ứng C6H5CH2OH + NaOH
- 5.1. Nồng Độ Chất Phản Ứng
- 5.2. Nhiệt Độ
- 5.3. Dung Môi
- 5.4. Bản Chất Của Các Chất Phản Ứng
- 6. So Sánh Phản Ứng C6H5CH2OH + NaOH với Phản Ứng C6H5OH + NaOH
- 6.1. Tính Axit
- 6.2. Sản Phẩm
- 6.3. Ứng Dụng
- 6.4. Điều Kiện Phản Ứng
- 7. Bài Tập Vận Dụng Về Phản Ứng C6H5CH2OH + NaOH
- 7.1. Bài Tập 1
- 7.2. Bài Tập 2
- 7.3. Bài Tập 3
- 8. Các Câu Hỏi Thường Gặp (FAQ) Về Phản Ứng C6H5CH2OH + NaOH
- 8.1. Tại sao ancol benzylic phản ứng với NaOH?
- 8.2. Phản ứng giữa ancol benzylic và NaOH có phải là phản ứng trung hòa không?
- 8.3. Sản phẩm của phản ứng giữa ancol benzylic và NaOH là gì?
- 8.4. Phản ứng giữa ancol benzylic và NaOH có ứng dụng gì?
- 8.5. Điều kiện để phản ứng giữa ancol benzylic và NaOH xảy ra là gì?
- 8.6. Làm thế nào để tăng tốc độ phản ứng giữa ancol benzylic và NaOH?
- 8.7. Phản ứng giữa ancol benzylic và NaOH có tạo ra khí không?
- 8.8. Natri benzilat (C6H5CH2ONa) có độc hại không?
- 8.9. Làm thế nào để phân biệt phenol và ancol benzylic?
- 8.10. Tại sao phenol có tính axit mạnh hơn ancol benzylic?
- 9. Tổng Kết
1. Phản Ứng C6H5CH2OH + NaOH Là Gì?
Phản ứng giữa C6H5CH2OH (ancol benzylic) và NaOH (natri hydroxit) là phản ứng trung hòa, trong đó ancol benzylic phản ứng với bazơ mạnh NaOH.
Ancol benzylic, có công thức cấu tạo C6H5CH2OH, là một hợp chất hữu cơ thuộc loại ancol thơm. Nó bao gồm một vòng benzen (C6H5) gắn với một nhóm metylen (-CH2-) và một nhóm hydroxyl (-OH).
Natri hydroxit (NaOH), còn được gọi là xút ăn da, là một bazơ mạnh. Trong dung dịch nước, NaOH phân ly hoàn toàn thành các ion Na+ và OH-.
1.1. Bản Chất Phản Ứng
Phản ứng giữa ancol benzylic và natri hydroxit xảy ra do tính axit yếu của nhóm hydroxyl (-OH) trong ancol benzylic. Mặc dù ancol không phải là axit mạnh, nhưng trong môi trường bazơ mạnh như NaOH, nó có thể thể hiện tính axit và phản ứng với bazơ.
1.2. Phương Trình Phản Ứng
Phương trình hóa học của phản ứng như sau:
C6H5CH2OH + NaOH → C6H5CH2ONa + H2O
Trong đó:
- C6H5CH2OH là ancol benzylic.
- NaOH là natri hydroxit.
- C6H5CH2ONa là natri benzilat.
- H2O là nước.
1.3. Cơ Chế Phản Ứng
Cơ chế của phản ứng này bao gồm các bước sau:
- Ion hóa NaOH: NaOH phân ly trong nước tạo thành ion Na+ và OH-.
- Tấn công của OH-: Ion OH- tấn công nguyên tử hydro của nhóm hydroxyl (-OH) trong ancol benzylic.
- Hình thành liên kết: Liên kết O-H bị phá vỡ, và một liên kết mới được hình thành giữa oxy và natri, tạo thành natri benzilat (C6H5CH2ONa) và nước (H2O).
Hình ảnh minh họa phản ứng giữa ancol benzylic và NaOH, tạo ra natri benzilat và nước
2. Điều Kiện Phản Ứng C6H5CH2OH + NaOH
Phản ứng giữa C6H5CH2OH và NaOH diễn ra trong điều kiện dung dịch.
2.1. Dung Môi
Nước thường được sử dụng làm dung môi cho phản ứng này vì cả ancol benzylic và natri hydroxit đều tan trong nước.
2.2. Nhiệt Độ
Phản ứng có thể xảy ra ở nhiệt độ phòng, nhưng tốc độ phản ứng có thể tăng lên khi đun nóng nhẹ. Tuy nhiên, cần tránh đun nóng quá mức vì có thể gây ra các phản ứng phụ không mong muốn.
2.3. Nồng Độ
Nồng độ của NaOH ảnh hưởng đến tốc độ phản ứng. Nồng độ NaOH càng cao, tốc độ phản ứng càng nhanh. Tuy nhiên, cần lưu ý rằng nồng độ NaOH quá cao có thể gây ra các phản ứng phụ.
2.4. Chất Xúc Tác
Thông thường, phản ứng giữa ancol benzylic và natri hydroxit không cần chất xúc tác.
3. Ứng Dụng Phản Ứng C6H5CH2OH + NaOH
Phản ứng giữa C6H5CH2OH và NaOH có nhiều ứng dụng quan trọng trong hóa học và công nghiệp.
3.1. Tổng Hợp Hóa Học
Natri benzilat (C6H5CH2ONa), sản phẩm của phản ứng, là một chất trung gian quan trọng trong tổng hợp hữu cơ. Nó có thể được sử dụng để điều chế nhiều hợp chất khác, chẳng hạn như este, ete, và các dẫn xuất của ancol benzylic.
3.2. Điều Chế Xà Phòng
Phản ứng xà phòng hóa là quá trình thủy phân este của axit béo bằng bazơ mạnh như NaOH hoặc KOH để tạo ra xà phòng và glycerol. Ancol benzylic có thể được sử dụng như một chất hoạt động bề mặt trong quá trình này, giúp cải thiện khả năng tạo bọt và làm sạch của xà phòng.
3.3. Chất Khử
Trong một số trường hợp, hỗn hợp C6H5CH2OH và NaOH có thể được sử dụng như một chất khử trong các phản ứng hóa học.
3.4. Ứng Dụng Trong Phòng Thí Nghiệm
Phản ứng này thường được sử dụng trong các phòng thí nghiệm hóa học để minh họa các khái niệm về phản ứng trung hòa, tính axit của ancol và các phản ứng hữu cơ cơ bản.
4. Ưu Điểm và Hạn Chế Của Phản Ứng C6H5CH2OH + NaOH
4.1. Ưu Điểm
- Dễ thực hiện: Phản ứng này tương đối dễ thực hiện và không đòi hỏi các điều kiện phức tạp.
- Nguyên liệu dễ kiếm: Cả ancol benzylic và natri hydroxit đều là những hóa chất phổ biến và dễ kiếm.
- Sản phẩm dễ tách: Natri benzilat và nước là những sản phẩm dễ tách ra khỏi hỗn hợp phản ứng.
4.2. Hạn Chế
- Tính axit yếu: Ancol benzylic là một axit yếu, do đó phản ứng có thể diễn ra chậm.
- Phản ứng phụ: Trong một số điều kiện, có thể xảy ra các phản ứng phụ không mong muốn.
- Ăn mòn: Natri hydroxit là một chất ăn mòn, do đó cần phải cẩn thận khi sử dụng.
5. Các Yếu Tố Ảnh Hưởng Đến Tốc Độ Phản Ứng C6H5CH2OH + NaOH
Tốc độ của phản ứng giữa C6H5CH2OH và NaOH có thể bị ảnh hưởng bởi một số yếu tố.
5.1. Nồng Độ Chất Phản Ứng
Nồng độ của ancol benzylic và natri hydroxit là một trong những yếu tố quan trọng nhất ảnh hưởng đến tốc độ phản ứng. Theo quy luật tác dụng khối lượng, tốc độ phản ứng tăng lên khi nồng độ của các chất phản ứng tăng lên.
5.2. Nhiệt Độ
Nhiệt độ cũng có ảnh hưởng đáng kể đến tốc độ phản ứng. Theo quy tắc Van’t Hoff, khi nhiệt độ tăng lên 10°C, tốc độ phản ứng thường tăng lên từ 2 đến 4 lần. Tuy nhiên, cần lưu ý rằng việc tăng nhiệt độ quá cao có thể dẫn đến các phản ứng phụ không mong muốn.
5.3. Dung Môi
Dung môi có thể ảnh hưởng đến tốc độ phản ứng bằng cách ảnh hưởng đến độ tan của các chất phản ứng và sự ổn định của các trạng thái chuyển tiếp.
5.4. Bản Chất Của Các Chất Phản Ứng
Bản chất của ancol benzylic và natri hydroxit cũng ảnh hưởng đến tốc độ phản ứng. Ancol benzylic là một axit yếu, do đó phản ứng có thể diễn ra chậm hơn so với các axit mạnh hơn. Natri hydroxit là một bazơ mạnh, giúp thúc đẩy phản ứng.
6. So Sánh Phản Ứng C6H5CH2OH + NaOH với Phản Ứng C6H5OH + NaOH
Để hiểu rõ hơn về phản ứng C6H5CH2OH + NaOH, chúng ta hãy so sánh nó với phản ứng giữa phenol (C6H5OH) và NaOH.
6.1. Tính Axit
Phenol (C6H5OH) có tính axit mạnh hơn ancol benzylic (C6H5CH2OH) do hiệu ứng cộng hưởng của vòng benzen làm ổn định anion phenolat. Do đó, phenol phản ứng với NaOH dễ dàng hơn so với ancol benzylic.
6.2. Sản Phẩm
Khi phenol phản ứng với NaOH, sản phẩm là natri phenolat (C6H5ONa) và nước (H2O):
C6H5OH + NaOH → C6H5ONa + H2O
Khi ancol benzylic phản ứng với NaOH, sản phẩm là natri benzilat (C6H5CH2ONa) và nước (H2O):
C6H5CH2OH + NaOH → C6H5CH2ONa + H2O
6.3. Ứng Dụng
Cả natri phenolat và natri benzilat đều là những chất trung gian quan trọng trong tổng hợp hữu cơ. Tuy nhiên, do tính chất hóa học khác nhau, chúng được sử dụng trong các ứng dụng khác nhau.
6.4. Điều Kiện Phản Ứng
Phản ứng giữa phenol và NaOH xảy ra dễ dàng hơn so với phản ứng giữa ancol benzylic và NaOH. Phản ứng giữa phenol và NaOH có thể xảy ra ở nhiệt độ phòng, trong khi phản ứng giữa ancol benzylic và NaOH có thể cần đun nóng nhẹ.
7. Bài Tập Vận Dụng Về Phản Ứng C6H5CH2OH + NaOH
Để củng cố kiến thức về phản ứng C6H5CH2OH + NaOH, chúng ta hãy cùng giải một số bài tập vận dụng.
7.1. Bài Tập 1
Cho 10,8 gam ancol benzylic phản ứng hoàn toàn với dung dịch NaOH dư. Tính khối lượng natri benzilat thu được.
Giải:
Số mol ancol benzylic: n(C6H5CH2OH) = 10,8 / 108 = 0,1 mol
Theo phương trình phản ứng: C6H5CH2OH + NaOH → C6H5CH2ONa + H2O
Số mol natri benzilat: n(C6H5CH2ONa) = n(C6H5CH2OH) = 0,1 mol
Khối lượng natri benzilat: m(C6H5CH2ONa) = 0,1 * 130 = 13 gam
7.2. Bài Tập 2
Cho 21,6 gam hỗn hợp gồm phenol và ancol benzylic phản ứng hoàn toàn với dung dịch NaOH dư, thu được 25,8 gam muối. Tính phần trăm khối lượng của ancol benzylic trong hỗn hợp ban đầu.
Giải:
Gọi số mol phenol là x, số mol ancol benzylic là y.
Ta có: 94x + 108y = 21,6 (1)
Phản ứng với NaOH:
C6H5OH + NaOH → C6H5ONa + H2O
x → x
C6H5CH2OH + NaOH → C6H5CH2ONa + H2O
y → y
Khối lượng muối thu được: 116x + 130y = 25,8 (2)
Giải hệ phương trình (1) và (2), ta được: x = 0,1 mol, y = 0,1 mol
Phần trăm khối lượng của ancol benzylic trong hỗn hợp ban đầu:
%m(C6H5CH2OH) = (108 0,1 / 21,6) 100% = 50%
7.3. Bài Tập 3
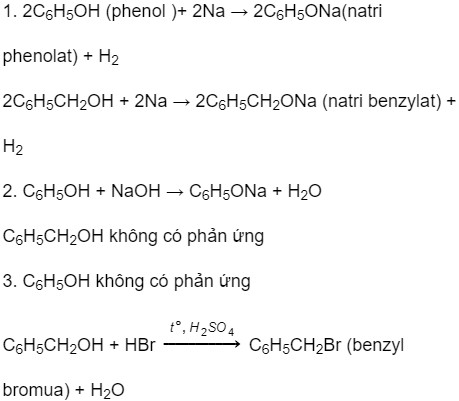
Viết phương trình phản ứng (nếu có) khi cho C6H5CH2OH tác dụng với các chất sau:
- Na
- Dung dịch NaOH
- Dung dịch HBr (có mặt H2SO4 đặc, đun nóng)
Giải:
- C6H5CH2OH + Na → C6H5CH2ONa + 1/2 H2
- C6H5CH2OH + NaOH → C6H5CH2ONa + H2O
- C6H5CH2OH + HBr → C6H5CH2Br + H2O (điều kiện: H2SO4 đặc, đun nóng)
8. Các Câu Hỏi Thường Gặp (FAQ) Về Phản Ứng C6H5CH2OH + NaOH
8.1. Tại sao ancol benzylic phản ứng với NaOH?
Ancol benzylic phản ứng với NaOH do tính axit yếu của nhóm hydroxyl (-OH) trong ancol benzylic. Trong môi trường bazơ mạnh như NaOH, nó có thể thể hiện tính axit và phản ứng với bazơ.
8.2. Phản ứng giữa ancol benzylic và NaOH có phải là phản ứng trung hòa không?
Đúng, phản ứng giữa ancol benzylic và NaOH là một phản ứng trung hòa, trong đó một axit yếu (ancol benzylic) phản ứng với một bazơ mạnh (NaOH).
8.3. Sản phẩm của phản ứng giữa ancol benzylic và NaOH là gì?
Sản phẩm của phản ứng giữa ancol benzylic và NaOH là natri benzilat (C6H5CH2ONa) và nước (H2O).
8.4. Phản ứng giữa ancol benzylic và NaOH có ứng dụng gì?
Phản ứng giữa ancol benzylic và NaOH có nhiều ứng dụng, bao gồm tổng hợp hóa học, điều chế xà phòng và sử dụng như một chất khử.
8.5. Điều kiện để phản ứng giữa ancol benzylic và NaOH xảy ra là gì?
Phản ứng giữa ancol benzylic và NaOH xảy ra trong điều kiện dung dịch, thường là trong nước. Phản ứng có thể xảy ra ở nhiệt độ phòng, nhưng tốc độ phản ứng có thể tăng lên khi đun nóng nhẹ.
8.6. Làm thế nào để tăng tốc độ phản ứng giữa ancol benzylic và NaOH?
Tốc độ phản ứng giữa ancol benzylic và NaOH có thể được tăng lên bằng cách tăng nồng độ của các chất phản ứng, tăng nhiệt độ hoặc sử dụng dung môi phù hợp.
8.7. Phản ứng giữa ancol benzylic và NaOH có tạo ra khí không?
Không, phản ứng giữa ancol benzylic và NaOH không tạo ra khí.
8.8. Natri benzilat (C6H5CH2ONa) có độc hại không?
Natri benzilat có thể gây kích ứng da và mắt. Cần phải cẩn thận khi sử dụng và tránh tiếp xúc trực tiếp với da và mắt.
8.9. Làm thế nào để phân biệt phenol và ancol benzylic?
Phenol và ancol benzylic có thể được phân biệt bằng cách sử dụng dung dịch FeCl3. Phenol tạo ra dung dịch màu tím với FeCl3, trong khi ancol benzylic không phản ứng.
8.10. Tại sao phenol có tính axit mạnh hơn ancol benzylic?
Phenol có tính axit mạnh hơn ancol benzylic do hiệu ứng cộng hưởng của vòng benzen làm ổn định anion phenolat.
9. Tổng Kết
Phản ứng giữa C6H5CH2OH (ancol benzylic) và NaOH (natri hydroxit) là một phản ứng quan trọng trong hóa học hữu cơ, có nhiều ứng dụng trong tổng hợp hóa học, điều chế xà phòng và các lĩnh vực khác. Hiểu rõ về cơ chế, điều kiện và các yếu tố ảnh hưởng đến phản ứng này sẽ giúp bạn nắm vững kiến thức và tự tin chinh phục các bài tập liên quan.
Hy vọng bài viết này của tic.edu.vn đã cung cấp cho bạn một cái nhìn tổng quan và chi tiết về phản ứng C6H5CH2OH + NaOH. Nếu bạn có bất kỳ câu hỏi nào, đừng ngần ngại liên hệ với chúng tôi qua email: [email protected] hoặc truy cập trang web: tic.edu.vn để được tư vấn và hỗ trợ.
Bạn đang gặp khó khăn trong việc tìm kiếm tài liệu học tập chất lượng? Bạn muốn nâng cao kiến thức và kỹ năng của mình một cách hiệu quả? Hãy truy cập tic.edu.vn ngay hôm nay để khám phá nguồn tài liệu học tập phong phú và các công cụ hỗ trợ học tập trực tuyến hiệu quả. Cộng đồng học tập sôi nổi của chúng tôi luôn sẵn sàng chào đón bạn. tic.edu.vn – Nơi chắp cánh cho ước mơ tri thức của bạn.