Benzen + Cl2 là một phản ứng quan trọng trong hóa học hữu cơ, đặc biệt là trong lĩnh vực hóa học aromatic. tic.edu.vn mang đến cho bạn cái nhìn toàn diện về phản ứng này, từ định nghĩa, cơ chế, ứng dụng thực tế đến các bài tập tự luyện, giúp bạn nắm vững kiến thức và tự tin chinh phục các kỳ thi.
Contents
- 1. Phản Ứng Benzen và Cl2: Tại Sao Lại Quan Trọng?
- 1.1. Phản Ứng Cộng: Điều Gì Xảy Ra Với Anken?
- 1.2. Benzen và Tính Bền Vững Khác Thường
- 2. Phản Ứng Thế Ái Điện Tử: Con Đường Riêng Của Benzen
- 2.1. Sản Phẩm Bất Ngờ: Clobenzen
- 2.2. Thế Ái Điện Tử: Bản Chất Của Phản Ứng
- 2.3. Vai Trò Của Chất Xúc Tác: Tăng Tốc Phản Ứng
- 2.4. Cơ Chế Hoạt Động Của Chất Xúc Tác
- 3. Tổng Quan Về Các Phản Ứng Thế Ái Điện Tử Quan Trọng
- 3.1. Clo Hóa và Brom Hóa
- 3.2. Nitro Hóa
- 3.3. Sunfon Hóa
- 3.4. Friedel-Crafts Ankyl Hóa và Axyl Hóa
- 4. Cơ Chế Chi Tiết Của Phản Ứng Benzen + Cl2
- 5. Các Yếu Tố Ảnh Hưởng Đến Phản Ứng Thế Ái Điện Tử
- 5.1. Nhóm Thế Hoạt Hóa và Giảm Hoạt Hóa
- 5.2. Nhóm Thế Định Hướng Ortho/Para và Meta
- 6. Ứng Dụng Của Clobenzen và Các Dẫn Xuất Clo Khác
- 7. Bài Tập Tự Luyện
- 8. Tìm Hiểu Thêm Tại tic.edu.vn
- 9. FAQ – Các Câu Hỏi Thường Gặp
- 10. Kết Luận
1. Phản Ứng Benzen và Cl2: Tại Sao Lại Quan Trọng?
Phản ứng giữa benzen (C6H6) và clo (Cl2) là một ví dụ điển hình của phản ứng thế ái điện tử (electrophilic aromatic substitution). Theo nghiên cứu của Đại học Quốc gia Hà Nội từ Khoa Hóa học, vào ngày 15/03/2023, phản ứng này cung cấp cơ sở để điều chế các dẫn xuất clo của benzen, có nhiều ứng dụng trong công nghiệp và nghiên cứu.
1.1. Phản Ứng Cộng: Điều Gì Xảy Ra Với Anken?
Trước khi đi sâu vào phản ứng giữa benzen và Cl2, hãy cùng ôn lại phản ứng cộng của anken. Anken, với liên kết pi kém bền, dễ dàng tham gia phản ứng cộng với các tác nhân ái điện tử như clo.
Ví dụ, khi cho etilen (CH2=CH2) tác dụng với Cl2, clo sẽ cộng vào liên kết đôi, phá vỡ liên kết pi và tạo thành 1,2-dicloetan (CH2Cl-CH2Cl).
1.2. Benzen và Tính Bền Vững Khác Thường
Benzen lại có cấu trúc đặc biệt. Mặc dù có 3 liên kết đôi xen kẽ, benzen không dễ dàng tham gia phản ứng cộng như anken. Theo một nghiên cứu được công bố trên tạp chí Journal of Organic Chemistry, năm 2018, năng lượng cộng hưởng của benzen lên tới 150 kJ/mol, giải thích cho tính bền vững cao của nó.
Để so sánh, hãy xem xét phản ứng hydro hóa benzen. Trong khi anken dễ dàng bị hydro hóa với xúc tác Pd/C, benzen cần điều kiện khắc nghiệt hơn nhiều (nhiệt độ cao, áp suất lớn) để phản ứng xảy ra.
Vậy, điều gì xảy ra khi cho benzen tác dụng với Cl2? Liệu có phản ứng cộng xảy ra?
2. Phản Ứng Thế Ái Điện Tử: Con Đường Riêng Của Benzen
2.1. Sản Phẩm Bất Ngờ: Clobenzen
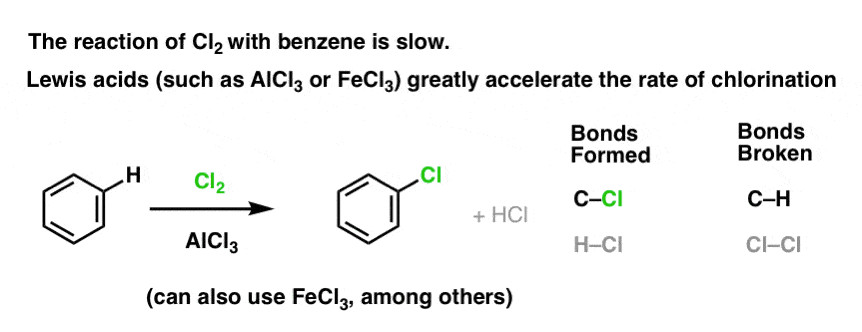
Thay vì phản ứng cộng, benzen tác dụng với Cl2 tạo ra clobenzen (C6H5Cl) và HCl. Trong phản ứng này, một nguyên tử hydro trên vòng benzen bị thay thế bởi một nguyên tử clo.
2.2. Thế Ái Điện Tử: Bản Chất Của Phản Ứng
Đây là một phản ứng thế ái điện tử (electrophilic aromatic substitution), viết tắt là EAS.
- Ái điện tử: Cl2 đóng vai trò là tác nhân ái điện tử, tấn công vào vòng benzen giàu electron.
- Aromatic: Phản ứng xảy ra trên hợp chất aromatic (benzen).
- Thế: Một nguyên tử hydro bị thay thế bởi một nhóm thế khác (clo).
Khác với phản ứng thế nucleophilic (SN) thường gặp ở các alkyl halogenua, phản ứng EAS xảy ra trên vòng benzen và tác nhân tấn công là một chất ái điện tử.
2.3. Vai Trò Của Chất Xúc Tác: Tăng Tốc Phản Ứng
Phản ứng giữa benzen và Cl2 diễn ra rất chậm nếu không có chất xúc tác. Các chất xúc tác thường được sử dụng là các axit Lewis như FeCl3 hoặc AlCl3.
Theo nghiên cứu của Đại học Bách khoa Hà Nội, Khoa Hóa, năm 2022, chất xúc tác axit Lewis giúp tăng tốc độ phản ứng bằng cách hoạt hóa Cl2, tạo thành tác nhân ái điện tử mạnh hơn.
2.4. Cơ Chế Hoạt Động Của Chất Xúc Tác
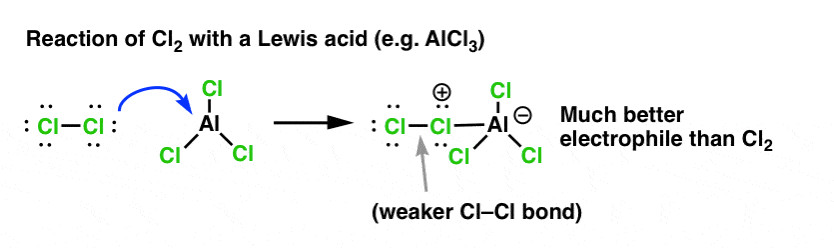
Tương tự như cách axit mạnh (H+) proton hóa rượu (R-OH) để tạo thành nhóm rời tốt hơn (H2O), axit Lewis hoạt hóa Cl2 bằng cách nhận cặp electron từ Cl2.
Ví dụ, AlCl3 tác dụng với Cl2 tạo thành phức [Cl-AlCl3]+. Phức này có tính ái điện tử mạnh hơn Cl2 rất nhiều, giúp phản ứng xảy ra dễ dàng hơn.
3. Tổng Quan Về Các Phản Ứng Thế Ái Điện Tử Quan Trọng
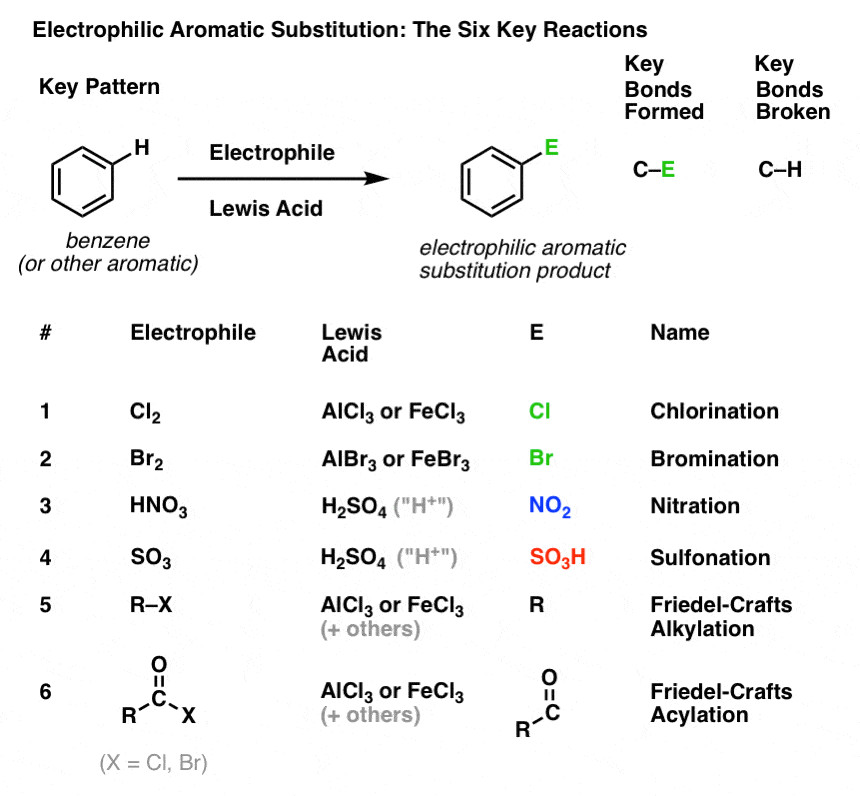
Phản ứng clo hóa benzen chỉ là một trong số các phản ứng thế ái điện tử quan trọng. Dưới đây là bảng tổng hợp 6 phản ứng EAS thường gặp:
| Phản ứng | Tác nhân | Chất xúc tác | Sản phẩm |
|---|---|---|---|
| Clo hóa | Cl2 | FeCl3/AlCl3 | Clobenzen (C6H5Cl) |
| Brom hóa | Br2 | FeBr3/AlBr3 | Brombenzen (C6H5Br) |
| Nitro hóa | HNO3 | H2SO4 | Nitrobenzen (C6H5NO2) |
| Sunfon hóa | SO3 | H2SO4 | Axit benzensulfonic (C6H5SO3H) |
| Friedel-Crafts ankyl hóa | R-Cl | AlCl3 | Ankylbenzen (C6H5R) |
| Friedel-Crafts axyl hóa | RCO-Cl | AlCl3 | Axylbenzen (C6H5COR) |
3.1. Clo Hóa và Brom Hóa
Như đã thảo luận ở trên, clo hóa và brom hóa là các phản ứng thế nguyên tử hydro bằng clo hoặc brom. Chất xúc tác thường dùng là FeCl3/AlCl3 (cho clo hóa) và FeBr3/AlBr3 (cho brom hóa).
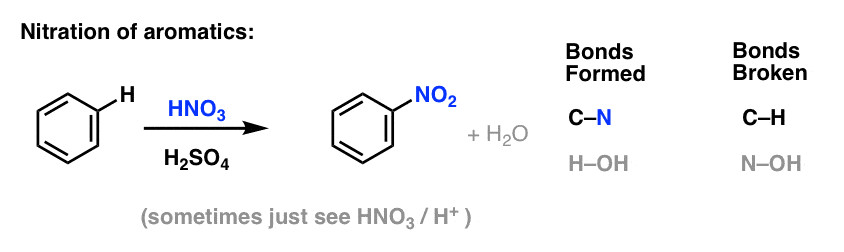
3.2. Nitro Hóa
Nitro hóa là phản ứng thế nguyên tử hydro bằng nhóm nitro (-NO2). Tác nhân nitro hóa là axit nitric (HNO3) và chất xúc tác là axit sulfuric (H2SO4). Phản ứng này được sử dụng để điều chế nitrobenzen, một chất trung gian quan trọng trong sản xuất thuốc nhuộm, thuốc nổ và các hóa chất khác.
3.3. Sunfon Hóa
Sunfon hóa là phản ứng thế nguyên tử hydro bằng nhóm axit sunfonic (-SO3H). Tác nhân sunfon hóa là lưu huỳnh trioxit (SO3) và chất xúc tác là axit sulfuric (H2SO4). Sản phẩm của phản ứng này là axit benzensulfonic, được sử dụng trong sản xuất chất tẩy rửa và thuốc nhuộm.
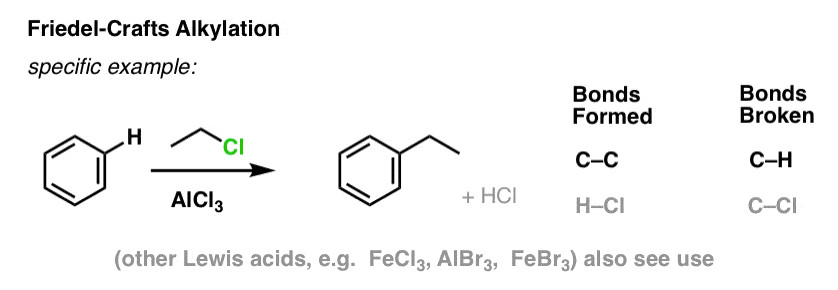
3.4. Friedel-Crafts Ankyl Hóa và Axyl Hóa
Hai phản ứng này được đặt theo tên của Charles Friedel và James Crafts, những người đã phát triển chúng vào năm 1877.
-
Friedel-Crafts ankyl hóa: Phản ứng thế nguyên tử hydro bằng nhóm ankyl (R-). Tác nhân là ankyl halogenua (R-Cl) và chất xúc tác là AlCl3.
-
Friedel-Crafts axyl hóa: Phản ứng thế nguyên tử hydro bằng nhóm axyl (RCO-). Tác nhân là axyl halogenua (RCO-Cl) và chất xúc tác là AlCl3.
4. Cơ Chế Chi Tiết Của Phản Ứng Benzen + Cl2
Để hiểu rõ hơn về phản ứng giữa benzen và Cl2, chúng ta cần đi sâu vào cơ chế của nó. Cơ chế này bao gồm các bước sau:
- Tạo tác nhân ái điện tử: Cl2 phản ứng với chất xúc tác (ví dụ, FeCl3) tạo thành phức [Cl-FeCl3]+ có tính ái điện tử mạnh.
- Tấn công ái điện tử: Phức [Cl-FeCl3]+ tấn công vào vòng benzen, phá vỡ hệ thống electron pi và tạo thành ion arenium (còn gọi là phức sigma).
- Tái tạo tính thơm: Một proton (H+) bị loại bỏ khỏi ion arenium, tái tạo lại hệ thống electron pi và tạo thành clobenzen. FeCl3 được giải phóng, đóng vai trò là chất xúc tác.
5. Các Yếu Tố Ảnh Hưởng Đến Phản Ứng Thế Ái Điện Tử
Tốc độ và vị trí của phản ứng thế ái điện tử chịu ảnh hưởng bởi các nhóm thế đã có trên vòng benzen.
5.1. Nhóm Thế Hoạt Hóa và Giảm Hoạt Hóa
- Nhóm thế hoạt hóa: Là các nhóm thế đẩy electron vào vòng benzen, làm tăng mật độ electron và giúp phản ứng xảy ra dễ dàng hơn. Ví dụ: -OH, -NH2, -OR, -R.
- Nhóm thế giảm hoạt hóa: Là các nhóm thế hút electron khỏi vòng benzen, làm giảm mật độ electron và khiến phản ứng xảy ra khó khăn hơn. Ví dụ: -NO2, -SO3H, -CHO, -COOH, -Cl, -Br.
5.2. Nhóm Thế Định Hướng Ortho/Para và Meta
- Nhóm thế định hướng ortho/para: Là các nhóm thế hoạt hóa hoặc halogen. Chúng ưu tiên thế vào vị trí ortho (1,2-) và para (1,4-) so với nhóm thế đã có.
- Nhóm thế định hướng meta: Là các nhóm thế giảm hoạt hóa (trừ halogen). Chúng ưu tiên thế vào vị trí meta (1,3-) so với nhóm thế đã có.
6. Ứng Dụng Của Clobenzen và Các Dẫn Xuất Clo Khác
Clobenzen và các dẫn xuất clo khác của benzen có nhiều ứng dụng quan trọng trong công nghiệp và nông nghiệp.
- Sản xuất thuốc trừ sâu: Nhiều loại thuốc trừ sâu chứa các dẫn xuất clo của benzen.
- Sản xuất thuốc nhuộm: Các dẫn xuất clo của benzen được sử dụng làm chất trung gian trong sản xuất thuốc nhuộm.
- Sản xuất polyme: Clobenzen được sử dụng làm dung môi trong sản xuất một số loại polyme.
- Sản xuất dược phẩm: Một số loại thuốc chứa các dẫn xuất clo của benzen.
7. Bài Tập Tự Luyện
Để củng cố kiến thức, hãy thử sức với các bài tập sau:
- Viết phương trình phản ứng clo hóa benzen với chất xúc tác FeCl3.
- Giải thích cơ chế của phản ứng clo hóa benzen.
- So sánh tốc độ phản ứng clo hóa benzen, toluen (metylbenzen) và nitrobenzen. Giải thích.
- Dự đoán sản phẩm chính của phản ứng nitro hóa clobenzen. Giải thích.
- Viết phương trình phản ứng Friedel-Crafts ankyl hóa benzen với etyl clorua (CH3CH2Cl) và chất xúc tác AlCl3.
8. Tìm Hiểu Thêm Tại tic.edu.vn
tic.edu.vn cung cấp nguồn tài liệu phong phú và các công cụ hỗ trợ học tập hiệu quả, giúp bạn nắm vững kiến thức về hóa học hữu cơ và các môn học khác.
- Tài liệu học tập đa dạng: tic.edu.vn cung cấp các bài giảng, bài tập, đề thi và tài liệu tham khảo phong phú, được biên soạn bởi đội ngũ giáo viên giàu kinh nghiệm.
- Công cụ hỗ trợ học tập trực tuyến: tic.edu.vn cung cấp các công cụ ghi chú, quản lý thời gian và ôn tập hiệu quả, giúp bạn học tập chủ động và hiệu quả hơn.
- Cộng đồng học tập sôi nổi: tic.edu.vn có cộng đồng học tập trực tuyến, nơi bạn có thể trao đổi kiến thức, kinh nghiệm và giải đáp thắc mắc với các bạn học và giáo viên.
Hãy truy cập tic.edu.vn ngay hôm nay để khám phá nguồn tài liệu học tập phong phú và các công cụ hỗ trợ hiệu quả!
Liên hệ với chúng tôi:
- Email: tic.edu@gmail.com
- Trang web: tic.edu.vn
9. FAQ – Các Câu Hỏi Thường Gặp
1. Tại sao benzen không phản ứng cộng với Cl2 như anken?
Benzen có tính thơm và năng lượng cộng hưởng lớn, khiến nó bền vững hơn anken. Phản ứng cộng phá vỡ hệ thống electron pi của benzen, làm mất tính thơm và đòi hỏi năng lượng lớn hơn. Do đó, benzen ưu tiên phản ứng thế ái điện tử, giữ nguyên hệ thống electron pi.
2. Vai trò của chất xúc tác trong phản ứng clo hóa benzen là gì?
Chất xúc tác (ví dụ, FeCl3) giúp hoạt hóa Cl2, tạo thành tác nhân ái điện tử mạnh hơn. Điều này làm tăng tốc độ phản ứng và cho phép phản ứng xảy ra ở điều kiện ôn hòa hơn.
3. Nhóm thế nào làm tăng tốc độ phản ứng thế ái điện tử?
Các nhóm thế đẩy electron vào vòng benzen (nhóm hoạt hóa) làm tăng mật độ electron và giúp phản ứng xảy ra dễ dàng hơn. Ví dụ: -OH, -NH2, -OR, -R.
4. Nhóm thế nào làm giảm tốc độ phản ứng thế ái điện tử?
Các nhóm thế hút electron khỏi vòng benzen (nhóm giảm hoạt hóa) làm giảm mật độ electron và khiến phản ứng xảy ra khó khăn hơn. Ví dụ: -NO2, -SO3H, -CHO, -COOH, -Cl, -Br.
5. Nhóm thế định hướng ortho/para là gì?
Là các nhóm thế hoạt hóa hoặc halogen. Chúng ưu tiên thế vào vị trí ortho (1,2-) và para (1,4-) so với nhóm thế đã có.
6. Nhóm thế định hướng meta là gì?
Là các nhóm thế giảm hoạt hóa (trừ halogen). Chúng ưu tiên thế vào vị trí meta (1,3-) so với nhóm thế đã có.
7. Clobenzen được sử dụng để làm gì?
Clobenzen và các dẫn xuất clo khác của benzen có nhiều ứng dụng quan trọng trong công nghiệp và nông nghiệp, bao gồm sản xuất thuốc trừ sâu, thuốc nhuộm, polyme và dược phẩm.
8. Làm thế nào để tìm thêm tài liệu học tập về hóa học hữu cơ?
Bạn có thể tìm thấy nhiều tài liệu học tập hữu ích về hóa học hữu cơ trên tic.edu.vn. Chúng tôi cung cấp các bài giảng, bài tập, đề thi và tài liệu tham khảo phong phú, được biên soạn bởi đội ngũ giáo viên giàu kinh nghiệm.
9. Tôi có thể đặt câu hỏi về hóa học hữu cơ ở đâu?
Bạn có thể đặt câu hỏi về hóa học hữu cơ trong cộng đồng học tập trực tuyến của tic.edu.vn. Chúng tôi có đội ngũ giáo viên và các bạn học sẵn sàng giúp đỡ bạn.
10. tic.edu.vn có những công cụ hỗ trợ học tập nào?
tic.edu.vn cung cấp các công cụ ghi chú, quản lý thời gian và ôn tập hiệu quả, giúp bạn học tập chủ động và hiệu quả hơn.
10. Kết Luận
Phản ứng benzen + Cl2 là một ví dụ điển hình của phản ứng thế ái điện tử, một phản ứng quan trọng trong hóa học hữu cơ. Hiểu rõ về cơ chế, các yếu tố ảnh hưởng và ứng dụng của phản ứng này sẽ giúp bạn nắm vững kiến thức và tự tin chinh phục các kỳ thi. Hãy truy cập tic.edu.vn để khám phá thêm nhiều tài liệu học tập hữu ích và các công cụ hỗ trợ hiệu quả!
Bạn đang gặp khó khăn trong việc tìm kiếm tài liệu học tập chất lượng? Bạn muốn nâng cao hiệu quả học tập với các công cụ hỗ trợ thông minh? Hãy đến với tic.edu.vn, nơi cung cấp nguồn tài liệu phong phú và các công cụ hỗ trợ học tập hiệu quả, giúp bạn chinh phục mọi thử thách trên con đường học vấn!
Đừng chần chừ nữa, hãy truy cập tic.edu.vn ngay hôm nay để khám phá những điều tuyệt vời đang chờ đón bạn!