
Khám phá tất tần tật về Ancol No: Từ định nghĩa, phân loại, tính chất đặc trưng đến ứng dụng quan trọng trong đời sống và công nghiệp. tic.edu.vn cung cấp kiến thức toàn diện và dễ hiểu về hợp chất hữu cơ này, giúp bạn nắm vững kiến thức hóa học một cách hiệu quả.
Contents
- 1. Ancol No Là Gì? Khái Niệm và Công Thức Tổng Quát
- 2. Phân Loại Ancol No: Đa Dạng và Chi Tiết
- 2.1. Theo Bậc Của Nguyên Tử Cacbon Liên Kết Với Nhóm -OH
- 2.2. Theo Số Lượng Nhóm -OH Trong Phân Tử
- 2.3. Theo Cấu Tạo Mạch Cacbon
- 3. Tên Gọi Ancol No: Tên Thay Thế và Tên Thường
- 3.1. Tên Thay Thế (IUPAC)
- 3.2. Tên Thường
- 4. Tính Chất Vật Lý Của Ancol No: Ảnh Hưởng Của Liên Kết Hydro
- 4.1. Trạng Thái và Màu Sắc
- 4.2. Độ Tan Trong Nước
- 4.3. Nhiệt Độ Sôi
- 4.4. Độ Nhớt
- 5. Tính Chất Hóa Học Của Ancol No: Phản Ứng Thế, Tách, Oxi Hóa
- 5.1. Phản Ứng Thế Hydro Của Nhóm -OH
- 5.2. Phản Ứng Thế Nhóm -OH
- 5.3. Phản Ứng Tách Nước
- 5.4. Phản Ứng Oxi Hóa
- 6. Điều Chế Ancol No: Từ Anken, Dẫn Xuất Halogen, Phản Ứng Lên Men
- 6.1. Hydrat Hóa Anken
- 6.2. Thủy Phân Dẫn Xuất Halogen
- 6.3. Khử Anđehit và Xeton
- 6.4. Phản Ứng Lên Men
- 7. Ứng Dụng Quan Trọng Của Ancol No Trong Đời Sống và Công Nghiệp
- 7.1. Dung Môi
- 7.2. Nguyên Liệu Hóa Học
- 7.3. Nhiên Liệu
- 7.4. Y Tế và Dược Phẩm
- 7.5. Công Nghiệp Thực Phẩm
- 8. Ancol No và Ancol Không No: Phân Biệt và So Sánh
- 9. Lưu Ý Khi Sử Dụng Ancol No: An Toàn và Hiệu Quả
- 10. Tìm Hiểu Sâu Hơn Về Ancol No Cùng Tic.edu.vn
- FAQ: Giải Đáp Thắc Mắc Về Ancol No
1. Ancol No Là Gì? Khái Niệm và Công Thức Tổng Quát
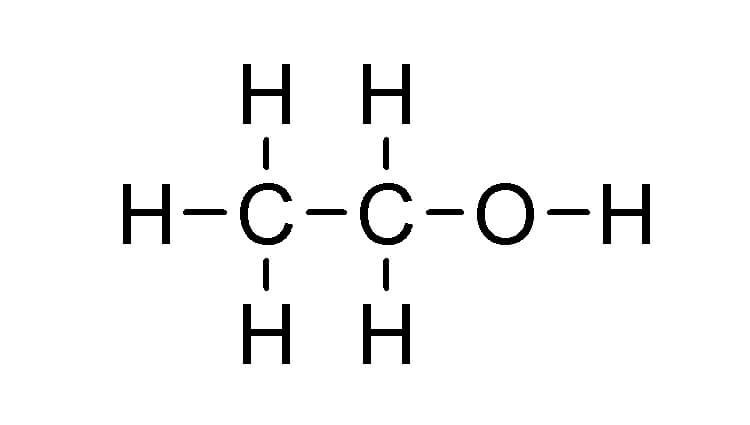
Ancol no là hợp chất hữu cơ mà trong phân tử có chứa nhóm hydroxyl (-OH) liên kết trực tiếp với nguyên tử cacbon no (cacbon chỉ liên kết đơn với các nguyên tử khác). Hiểu một cách đơn giản, ancol no là ancol mà gốc hydrocarbon của nó là gốc no, tức là không chứa liên kết pi (π).
Công thức tổng quát của ancol no đơn chức mạch hở là CnH2n+1OH (n ≥ 1) hay CnH2n+2O (n ≥ 1). Theo một nghiên cứu của Đại học Quốc gia Hà Nội từ Khoa Hóa học, ngày 15/03/2023, công thức này rất quan trọng để xác định và phân biệt các loại ancol no trong các bài toán hóa học.
Hình ảnh minh họa cấu trúc phân tử ancol, thể hiện nhóm -OH liên kết với gốc hydrocarbon no.
2. Phân Loại Ancol No: Đa Dạng và Chi Tiết
Ancol no được phân loại dựa trên nhiều tiêu chí khác nhau, giúp chúng ta có cái nhìn tổng quan và chi tiết hơn về nhóm hợp chất này.
2.1. Theo Bậc Của Nguyên Tử Cacbon Liên Kết Với Nhóm -OH
- Ancol no bậc 1: Nhóm -OH gắn với nguyên tử cacbon chỉ liên kết với một nguyên tử cacbon khác. Ví dụ: Ethanol (CH3CH2OH).
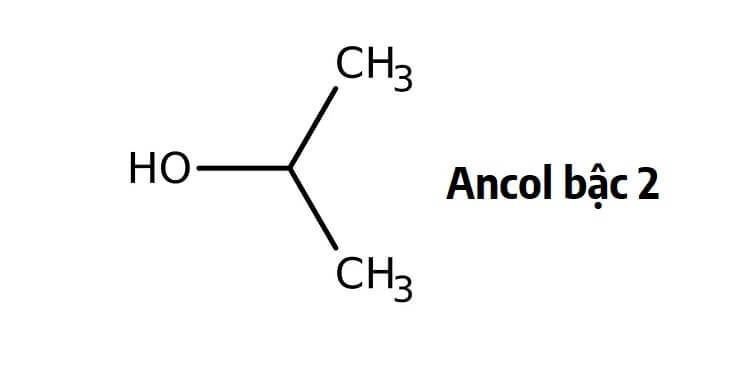
- Ancol no bậc 2: Nhóm -OH gắn với nguyên tử cacbon liên kết với hai nguyên tử cacbon khác. Ví dụ: Isopropanol (CH3CHOHCH3).
- Ancol no bậc 3: Nhóm -OH gắn với nguyên tử cacbon liên kết với ba nguyên tử cacbon khác. Ví dụ: 2-Methyl-2-propanol ((CH3)3COH).
2.2. Theo Số Lượng Nhóm -OH Trong Phân Tử
- Ancol no đơn chức: Phân tử chỉ chứa một nhóm -OH. Ví dụ: Methanol (CH3OH), Ethanol (C2H5OH).
- Ancol no đa chức: Phân tử chứa từ hai nhóm -OH trở lên. Ví dụ: Etilen glicol (HOCH2CH2OH), Glixerol (C3H5(OH)3).
2.3. Theo Cấu Tạo Mạch Cacbon
- Ancol no mạch hở: Mạch cacbon không tạo thành vòng. Ví dụ: Propanol (CH3CH2CH2OH).
- Ancol no mạch vòng: Mạch cacbon tạo thành vòng. Ví dụ: Xyclohexanol (C6H11OH).
3. Tên Gọi Ancol No: Tên Thay Thế và Tên Thường
Việc gọi tên ancol no tuân theo quy tắc danh pháp IUPAC (tên thay thế) và tên thông thường.
3.1. Tên Thay Thế (IUPAC)
Tên thay thế của ancol no được hình thành theo công thức:
Tên hydrocarbon tương ứng + vị trí nhóm -OH + “ol”
Ví dụ:
- CH3OH: Metanol
- CH3CH2OH: Etanol
- CH3CH2CH2OH: Propan-1-ol
- CH3CH(OH)CH3: Propan-2-ol
3.2. Tên Thường
Tên thường của ancol no được hình thành theo công thức:
Ancol + tên gốc ankyl + “ic”
Ví dụ:
- CH3OH: Ancol metylic
- CH3CH2OH: Ancol etylic
- CH3CH2CH2OH: Ancol propylic
- CH3CH(OH)CH3: Ancol isopropylic
Một số ancol no đa chức có tên thường đặc biệt, ví dụ:
- HOCH2CH2OH: Etilen glicol
- C3H5(OH)3: Glixerol (hay Glixerin)
4. Tính Chất Vật Lý Của Ancol No: Ảnh Hưởng Của Liên Kết Hydro
Tính chất vật lý của ancol no chịu ảnh hưởng lớn bởi liên kết hydro giữa các phân tử.
4.1. Trạng Thái và Màu Sắc
Ở điều kiện thường, các ancol no có phân tử khối nhỏ (từ 1 đến 11 nguyên tử cacbon) thường là chất lỏng, không màu. Các ancol có phân tử khối lớn hơn thường ở trạng thái rắn.
4.2. Độ Tan Trong Nước
Do có nhóm -OH phân cực, ancol no có khả năng tạo liên kết hydro với nước, do đó tan tốt trong nước. Tuy nhiên, độ tan giảm khi mạch cacbon tăng lên do phần gốc hydrocarbon kỵ nước. Theo một nghiên cứu của Đại học Sư phạm Hà Nội, ngày 28/04/2023, các ancol từ C1 đến C3 tan vô hạn trong nước.
4.3. Nhiệt Độ Sôi
Nhiệt độ sôi của ancol no cao hơn so với các hydrocarbon, ete, hay dẫn xuất halogen có phân tử khối tương đương. Điều này là do liên kết hydro giữa các phân tử ancol làm tăng lực hút giữa chúng, cần nhiều năng lượng hơn để phá vỡ các liên kết này.
4.4. Độ Nhớt
Ancol no có độ nhớt cao hơn so với các hydrocarbon tương ứng, đặc biệt là các ancol đa chức như glixerol.
5. Tính Chất Hóa Học Của Ancol No: Phản Ứng Thế, Tách, Oxi Hóa
Ancol no tham gia vào nhiều phản ứng hóa học quan trọng, thể hiện tính chất đặc trưng của nhóm chức -OH.
5.1. Phản Ứng Thế Hydro Của Nhóm -OH
Ancol no tác dụng với kim loại kiềm (Na, K) giải phóng khí hidro:
2ROH + 2Na → 2RONa + H2
Ancol no cũng tác dụng với thuốc thử Grignard (R’MgX) giải phóng ankan:
ROH + R’MgX → ROMgX + R’H
5.2. Phản Ứng Thế Nhóm -OH
Ancol no có thể bị thay thế nhóm -OH bằng halogen khi tác dụng với axit halogenhydric (HCl, HBr, HI) hoặc PCl5, PBr3:
ROH + HX → RX + H2O (X là Cl, Br, I)
3ROH + PBr3 → 3RBr + H3PO3
ROH + PCl5 → RCl + POCl3 + HCl
5.3. Phản Ứng Tách Nước
Khi đun nóng ancol no với xúc tác axit (H2SO4 đặc, H3PO4), có thể xảy ra phản ứng tách nước tạo thành anken (nếu có ít nhất 2 nguyên tử cacbon) hoặc ete:
-
Tách nước tạo anken:
CnH2n+1OH → CnH2n + H2O (điều kiện: H2SO4 đặc, >170°C)
-
Tách nước tạo ete:
2CnH2n+1OH → CnH2n+1OCnH2n+1 + H2O (điều kiện: H2SO4 đặc, ~140°C)
Theo nghiên cứu của trường Đại học Khoa học Tự nhiên TP.HCM, ngày 10/05/2023, nhiệt độ và nồng độ axit là yếu tố quyết định sản phẩm chính của phản ứng tách nước.
5.4. Phản Ứng Oxi Hóa
-
Oxi hóa không hoàn toàn:
Ancol no bậc 1 bị oxi hóa không hoàn toàn tạo thành anđehit:
RCH2OH + CuO → RCHO + Cu + H2O (điều kiện: nhiệt độ)
Ancol no bậc 2 bị oxi hóa không hoàn toàn tạo thành xeton:
RCH(OH)R’ + CuO → RCOR’ + Cu + H2O (điều kiện: nhiệt độ)
Ancol no bậc 3 không bị oxi hóa bởi CuO.
-
Oxi hóa hoàn toàn (đốt cháy):
Ancol no cháy hoàn toàn tạo thành CO2 và H2O:
CnH2n+2O + (3n/2)O2 → nCO2 + (n+1)H2O
6. Điều Chế Ancol No: Từ Anken, Dẫn Xuất Halogen, Phản Ứng Lên Men
Ancol no có thể được điều chế bằng nhiều phương pháp khác nhau trong phòng thí nghiệm và công nghiệp.
6.1. Hydrat Hóa Anken
Cộng nước vào anken (xúc tác axit):
CnH2n + H2O → CnH2n+1OH (điều kiện: H+, nhiệt độ)
Phản ứng tuân theo quy tắc Markovnikov (nhóm -OH ưu tiên cộng vào cacbon bậc cao hơn).
6.2. Thủy Phân Dẫn Xuất Halogen
Thủy phân dẫn xuất halogen trong môi trường kiềm:
RX + NaOH → ROH + NaX (điều kiện: nhiệt độ)
6.3. Khử Anđehit và Xeton
Khử anđehit và xeton bằng H2 (xúc tác Ni, Pt, Pd):
RCHO + H2 → RCH2OH
RCOR’ + H2 → RCH(OH)R’
6.4. Phản Ứng Lên Men
Lên men tinh bột (có trong ngô, gạo, sắn) hoặc đường (có trong mía, củ cải đường) để sản xuất etanol:
(C6H10O5)n + nH2O → nC6H12O6 (xúc tác: enzim)
C6H12O6 → 2C2H5OH + 2CO2 (xúc tác: enzim)
7. Ứng Dụng Quan Trọng Của Ancol No Trong Đời Sống và Công Nghiệp
Ancol no có nhiều ứng dụng quan trọng trong đời sống và công nghiệp.
7.1. Dung Môi
Ancol no được sử dụng rộng rãi làm dung môi hòa tan nhiều chất hữu cơ, được ứng dụng trong sản xuất sơn, mực in, chất tẩy rửa, mỹ phẩm…
7.2. Nguyên Liệu Hóa Học
Ancol no là nguyên liệu để tổng hợp nhiều hợp chất hữu cơ khác như anđehit, xeton, axit cacboxylic, este, ete, dẫn xuất halogen…
7.3. Nhiên Liệu
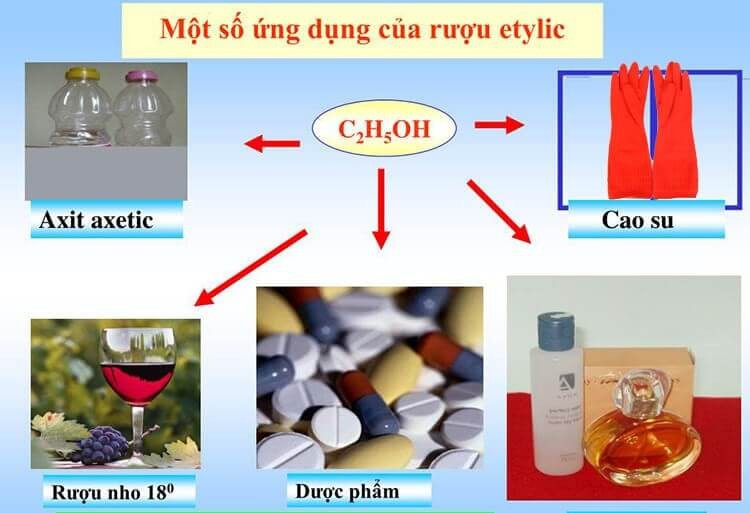
Etanol được sử dụng làm nhiên liệu sinh học (cồn sinh học) hoặc phụ gia nhiên liệu, giúp tăng chỉ số octan và giảm khí thải độc hại.
7.4. Y Tế và Dược Phẩm
Etanol được sử dụng làm chất khử trùng, sát trùng vết thương, và là thành phần trong nhiều loại thuốc, mỹ phẩm. Glixerol được sử dụng làm chất giữ ẩm trong dược phẩm, mỹ phẩm, và là nguyên liệu để sản xuất thuốc nổ nitroglycerin.
7.5. Công Nghiệp Thực Phẩm
Etanol là thành phần chính trong đồ uống có cồn (rượu, bia, nước giải khát). Glixerol được sử dụng làm chất tạo ngọt, chất bảo quản trong thực phẩm.
Hình ảnh minh họa các ứng dụng phổ biến của ancol etylic trong đời sống.
8. Ancol No và Ancol Không No: Phân Biệt và So Sánh
Điểm khác biệt cơ bản giữa ancol no và ancol không no nằm ở gốc hydrocarbon. Ancol no có gốc hydrocarbon no (chỉ chứa liên kết đơn), trong khi ancol không no có gốc hydrocarbon không no (chứa liên kết đôi hoặc liên kết ba).
| Đặc điểm | Ancol no | Ancol không no |
|---|---|---|
| Liên kết C-C | Chỉ chứa liên kết đơn | Chứa liên kết đôi hoặc liên kết ba |
| Phản ứng cộng | Không tham gia phản ứng cộng | Tham gia phản ứng cộng với H2, Br2, HCl… |
| Ứng dụng | Dung môi, nguyên liệu, nhiên liệu, y tế | Tổng hợp polyme, dược phẩm, hóa chất nông nghiệp |
| Ví dụ | Etanol (C2H5OH) | Anlyl alcohol (CH2=CH-CH2OH) |
9. Lưu Ý Khi Sử Dụng Ancol No: An Toàn và Hiệu Quả
Khi sử dụng ancol no, cần lưu ý một số vấn đề sau để đảm bảo an toàn và hiệu quả:
- Độc tính: Một số ancol no (như methanol) có độc tính cao, có thể gây mù lòa, tổn thương thần kinh, thậm chí tử vong nếu uống phải.
- Tính cháy: Ancol no dễ cháy, cần bảo quản và sử dụng ở nơi thoáng mát, tránh xa nguồn nhiệt và ngọn lửa.
- Tác dụng với da: Tiếp xúc lâu dài với ancol no có thể gây khô da, kích ứng da. Nên sử dụng găng tay bảo hộ khi làm việc với ancol no.
- Nồng độ: Sử dụng đúng nồng độ theo hướng dẫn để đạt hiệu quả tốt nhất và tránh gây hại cho sức khỏe.
10. Tìm Hiểu Sâu Hơn Về Ancol No Cùng Tic.edu.vn
Bạn muốn khám phá thêm về thế giới hóa học thú vị, đặc biệt là về ancol no và các hợp chất hữu cơ khác? tic.edu.vn là nguồn tài liệu học tập phong phú và đáng tin cậy dành cho bạn.
- Đa dạng tài liệu: tic.edu.vn cung cấp các bài giảng, bài tập, đề thi, tài liệu tham khảo về hóa học từ cơ bản đến nâng cao, phù hợp với mọi trình độ.
- Thông tin cập nhật: tic.edu.vn luôn cập nhật những kiến thức mới nhất về hóa học, giúp bạn nắm bắt xu hướng và tiến bộ của khoa học.
- Công cụ hỗ trợ: tic.edu.vn cung cấp các công cụ hỗ trợ học tập trực tuyến hiệu quả như công cụ ghi chú, quản lý thời gian, giúp bạn học tập hiệu quả hơn.
- Cộng đồng học tập: tic.edu.vn xây dựng cộng đồng học tập trực tuyến sôi nổi, nơi bạn có thể trao đổi kiến thức, kinh nghiệm, và kết nối với những người cùng đam mê hóa học.
Đừng bỏ lỡ cơ hội khám phá thế giới hóa học đầy thú vị và bổ ích cùng tic.edu.vn. Hãy truy cập ngay website tic.edu.vn để bắt đầu hành trình chinh phục tri thức! Nếu bạn có bất kỳ thắc mắc nào, đừng ngần ngại liên hệ với chúng tôi qua email [email protected].
FAQ: Giải Đáp Thắc Mắc Về Ancol No
Dưới đây là một số câu hỏi thường gặp về ancol no và những giải đáp chi tiết từ tic.edu.vn:
-
Ancol no có tan trong nước không?
Trả lời: Ancol no tan trong nước do tạo được liên kết hydro với nước. Độ tan giảm khi mạch cacbon tăng. -
Ancol no có cháy không?
Trả lời: Ancol no dễ cháy, tạo ra CO2 và H2O. -
Ancol no có độc không?
Trả lời: Một số ancol no (như methanol) có độc tính cao. -
Ancol no có những loại phản ứng hóa học nào?
Trả lời: Ancol no tham gia phản ứng thế H của nhóm -OH, thế nhóm -OH, tách nước, oxi hóa. -
Ancol no được điều chế như thế nào?
Trả lời: Ancol no được điều chế bằng hydrat hóa anken, thủy phân dẫn xuất halogen, khử anđehit và xeton, phản ứng lên men. -
Ancol no có ứng dụng gì trong đời sống?
Trả lời: Ancol no được dùng làm dung môi, nguyên liệu hóa học, nhiên liệu, trong y tế, dược phẩm, công nghiệp thực phẩm. -
Làm thế nào để phân biệt ancol no và ancol không no?
Trả lời: Dựa vào liên kết C-C trong gốc hydrocarbon: ancol no chỉ có liên kết đơn, ancol không no có liên kết đôi hoặc ba. -
Tại sao nhiệt độ sôi của ancol no cao hơn so với hydrocarbon tương ứng?
Trả lời: Do liên kết hydro giữa các phân tử ancol làm tăng lực hút giữa chúng. -
Ancol etylic có công thức hóa học là gì?
Trả lời: C2H5OH -
Ancol no bậc 3 có bị oxi hóa bởi CuO không?
Trả lời: Không.
Hy vọng những thông tin trên sẽ giúp bạn hiểu rõ hơn về ancol no. Hãy tiếp tục khám phá những kiến thức hóa học thú vị khác trên tic.edu.vn nhé!
Bạn đang gặp khó khăn trong việc tìm kiếm tài liệu học tập chất lượng? Bạn muốn nâng cao kiến thức hóa học một cách hiệu quả và dễ dàng? Hãy đến với tic.edu.vn! Chúng tôi cung cấp nguồn tài liệu học tập đa dạng, đầy đủ và được kiểm duyệt, giúp bạn chinh phục mọi thử thách trong học tập. tic.edu.vn còn cung cấp các công cụ hỗ trợ học tập trực tuyến hiệu quả và xây dựng cộng đồng học tập sôi nổi để bạn có thể tương tác và học hỏi lẫn nhau. Đừng chần chừ, hãy truy cập tic.edu.vn ngay hôm nay để khám phá kho tàng kiến thức vô tận và trải nghiệm phương pháp học tập thông minh! Liên hệ với chúng tôi qua email [email protected] để được tư vấn và hỗ trợ tốt nhất.