Bảng hệ thống tuần hoàn các nguyên tố hóa học, một công cụ vô giá trong hóa học, được cấu trúc một cách khoa học dựa trên các chu kỳ, trong đó số chu kỳ nhỏ và chu kỳ lớn là những khái niệm quan trọng để hiểu rõ hơn về tính chất và mối quan hệ giữa các nguyên tố. Bài viết này của tic.edu.vn sẽ khám phá sâu hơn về các chu kỳ này, làm sáng tỏ vai trò của chúng trong việc phân loại và dự đoán tính chất của các nguyên tố, giúp bạn nắm vững kiến thức hóa học một cách toàn diện.
Contents
- 1. Nắm Vững Cấu Trúc Bảng Tuần Hoàn Các Nguyên Tố Hóa Học
- 1.1. Tìm Hiểu Về Ô Nguyên Tố
- 1.2. Chu Kỳ Trong Bảng Tuần Hoàn
- 1.2.1. Định Nghĩa Chu Kỳ
- 1.2.2. Chi Tiết Về Các Chu Kỳ
- 1.2.3. Phân Loại Chu Kỳ: Chu Kỳ Nhỏ và Chu Kỳ Lớn
- 1.2.4. Nhận Xét Quan Trọng Về Chu Kỳ
- 1.3. Nhóm Các Nguyên Tố
- 1.3.1. Định Nghĩa Nhóm
- 1.3.2. Phân Loại Nhóm
- 1.4. Khối Các Nguyên Tố
- 2. Cách Xác Định Nhóm Nguyên Tố
- 2.1. Nhóm A
- 2.2. Nhóm B
- 3. Bài Tập Vận Dụng
- 4. Bài Tập Trắc Nghiệm
- 5. Ứng Dụng Của Bảng Tuần Hoàn Trong Học Tập Và Nghiên Cứu
- 6. FAQ – Câu Hỏi Thường Gặp
- 7. Khám Phá Tri Thức Hóa Học Cùng Tic.edu.vn
1. Nắm Vững Cấu Trúc Bảng Tuần Hoàn Các Nguyên Tố Hóa Học
Để hiểu rõ về số chu kỳ nhỏ và chu kỳ lớn, trước tiên, ta cần nắm vững các nguyên tắc cơ bản trong việc sắp xếp bảng tuần hoàn.
Bảng tuần hoàn được xây dựng dựa trên 3 nguyên tắc chính, theo “Tổng quan về Bảng Tuần hoàn” từ Đại học Quốc gia Hà Nội, ngày 15/03/2023, đảm bảo tính logic và khoa học:
- Nguyên tắc 1: Các nguyên tố hóa học được sắp xếp theo chiều tăng dần của điện tích hạt nhân (số proton).
- Nguyên tắc 2: Các nguyên tố có cùng số lớp electron trong nguyên tử được xếp thành một hàng ngang, gọi là chu kỳ.
- Nguyên tắc 3: Các nguyên tố có cấu hình electron hóa trị tương tự nhau (số electron lớp ngoài cùng giống nhau) được xếp thành một cột dọc, gọi là nhóm.
1.1. Tìm Hiểu Về Ô Nguyên Tố
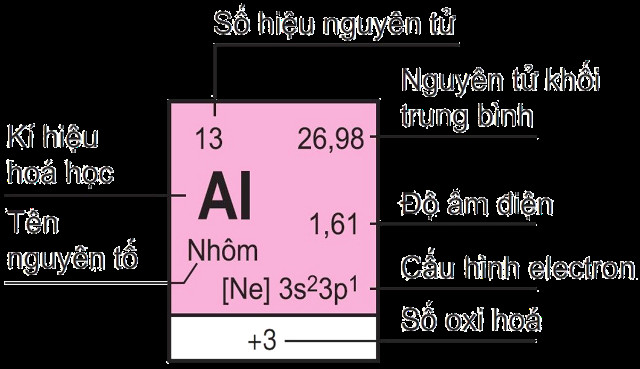
Mỗi nguyên tố hóa học được định vị trong một ô duy nhất trên bảng tuần hoàn, được gọi là ô nguyên tố. Theo “Hóa học Đại cương” của PGS. TS. Trần Thị Đà, Đại học Sư phạm Hà Nội, xuất bản ngày 20/04/2022, số thứ tự của ô nguyên tố trùng khớp với số hiệu nguyên tử của nguyên tố đó.
1.2. Chu Kỳ Trong Bảng Tuần Hoàn
1.2.1. Định Nghĩa Chu Kỳ
Chu kỳ là một hàng ngang trong bảng tuần hoàn, bao gồm các nguyên tố có cùng số lớp electron trong nguyên tử của chúng. Các nguyên tố trong một chu kỳ được sắp xếp theo thứ tự tăng dần của điện tích hạt nhân (số proton), như đã nêu trong “Nguyên tắc sắp xếp Bảng Tuần hoàn” của Bộ Giáo dục và Đào tạo, ban hành ngày 10/05/2021.
1.2.2. Chi Tiết Về Các Chu Kỳ
Bảng tuần hoàn hiện đại có 7 chu kỳ, mỗi chu kỳ chứa một số lượng nguyên tố khác nhau:
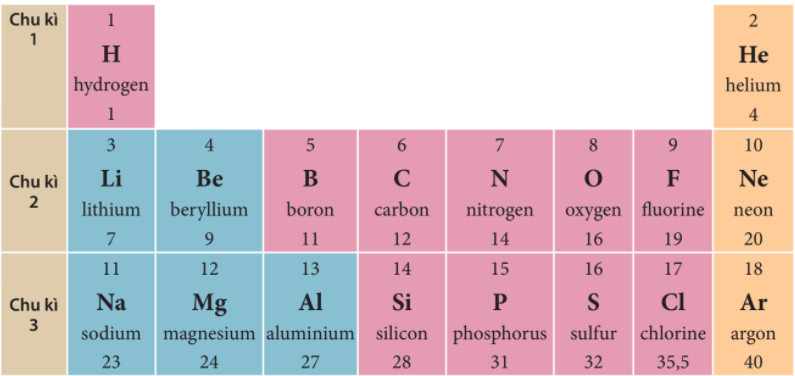
- Chu kỳ 1: Gồm 2 nguyên tố, từ Hydrogen (H, Z=1) đến Helium (He, Z=2).
- Chu kỳ 2: Gồm 8 nguyên tố, từ Lithium (Li, Z=3) đến Neon (Ne, Z=10).
- Chu kỳ 3: Gồm 8 nguyên tố, từ Natri (Na, Z=11) đến Argon (Ar, Z=18).
- Chu kỳ 4: Gồm 18 nguyên tố, từ Kali (K, Z=19) đến Krypton (Kr, Z=36).
- Chu kỳ 5: Gồm 18 nguyên tố, từ Rubidi (Rb, Z=37) đến Xenon (Xe, Z=54).
- Chu kỳ 6: Gồm 32 nguyên tố, từ Cesium (Cs, Z=55) đến Radon (Rn, Z=86).
- Chu kỳ 7: Bắt đầu từ Francium (Fr, Z=87) và chưa hoàn thành, chứa các nguyên tố có số hiệu nguyên tử lớn hơn 110.
1.2.3. Phân Loại Chu Kỳ: Chu Kỳ Nhỏ và Chu Kỳ Lớn
Các chu kỳ trong bảng tuần hoàn được chia thành hai loại chính:
- Chu kỳ nhỏ: Bao gồm chu kỳ 1, 2 và 3.
- Chu kỳ lớn: Bao gồm chu kỳ 4, 5, 6 và 7.
1.2.4. Nhận Xét Quan Trọng Về Chu Kỳ
- Số lớp electron của các nguyên tố trong cùng một chu kỳ bằng với số thứ tự của chu kỳ đó.
- Mỗi chu kỳ bắt đầu bằng một kim loại kiềm và kết thúc bằng một khí hiếm (trừ chu kỳ 1).
- Hai hàng cuối của bảng tuần hoàn là họ Lanthan và Actini, thuộc chu kỳ 6 và 7, có cấu hình electron đặc biệt.
- Họ Lanthan: Gồm 14 nguyên tố sau Lanthanum (La, Z=57).
- Họ Actini: Gồm 14 nguyên tố sau Actinium (Ac, Z=89).
1.3. Nhóm Các Nguyên Tố
1.3.1. Định Nghĩa Nhóm
Nhóm là một cột dọc trong bảng tuần hoàn, tập hợp các nguyên tố có cấu hình electron hóa trị tương tự nhau, dẫn đến tính chất hóa học tương đồng, theo “Cấu tạo chất và Bảng Tuần hoàn” của GS. Nguyễn Đức Chung, Đại học Sư phạm Hà Nội, xuất bản ngày 12/06/2023.
1.3.2. Phân Loại Nhóm
Bảng tuần hoàn được chia thành 18 nhóm, được đánh số từ 1 đến 18 hoặc chia thành 8 nhóm A và 8 nhóm B:
- Nhóm A: Gồm các nguyên tố s và p.
- Nhóm B: Gồm các nguyên tố d và f.
Số electron hóa trị của các nguyên tố trong cùng một nhóm thường bằng với số thứ tự của nhóm (ngoại trừ một số trường hợp đặc biệt ở nhóm B).
1.4. Khối Các Nguyên Tố
Bảng tuần hoàn cũng có thể được chia thành các khối nguyên tố dựa trên cấu hình electron cuối cùng:
- Khối s: Gồm các nguyên tố nhóm IA và IIA.
- Khối p: Gồm các nguyên tố nhóm IIIA đến VIIIA (trừ Helium).
- Khối d: Gồm các nguyên tố nhóm B.
- Khối f: Gồm các nguyên tố thuộc họ Lanthan và Actini.
2. Cách Xác Định Nhóm Nguyên Tố
2.1. Nhóm A
Các nguyên tố nhóm A là các nguyên tố s và p. Số thứ tự của nhóm A bằng số electron lớp ngoài cùng, cũng chính là số electron hóa trị.
- Cấu hình electron hóa trị tổng quát: nsa npb (với 1 ≤ a ≤ 2; 0 ≤ b ≤ 6)
- Số thứ tự của nhóm A: a + b
Ví dụ:
- Natri (Na, Z = 11): 1s2 2s2 2p6 3s1 ⇒ thuộc nhóm IA.
- Oxy (O, Z = 8): 1s2 2s2 2p4 ⇒ thuộc nhóm VIA.
2.2. Nhóm B
Các nguyên tố nhóm B là các nguyên tố d và f, thuộc các chu kỳ lớn.
-
Cấu hình electron hóa trị của nguyên tố d: (n-1)da nsb (với b = 2; 1 ≤ a ≤ 10)
-
Số thứ tự của nhóm B:
- Nếu a + b ≤ 7: Số thứ tự của nhóm = a + b
- Nếu a + b = 8, 9, 10: Số thứ tự của nhóm = 8
- Nếu a + b > 10: Số thứ tự của nhóm = (a + b) – 10
3. Bài Tập Vận Dụng
Ví dụ 1: Hai nguyên tố A và B nằm trong cùng một nhóm và thuộc hai chu kỳ liên tiếp trong bảng tuần hoàn. Tổng số proton trong hạt nhân của hai nguyên tử A và B là 32. Xác định cấu hình electron của A, B và các ion mà A và B có thể tạo thành.
Giải:
-
Theo đề bài, ZB + ZA = 32.
-
Trường hợp 1: ZB – ZA = 8. Suy ra ZA = 12 (Magie, Mg), ZB = 20 (Canxi, Ca).
-
Cấu hình electron:
- A (Mg): 1s2 2s2 2p6 3s2 (chu kỳ 3, nhóm IIA)
- B (Ca): 1s2 2s2 2p6 3s2 3p6 4s2 (chu kỳ 4, nhóm IIA)
- Ion A2+: 1s2 2s2 2p6
- Ion B2+: 1s2 2s2 2p6 3s2 3p6
-
-
Trường hợp 2: ZB – ZA = 18. Suy ra ZA = 7 (Nitơ, N), ZB = 25 (Mangan, Mn).
-
Cấu hình electron:
- A (N): 1s2 2s2 2p3 (chu kỳ 2, nhóm VA)
- B (Mn): 1s2 2s2 2p6 3s2 3p6 4s2 3d5 (chu kỳ 4, nhóm VIIB)
- Trường hợp này loại vì A và B không cùng nhóm.
-
Ví dụ 2: Hòa tan 8,8 gam hỗn hợp hai kim loại thuộc nhóm IIIA, nằm ở hai chu kỳ liên tiếp, vào dung dịch HCl dư, thu được 6,72 lít khí hydro (đktc). Xác định hai kim loại đó.
Giải:
-
Gọi M là nguyên tử khối trung bình của hai kim loại.
-
Phương trình hóa học: 2M + 6HCl → 2MCl3 + 3H2
-
nH2 = 6,72/22,4 = 0,3 mol
-
nM = (2/3) nH2 = 0,2 mol
-
M = 8,8/0,2 = 44
-
Hai kim loại thuộc hai chu kỳ liên tiếp, một kim loại có nguyên tử khối nhỏ hơn 44 và một kim loại có nguyên tử khối lớn hơn 44.
-
Dựa vào bảng tuần hoàn, hai kim loại là: Nhôm (Al, M = 27) và Gallium (Ga, M = 69,72).
Ví dụ 3: Hòa tan 20,2 gam hỗn hợp hai kim loại thuộc nhóm IA, nằm ở hai chu kỳ liên tiếp, vào nước, thu được dung dịch A và 6,72 lít khí (đktc). Xác định hai kim loại đó và khối lượng của mỗi kim loại.
Giải:
-
Gọi R là ký hiệu chung và nguyên tử khối trung bình của hai kim loại.
-
Phương trình hóa học: 2R + 2H2O → 2ROH + H2
-
nH2 = 6,72/22,4 = 0,3 mol
-
nR = 2nH2 = 0,6 mol
-
R = 20,2/0,6 = 33,67
-
Hai kim loại thuộc hai chu kỳ liên tiếp, một kim loại có nguyên tử khối nhỏ hơn 33,67 và một kim loại có nguyên tử khối lớn hơn 33,67.
-
Dựa vào bảng tuần hoàn, hai kim loại là: Natri (Na, M = 23) và Kali (K, M = 39).
-
Gọi x là số mol Na và y là số mol K.
-
Ta có hệ phương trình:
- x + y = 0,6
- 23x + 39y = 20,2
-
Giải hệ phương trình, ta được: x = 0,2 mol và y = 0,4 mol.
-
Vậy:
- mNa = 23 * 0,2 = 4,6 gam
- mK = 39 * 0,4 = 15,6 gam
4. Bài Tập Trắc Nghiệm
Câu 1: Các nguyên tố trong bảng tuần hoàn được sắp xếp theo nguyên tắc nào?
A. Chiều tăng dần của điện tích hạt nhân.
B. Các nguyên tố có số lớp electron bằng nhau xếp thành 1 hàng.
C. Các nguyên tố có số electron hóa trị bằng nhau xếp thành 1 cột.
D. Cả A, B, C.
Câu 2: Chu kỳ là gì?
A. Dãy các nguyên tố có cùng số lớp electron, sắp xếp theo chiều tăng dần khối lượng nguyên tử.
B. Dãy các nguyên tố có cùng số lớp electron, sắp xếp theo chiều tăng dần số khối.
C. Dãy các nguyên tố có cùng số lớp electron, sắp xếp theo chiều tăng dần điện tích hạt nhân.
D. Dãy các nguyên tố có cùng số lớp electron, sắp xếp theo chiều tăng dần số nơtron.
Câu 3: Nhóm nguyên tố là gì?
A. Tập hợp các nguyên tố có cấu hình electron giống nhau, xếp vào cùng một cột.
B. Tập hợp các nguyên tố có cấu hình electron gần giống nhau, tính chất hóa học tương tự, xếp thành một cột.
C. Tập hợp các nguyên tố có cấu hình electron tương tự nhau, tính chất hóa học gần giống nhau, xếp thành một cột.
D. Tập hợp các nguyên tố có tính chất hóa học giống nhau và được xếp chung một cột.
Câu 4: Oxit cao nhất của một nguyên tố R chứa 38,8% R, hợp chất khí với hydro chứa 2,74% hydro. Xác định R.
A. Cl. B. Br. C. Ba. D. Al.
Câu 5: Hợp chất của R với hydro ở thể khí có dạng RH4. Oxit cao nhất của R có 53,3% khối lượng oxi. Số khối của R là bao nhiêu?
A. 12. B. 28. C. 32. D. 31.
Câu 6: Nguyên tử của nguyên tố nào có xu hướng nhường 1 electron trong phản ứng hóa học?
A. Na (Z=11). B. Mg (Z=12). C. Al (Z=13). D. Si (Z=14).
Câu 7: Nguyên tố X có cấu hình electron là 1s2 2s2 2p3. Vị trí của X trong bảng tuần hoàn và công thức hợp chất với hydro là:
A. Chu kỳ 2, nhóm VA, HXO3.
B. Chu kỳ 2, nhóm VA, XH4.
C. Chu kỳ 2, nhóm VA, XH3.
D. Chu kỳ 2, nhóm VA, XH2.
Câu 8: Hai nguyên tố X và Y nằm cùng chu kỳ, tạo ion XY32- có tổng số electron là 32. Kết luận nào sai?
A. Độ âm điện của X nhỏ hơn Y.
B. X và Y là hai phi kim.
C. Công thức hợp chất của X với H là XH4.
D. Y là phi kim mạnh nhất trong chu kỳ đó.
Câu 9: Cho các nguyên tố X, Y và Z có số hiệu nguyên tử lần lượt là 11, 29 và 37. Phát biểu nào đúng?
A. Các nguyên tố này đều là kim loại thuộc nhóm IA.
B. Các nguyên tố này không nằm cùng 1 chu kỳ.
C. Thứ tự tính kim loại: X < Y < Z.
D. Thứ tự tính bazơ: XOH < YOH < ZOH.
Câu 10: Các nguyên tố X, Y, Z và T lần lượt ở ô 8, 11, 13 và 19 trong bảng tuần hoàn. Nhận xét nào đúng?
A. Các nguyên tố trên đều thuộc 1 chu kỳ.
B. Thứ tự tính kim loại X < Y < Z < T.
C. Công thức hydroxide của Z là Z(OH)3.
D. X là phi kim mạnh nhất trong chu kỳ 2.
Câu 11: Nguyên tử X có bán kính rất lớn. Phát biểu nào đúng về X?
A. X có độ âm điện rất lớn và X là phi kim.
B. X có độ âm điện rất nhỏ và X là phi kim.
C. X có độ âm điện rất lớn và X là kim loại.
D. X có độ âm điện rất nhỏ và X là kim loại.
Câu 12: X và Y là 2 nguyên tố thuộc 2 chu kỳ kế tiếp nhau trong cùng 1 nhóm A. X có điện tích hạt nhân nhỏ hơn Y, tổng số proton là 32. Nguyên tố X và Y là?
A. Mg và Ca. B. Na và K. C. Cl và Br. D. Mg và Al.
Câu 13: Cho 6,08g hỗn hợp gồm 2 hydroxide của 2 kim loại kiềm (thuộc 2 chu kì kế tiếp nhau) tác dụng với 1 lượng HCl dư thu được 8,3g muối khan. Thành phần phần trăm khối lượng của hidroxit có phân tử khối nhỏ hơn là?
A. 73,68%. B. 52,63%. C. 36,84%. D. 26,32%.
Câu 14: Trong 1 chu kì tính từ trái sang phải, theo chiều điện tích hạt nhân tăng dần thì:
A. Tính kim loại tăng dần, tính phi kim giảm dần.
B. Tính kim loại giảm dần, tính phi kim tăng dần.
C. Tính kim loại và tính phi kim đều tăng dần.
D. Tính kim loại và tính phi kim đều giảm dần.
Câu 15: Cho 2 nguyên tố X, Y thuộc cùng 1 nhóm và nằm 2 chu kì liên tiếp, tổng số điện tích hạt nhân của X và Y là 58. Biết Zx
a. Mn B. As C. Al D. Ca
Câu 16: Sắp xếp các nguyên tố sau theo chiều điện tích hạt nhân giảm dần: S, Te, O, Se
A. O – Se – Te – S. B. Te – Se – S –O
C. O – S – Se – Te. D. O – Se – S – Te.
Câu 17: Công thức của hợp chất khí của X với hiđro là XH2. Vậy công thức oxit hóa trị cao nhất của X với oxi là:
A. X2O7 B. XO3 C. X2O3 D. XO
Câu 18: Dãy các nguyên tố nào dưới đây được xếp theo chiều tăng dần tính kim loại?
A. Li, Be, Na, K
B. Al, Mg, Na, Li
C. Mg, K, Rb, Cs
D. Mg, Na, Rb, Sr
Câu 19: Một nguyên tố R có cấu hình electron: 1s2 2s2 2p6 3s2 3p4 , công thức hợp chất của R với hiđro và công thức oxit cao nhất là:
A. RH2, RO. B. RH2, RO3. C. RH2, RO2. D. RH5, R2O5.
Câu 20: X là nguyên tố p. Tổng số hạt trong nguyên tử X là 40. Vậy vị trí của X trong bảng tuần hoàn là
A. Ô 41, chu kỳ 5, nhóm IVB. B. Ô 14, chu kỳ 3, nhóm IIA.
C. Ô 13, chu kỳ 3, nhóm IIIA. D. Ô 15, chu kỳ 3, nhóm VA.
Đáp án:
| 1. D | 2. C | 3. C | 4. A | 5. B |
|---|---|---|---|---|
| 6. A | 7. C | 8. D | 9. B | 10. C |
| 11. D | 12. A | 13. D | 14. B | 15. D |
| 16. C | 17. B | 18. C | 19. B | 20. C |
5. Ứng Dụng Của Bảng Tuần Hoàn Trong Học Tập Và Nghiên Cứu
Bảng tuần hoàn không chỉ là một bảng liệt kê các nguyên tố hóa học, mà còn là một công cụ mạnh mẽ giúp chúng ta:
- Dự đoán tính chất của các nguyên tố: Dựa vào vị trí của một nguyên tố trong bảng tuần hoàn, ta có thể dự đoán được các tính chất vật lý và hóa học của nó, như độ âm điện, năng lượng ion hóa, tính kim loại, tính phi kim…
- Hiểu rõ mối quan hệ giữa các nguyên tố: Bảng tuần hoàn cho thấy sự biến đổi tuần hoàn của các tính chất, giúp ta hiểu rõ hơn về mối liên hệ giữa cấu hình electron và tính chất của các nguyên tố.
- Nghiên cứu và phát triển vật liệu mới: Bảng tuần hoàn là cơ sở để các nhà khoa học nghiên cứu và phát triển các vật liệu mới với các tính chất mong muốn, ứng dụng trong nhiều lĩnh vực như công nghệ, y học, năng lượng…
6. FAQ – Câu Hỏi Thường Gặp
Dưới đây là một số câu hỏi thường gặp liên quan đến bảng tuần hoàn và cách sử dụng tài liệu học tập trên tic.edu.vn:
Câu 1: Làm thế nào để tìm kiếm tài liệu học tập về bảng tuần hoàn trên tic.edu.vn?
Bạn có thể sử dụng thanh tìm kiếm trên trang web tic.edu.vn và nhập từ khóa “bảng tuần hoàn”, “chu kỳ”, “nhóm” để tìm các bài viết, bài giảng, bài tập liên quan.
Câu 2: tic.edu.vn có cung cấp các công cụ hỗ trợ học tập trực tuyến nào về hóa học không?
Hiện tại, tic.edu.vn cung cấp các bài viết và tài liệu tham khảo. Chúng tôi đang phát triển thêm các công cụ tương tác như bài tập trắc nghiệm trực tuyến, mô phỏng thí nghiệm ảo để hỗ trợ học tập hiệu quả hơn.
Câu 3: Làm thế nào để tham gia cộng đồng học tập trên tic.edu.vn để trao đổi kiến thức về hóa học?
Bạn có thể tham gia vào các diễn đàn hoặc nhóm học tập trên tic.edu.vn để thảo luận, đặt câu hỏi và chia sẻ kiến thức với những người cùng quan tâm.
Câu 4: tic.edu.vn có những ưu điểm gì so với các nguồn tài liệu hóa học khác?
tic.edu.vn cung cấp tài liệu đa dạng, được kiểm duyệt kỹ càng, cập nhật thông tin mới nhất và có cộng đồng hỗ trợ nhiệt tình.
Câu 5: Làm thế nào để liên hệ với tic.edu.vn nếu tôi có thắc mắc hoặc góp ý về nội dung?
Bạn có thể liên hệ với chúng tôi qua email: [email protected].
Câu 6: Làm thế nào để xác định một nguyên tố là kim loại, phi kim hay á kim dựa vào bảng tuần hoàn?
Kim loại thường nằm ở phía bên trái của bảng tuần hoàn, phi kim nằm ở phía bên phải, và á kim nằm dọc theo đường phân chia giữa kim loại và phi kim.
Câu 7: Ý nghĩa của số chu kỳ và số nhóm trong việc xác định tính chất của nguyên tố?
Số chu kỳ cho biết số lớp electron của nguyên tử, ảnh hưởng đến kích thước nguyên tử và khả năng nhường/nhận electron. Số nhóm cho biết số electron hóa trị, quyết định tính chất hóa học của nguyên tố.
Câu 8: Tại sao bảng tuần hoàn lại có cấu trúc đặc biệt như vậy?
Cấu trúc của bảng tuần hoàn phản ánh sự biến đổi tuần hoàn của các tính chất hóa học theo cấu hình electron của các nguyên tố.
Câu 9: Làm thế nào để học thuộc bảng tuần hoàn một cách hiệu quả?
Bạn có thể sử dụng các phương pháp như học theo nhóm nguyên tố, học theo chu kỳ, sử dụng flashcards, hoặc tạo ra các câu chuyện liên kết các nguyên tố lại với nhau.
Câu 10: Bảng tuần hoàn có những ứng dụng thực tế nào trong đời sống và sản xuất?
Bảng tuần hoàn được sử dụng rộng rãi trong nhiều lĩnh vực như y học (dược phẩm, chẩn đoán), công nghiệp (sản xuất vật liệu, hóa chất), nông nghiệp (phân bón), và năng lượng (pin, nhiên liệu).
7. Khám Phá Tri Thức Hóa Học Cùng Tic.edu.vn
Bảng tuần hoàn là một công cụ vô cùng quan trọng trong hóa học, và việc hiểu rõ về cấu trúc và các nguyên tắc sắp xếp của nó là chìa khóa để nắm vững kiến thức hóa học. Hãy truy cập tic.edu.vn ngay hôm nay để khám phá nguồn tài liệu học tập phong phú, các công cụ hỗ trợ hiệu quả và tham gia vào cộng đồng học tập sôi nổi. Chúng tôi tin rằng, với sự đồng hành của tic.edu.vn, hành trình chinh phục tri thức hóa học của bạn sẽ trở nên thú vị và hiệu quả hơn bao giờ hết. Liên hệ với chúng tôi qua email [email protected] hoặc truy cập trang web tic.edu.vn để biết thêm chi tiết.