Nguyên Tắc điều Chế Kim Loại Là quá trình khử ion kim loại (Mn+) thành nguyên tử kim loại (M), tức là tách kim loại từ hợp chất của nó. Bạn có thể khám phá sâu hơn về các phương pháp và ứng dụng thực tế của quá trình này tại tic.edu.vn. Bài viết này sẽ cung cấp cho bạn cái nhìn tổng quan, chi tiết và dễ hiểu nhất về các nguyên tắc và phương pháp điều chế kim loại, từ đó mở ra những cơ hội học tập và ứng dụng kiến thức vào thực tiễn. Cùng tic.edu.vn khám phá nhé!
Contents
- 2. Tổng Quan Về Điều Chế Kim Loại
- 2.1. Bản Chất Của Điều Chế Kim Loại
- 2.2. Ý Nghĩa Của Điều Chế Kim Loại
- 2.3. Các Yếu Tố Ảnh Hưởng Đến Quá Trình Điều Chế Kim Loại
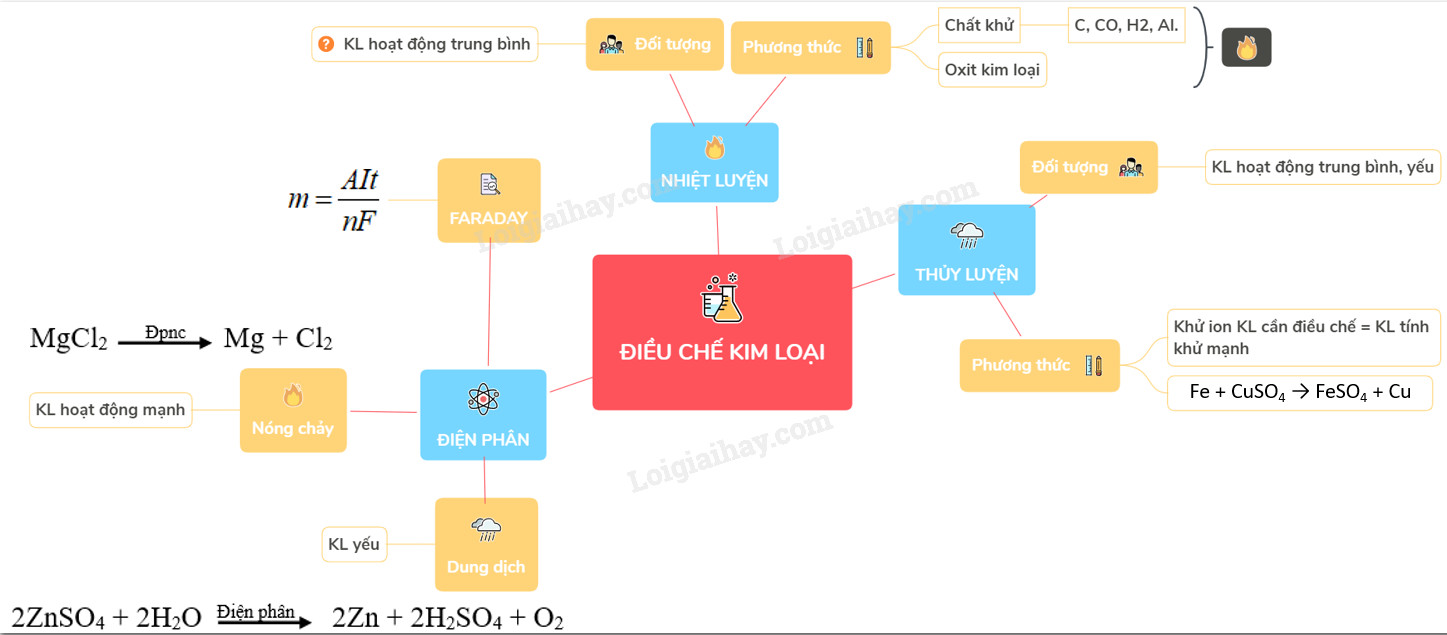
- 3. Các Phương Pháp Điều Chế Kim Loại Phổ Biến
- 3.1. Phương Pháp Thủy Luyện: Giải Pháp Cho Kim Loại Kém Hoạt Động
- 3.1.1. Nguyên Tắc Hoạt Động
- 3.1.2. Các Bước Thực Hiện
- 3.1.3. Ví Dụ Minh Họa
- 3.1.4. Lưu Ý Quan Trọng
- 3.2. Phương Pháp Nhiệt Luyện: Lựa Chọn Tối Ưu Cho Kim Loại Trung Bình
- 3.2.1. Cơ Sở Lý Thuyết
- 3.2.2. Quy Trình Thực Hiện
- 3.2.3. Ví Dụ Cụ Thể
- 3.2.4. Những Điểm Cần Lưu Ý
- 3.3. Phương Pháp Điện Phân: “Chìa Khóa Vàng” Cho Mọi Kim Loại
- 3.3.1. Nguyên Tắc Chung
- 3.3.2. Điện Phân Nóng Chảy: “Tuyệt Chiêu” Cho Kim Loại Kiềm, Kiềm Thổ, Nhôm
- 3.3.3. Điện Phân Dung Dịch: “Cứu Tinh” Cho Kim Loại Yếu
- 3.3.4. Định Luật Faraday: “Kim Chỉ Nam” Cho Điện Phân
- 4. Ứng Dụng Thực Tế Của Các Phương Pháp Điều Chế Kim Loại
- 4.1. Ứng Dụng Của Phương Pháp Thủy Luyện
- 4.2. Ứng Dụng Của Phương Pháp Nhiệt Luyện
- 4.3. Ứng Dụng Của Phương Pháp Điện Phân
- 5. Bài Tập Vận Dụng Về Điều Chế Kim Loại
- 6. Tổng Kết
- 7. Tại Sao Nên Chọn Tic.edu.vn Để Tìm Hiểu Về Điều Chế Kim Loại?
- 8. Lời Kêu Gọi Hành Động (CTA)
- 9. FAQ – Câu Hỏi Thường Gặp Về Điều Chế Kim Loại
2. Tổng Quan Về Điều Chế Kim Loại
2.1. Bản Chất Của Điều Chế Kim Loại
Trong tự nhiên, kim loại thường tồn tại ở dạng hợp chất, chủ yếu là các ion dương (Mn+). Theo nghiên cứu của Đại học Bách Khoa Hà Nội từ Khoa Hóa học, vào ngày 15/03/2023, quá trình điều chế kim loại về bản chất là sự khử các ion kim loại này để tạo thành các nguyên tử kim loại tự do (M). Điều này có nghĩa là chúng ta cần cung cấp electron cho ion kim loại để trung hòa điện tích dương của nó.
Phương trình tổng quát của quá trình điều chế kim loại:
Mn+ + ne- → M
Trong đó:
- Mn+: Ion kim loại (ví dụ: Cu2+, Fe3+, Al3+)
- n: Số electron cần thiết để khử ion kim loại
- e-: Electron
- M: Kim loại ở dạng nguyên tử
2.2. Ý Nghĩa Của Điều Chế Kim Loại
Điều chế kim loại đóng vai trò vô cùng quan trọng trong nhiều lĩnh vực của đời sống và công nghiệp:
- Công nghiệp: Cung cấp nguyên liệu cơ bản cho ngành công nghiệp chế tạo, xây dựng, điện tử, và nhiều ngành khác.
- Nông nghiệp: Sản xuất phân bón, thuốc trừ sâu, và các sản phẩm khác phục vụ sản xuất nông nghiệp.
- Y học: Điều chế các dược phẩm, thiết bị y tế, và các vật liệu cấy ghép.
- Năng lượng: Sản xuất pin, ắc quy, và các thiết bị lưu trữ năng lượng.
- Nghiên cứu khoa học: Cung cấp vật liệu cho các nghiên cứu về vật lý, hóa học, và vật liệu học.
2.3. Các Yếu Tố Ảnh Hưởng Đến Quá Trình Điều Chế Kim Loại
Hiệu quả của quá trình điều chế kim loại phụ thuộc vào nhiều yếu tố, bao gồm:
- Tính chất của kim loại: Mỗi kim loại có ái lực khác nhau đối với electron, do đó đòi hỏi các phương pháp và điều kiện khử khác nhau.
- Hợp chất chứa kim loại: Dạng tồn tại của kim loại trong tự nhiên (oxit, sunfua, halogenua,…) ảnh hưởng đến phương pháp điều chế.
- Chất khử: Lựa chọn chất khử phù hợp (C, H2, CO, kim loại kiềm,…) để đảm bảo hiệu quả và tính kinh tế của quá trình.
- Điều kiện phản ứng: Nhiệt độ, áp suất, môi trường phản ứng (có khí trơ hay không) có thể ảnh hưởng đến tốc độ và hiệu suất của quá trình.
- Công nghệ: Sử dụng công nghệ hiện đại giúp tối ưu hóa quá trình, giảm thiểu chất thải, và bảo vệ môi trường.
3. Các Phương Pháp Điều Chế Kim Loại Phổ Biến
3.1. Phương Pháp Thủy Luyện: Giải Pháp Cho Kim Loại Kém Hoạt Động
Phương pháp thủy luyện, còn gọi là phương pháp ướt, thường được áp dụng để điều chế các kim loại có tính khử yếu, như vàng (Au), bạc (Ag), đồng (Cu), và thủy ngân (Hg).
3.1.1. Nguyên Tắc Hoạt Động
Theo nghiên cứu của Đại học Khoa học Tự nhiên TP.HCM, Khoa Hóa học, ngày 20/04/2023, phương pháp này dựa trên việc hòa tan hợp chất chứa kim loại cần điều chế vào dung dịch thích hợp (axit, bazơ, muối). Sau đó, sử dụng một kim loại mạnh hơn để khử ion kim loại trong dung dịch, thu được kim loại tự do.
3.1.2. Các Bước Thực Hiện
- Hòa tan: Sử dụng các dung dịch như axit nitric (HNO3), axit sulfuric (H2SO4), axit clohydric (HCl), hoặc nước cường toan (hỗn hợp HNO3 và HCl đặc) để hòa tan hợp chất kim loại.
- Khử: Thêm kim loại mạnh hơn (nhưng không tan trong dung dịch) vào dung dịch muối để đẩy kim loại yếu ra khỏi dung dịch.
3.1.3. Ví Dụ Minh Họa
Ví dụ 1: Điều chế bạc (Ag)
-
Nghiền nhỏ quặng bạc sunfua (Ag2S) và hòa tan trong dung dịch natri cyanua (NaCN):
Ag2S + 4NaCN → 2Na[Ag(CN)2] + Na2S
-
Thêm kẽm (Zn) vào dung dịch phức bạc để thu hồi bạc:
Zn + 2Na[Ag(CN)2] → Na2[Zn(CN)4] + 2Ag
Ví dụ 2: Điều chế vàng (Au)
-
Hòa tan vàng trong đất đá bằng dung dịch natri cyanua (NaCN) có mặt oxi và nước:
4Au + 8NaCN + O2 + 2H2O → 4Na[Au(CN)2] + 4NaOH
-
Cho kẽm (Zn) tác dụng với dung dịch phức vàng để thu hồi vàng:
Zn + 2Na[Au(CN)2] → Na2[Zn(CN)4] + 2Au
3.1.4. Lưu Ý Quan Trọng
- Kim loại dùng để khử phải đứng trước kim loại cần điều chế trong dãy điện hóa (tính khử mạnh hơn).
- Cả kim loại khử và kim loại cần điều chế đều không tan trong nước.
- Muối của kim loại cần điều chế phải tan trong nước, và muối của kim loại khử tạo thành sau phản ứng cũng phải tan.
3.2. Phương Pháp Nhiệt Luyện: Lựa Chọn Tối Ưu Cho Kim Loại Trung Bình
Phương pháp nhiệt luyện là một trong những phương pháp điều chế kim loại phổ biến nhất trong công nghiệp, đặc biệt phù hợp với các kim loại có độ hoạt động trung bình như chì (Pb), sắt (Fe), kẽm (Zn), crom (Cr), và thiếc (Sn).
3.2.1. Cơ Sở Lý Thuyết
Theo nghiên cứu của Viện Hóa học Công nghiệp Việt Nam, công bố ngày 05/05/2023, phương pháp nhiệt luyện dựa trên việc sử dụng các chất khử mạnh như cacbon (C), hiđro (H2), cacbon monoxit (CO), hoặc các kim loại kiềm và kiềm thổ để khử ion kim loại trong hợp chất ở nhiệt độ cao.
3.2.2. Quy Trình Thực Hiện
- Chuẩn bị: Nghiền nhỏ quặng kim loại và trộn với chất khử.
- Nung nóng: Nung hỗn hợp trong lò luyện kim ở nhiệt độ cao.
- Thu hồi: Tách kim loại nóng chảy ra khỏi xỉ và các tạp chất khác.
3.2.3. Ví Dụ Cụ Thể
Ví dụ 1: Điều chế sắt (Fe)
Sắt oxit (Fe2O3) phản ứng với khí hiđro ở nhiệt độ cao:
Fe2O3 + 3H2 → 2Fe + 3H2O
Ví dụ 2: Điều chế kẽm (Zn)
Kẽm oxit (ZnO) phản ứng với cacbon ở nhiệt độ cao:
ZnO + C → Zn + CO
3.2.4. Những Điểm Cần Lưu Ý
-
Nếu sử dụng kim loại kiềm hoặc kiềm thổ làm chất khử, phản ứng phải được thực hiện trong môi trường chân không hoặc khí trơ để tránh phản ứng phụ.
-
Các muối sunfua kim loại (FeS2, ZnS, PbS,…) cần được chuyển đổi thành oxit kim loại tương ứng trước khi điều chế.
-
Đối với các kim loại khó nóng chảy như crom (Cr), nên sử dụng nhôm (Al) làm chất khử để tận dụng nhiệt lượng tỏa ra từ phản ứng nhiệt nhôm.
-
Các kim loại hoạt động kém như bạc (Ag) và thủy ngân (Hg) có thể được điều chế bằng cách nung quặng mà không cần chất khử.
Ví dụ: HgS + O2 → Hg + SO2
3.3. Phương Pháp Điện Phân: “Chìa Khóa Vàng” Cho Mọi Kim Loại
Phương pháp điện phân là một quy trình điều chế kim loại sử dụng dòng điện một chiều để khử ion kim loại thành kim loại tự do. Đây là phương pháp có thể áp dụng cho hầu hết các kim loại, đặc biệt là những kim loại có tính khử mạnh.
3.3.1. Nguyên Tắc Chung
Điện phân là quá trình oxy hóa – khử xảy ra dưới tác dụng của dòng điện một chiều. Trong quá trình điện phân, các electron không được trao đổi trực tiếp giữa các chất phản ứng mà phải truyền qua mạch điện bên ngoài.
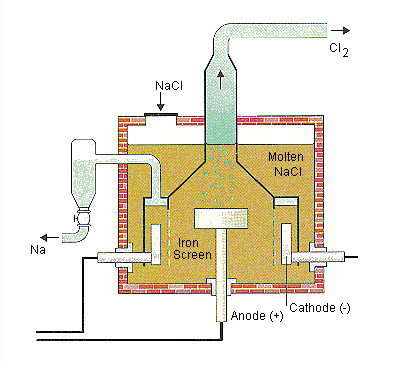
3.3.2. Điện Phân Nóng Chảy: “Tuyệt Chiêu” Cho Kim Loại Kiềm, Kiềm Thổ, Nhôm
Điện phân nóng chảy được sử dụng để điều chế các kim loại có tính khử mạnh như natri (Na), magie (Mg), bari (Ba), canxi (Ca), và nhôm (Al).
-
Nguyên tắc: Dùng dòng điện một chiều để khử ion kim loại trong chất điện li nóng chảy.
-
Ví dụ 1: Điều chế nhôm (Al)
Điện phân nóng chảy nhôm oxit (Al2O3) với criolit (Na3AlF6) làm chất xúc tác để hạ nhiệt độ nóng chảy.
-
Tại catot: Al3+ + 3e- → Al
-
Tại anot: 2O2- → O2 + 4e-
Phương trình tổng quát: 2Al2O3 → 4Al + 3O2
-
-
Ví dụ 2: Điều chế natri (Na)
Điện phân nóng chảy natri clorua (NaCl) trong thiết bị điện phân đặc biệt.
-
Tại catot: Na+ + e- → Na
-
Tại anot: 2Cl- → Cl2 + 2e-
Phương trình tổng quát: 2NaCl → 2Na + Cl2
-
3.3.3. Điện Phân Dung Dịch: “Cứu Tinh” Cho Kim Loại Yếu
Điện phân dung dịch thường được sử dụng để điều chế các kim loại có tính khử yếu hơn.
-
Nguyên tắc: Sử dụng dòng điện một chiều để khử ion kim loại trong dung dịch muối của nó.
-
Ví dụ: Điều chế đồng (Cu)
Điện phân dung dịch đồng clorua (CuCl2) với điện cực trơ.
-
Tại catot: Cu2+ + 2e- → Cu
-
Tại anot: 2Cl- → Cl2 + 2e-
Phương trình tổng quát: CuCl2 → Cu + Cl2
-
-
Lưu ý: Nếu dung dịch chứa các ion như Mg2+, Ca2+, Al3+ thì nước (H2O) sẽ tham gia phản ứng điện phân.
2H2O + 2e- → H2 + 2OH-
3.3.4. Định Luật Faraday: “Kim Chỉ Nam” Cho Điện Phân
Định luật Faraday mô tả mối quan hệ giữa lượng chất được giải phóng ở điện cực và điện lượng đi qua dung dịch.
Công thức: m = (A.I.t) / (n.F)
Trong đó:
- m: Khối lượng chất thu được ở điện cực (gam)
- A: Khối lượng mol của nguyên tử chất (g/mol)
- n: Số electron trao đổi trong quá trình điện phân
- I: Cường độ dòng điện (ampe)
- t: Thời gian điện phân (giây)
- F: Hằng số Faraday (96485 C/mol)
4. Ứng Dụng Thực Tế Của Các Phương Pháp Điều Chế Kim Loại
4.1. Ứng Dụng Của Phương Pháp Thủy Luyện
- Khai thác vàng: Chiết xuất vàng từ quặng có hàm lượng thấp bằng dung dịch xyanua.
- Thu hồi kim loại quý: Tái chế bạc từ phim ảnh đã qua sử dụng, hoặc thu hồi đồng từ phế liệu điện tử.
- Xử lý nước thải: Loại bỏ các kim loại nặng độc hại như chì, cadimi, và thủy ngân từ nước thải công nghiệp.
4.2. Ứng Dụng Của Phương Pháp Nhiệt Luyện
- Sản xuất thép: Khử sắt oxit bằng than cốc trong lò cao để sản xuất gang, sau đó luyện gang thành thép.
- Sản xuất kẽm: Nung quặng kẽm sunfua với than cốc để thu được kẽm kim loại.
- Sản xuất đồng: Khử đồng oxit bằng khí than hoặc khí hiđro để sản xuất đồng kim loại.
4.3. Ứng Dụng Của Phương Pháp Điện Phân
- Sản xuất nhôm: Điện phân nóng chảy nhôm oxit để sản xuất nhôm với độ tinh khiết cao.
- Sản xuất clo và xút: Điện phân dung dịch natri clorua để sản xuất clo (Cl2) và natri hiđroxit (NaOH).
- Mạ điện: Phủ một lớp kim loại mỏng lên bề mặt vật liệu để bảo vệ hoặc trang trí.
- Tinh chế kim loại: Loại bỏ tạp chất khỏi kim loại bằng phương pháp điện phân để tăng độ tinh khiết.
5. Bài Tập Vận Dụng Về Điều Chế Kim Loại
Bài 1: Cần dùng bao nhiêu lít khí CO (ở điều kiện tiêu chuẩn) để khử hoàn toàn 16 gam Fe2O3?
Lời giải:
- Số mol Fe2O3: nFe2O3 = 16 / 160 = 0,1 mol
- Phương trình phản ứng: Fe2O3 + 3CO → 2Fe + 3CO2
- Theo phương trình, nCO = 3 nFe2O3 = 3 0,1 = 0,3 mol
- Thể tích CO cần dùng: VCO = 0,3 * 22,4 = 6,72 lít
Bài 2: Cho 1,12 gam bột sắt tác dụng với 200 ml dung dịch hỗn hợp chứa Cu(NO3)2 0,5M và AgNO3 0,3M. Sau khi phản ứng xảy ra hoàn toàn, thu được m gam chất rắn A. Tính giá trị của m.
Lời giải:
-
Số mol Fe: nFe = 1,12 / 56 = 0,02 mol
-
Số mol AgNO3: nAgNO3 = 0,2 * 0,3 = 0,06 mol
-
Số mol Cu(NO3)2: nCu(NO3)2 = 0,2 * 0,5 = 0,1 mol
-
Phản ứng xảy ra theo thứ tự:
Fe + 2Ag+ → Fe2+ + 2Ag
Fe + Cu2+ → Fe2+ + Cu
-
Fe phản ứng hết với Ag+ trước, sau đó mới phản ứng với Cu2+.
-
Số mol Ag tạo thành: nAg = nAgNO3 = 0,06 mol
-
Khối lượng Ag: mAg = 0,06 * 108 = 6,48 gam
Bài 3: Điện phân dung dịch CuSO4 với điện cực trơ, cường độ dòng điện 10A. Khi ở anot có 4 gam khí thoát ra thì dừng lại. Tính khối lượng đồng thu được ở catot.
Lời giải:
- Số mol khí O2 thoát ra ở anot: nO2 = 4 / 32 = 0,125 mol
- Phản ứng ở anot: 2H2O → O2 + 4H+ + 4e-
- Số mol electron trao đổi: ne = 4 nO2 = 4 0,125 = 0,5 mol
- Phản ứng ở catot: Cu2+ + 2e- → Cu
- Số mol Cu tạo thành: nCu = ne / 2 = 0,5 / 2 = 0,25 mol
- Khối lượng Cu thu được: mCu = 0,25 * 64 = 16 gam
6. Tổng Kết
Nguyên tắc điều chế kim loại là khử ion kim loại thành kim loại tự do, và có nhiều phương pháp khác nhau để thực hiện quá trình này. Mỗi phương pháp có ưu và nhược điểm riêng, và được lựa chọn dựa trên tính chất của kim loại, hợp chất chứa kim loại, và các yếu tố kinh tế – kỹ thuật.
Hy vọng qua bài viết này, bạn đã nắm vững những kiến thức cơ bản và quan trọng về điều chế kim loại. Hãy tiếp tục khám phá và tìm hiểu sâu hơn về lĩnh vực thú vị này tại tic.edu.vn!
7. Tại Sao Nên Chọn Tic.edu.vn Để Tìm Hiểu Về Điều Chế Kim Loại?
Bạn đang tìm kiếm một nguồn tài liệu học tập đáng tin cậy và đầy đủ về điều chế kim loại? tic.edu.vn chính là điểm đến lý tưởng dành cho bạn!
- Nguồn tài liệu phong phú: tic.edu.vn cung cấp một kho tàng tài liệu đa dạng về điều chế kim loại, từ lý thuyết cơ bản đến các bài tập vận dụng nâng cao, phù hợp với mọi trình độ học tập.
- Thông tin cập nhật: Chúng tôi liên tục cập nhật những thông tin mới nhất về các phương pháp điều chế kim loại tiên tiến, các ứng dụng thực tế, và các nghiên cứu khoa học liên quan.
- Giao diện thân thiện: tic.edu.vn được thiết kế với giao diện trực quan, dễ sử dụng, giúp bạn dễ dàng tìm kiếm và tiếp thu kiến thức một cách hiệu quả.
- Cộng đồng học tập: Tham gia cộng đồng học tập trên tic.edu.vn để trao đổi kiến thức, kinh nghiệm, và giải đáp thắc mắc với các bạn học và các chuyên gia.
- Hỗ trợ tận tình: Đội ngũ hỗ trợ của tic.edu.vn luôn sẵn sàng giải đáp mọi thắc mắc và hỗ trợ bạn trong quá trình học tập.
8. Lời Kêu Gọi Hành Động (CTA)
Đừng bỏ lỡ cơ hội khám phá thế giới điều chế kim loại đầy thú vị và bổ ích! Hãy truy cập ngay tic.edu.vn để:
- Tìm kiếm tài liệu học tập đa dạng và đầy đủ.
- Cập nhật thông tin giáo dục mới nhất và chính xác.
- Sử dụng các công cụ hỗ trợ học tập trực tuyến hiệu quả.
- Tham gia cộng đồng học tập trực tuyến sôi nổi.
- Phát triển kỹ năng mềm và kỹ năng chuyên môn.
Liên hệ với chúng tôi:
- Email: [email protected]
- Trang web: tic.edu.vn
9. FAQ – Câu Hỏi Thường Gặp Về Điều Chế Kim Loại
1. Nguyên tắc điều chế kim loại là gì?
Trả lời: Nguyên tắc cơ bản là khử ion kim loại (Mn+) thành nguyên tử kim loại (M).
2. Có những phương pháp điều chế kim loại nào phổ biến?
Trả lời: Ba phương pháp chính là thủy luyện, nhiệt luyện và điện phân.
3. Phương pháp thủy luyện thích hợp cho những kim loại nào?
Trả lời: Thích hợp cho các kim loại kém hoạt động như Au, Ag, Cu, Hg.
4. Phương pháp nhiệt luyện thường được áp dụng cho kim loại nào?
Trả lời: Áp dụng cho các kim loại có độ hoạt động trung bình như Pb, Fe, Zn, Cr, Sn.
5. Điện phân nóng chảy dùng để điều chế kim loại nào?
Trả lời: Dùng để điều chế các kim loại mạnh như Na, Mg, Ba, Ca, Al.
6. Điện phân dung dịch thích hợp cho kim loại nào?
Trả lời: Thích hợp cho các kim loại yếu.
7. Yếu tố nào ảnh hưởng đến hiệu quả của quá trình điều chế kim loại?
Trả lời: Tính chất của kim loại, hợp chất chứa kim loại, chất khử, điều kiện phản ứng và công nghệ.
8. Tại sao cần phải chuyển đổi muối sunfua kim loại thành oxit trước khi điều chế bằng phương pháp nhiệt luyện?
Trả lời: Vì oxit kim loại dễ bị khử hơn so với muối sunfua.
9. Định luật Faraday có ý nghĩa gì trong điện phân?
Trả lời: Mô tả mối quan hệ giữa lượng chất giải phóng ở điện cực và điện lượng đi qua dung dịch.
10. Làm thế nào để tìm kiếm tài liệu học tập về điều chế kim loại trên tic.edu.vn?
Trả lời: Truy cập trang web tic.edu.vn và sử dụng chức năng tìm kiếm với từ khóa “điều chế kim loại”.