Tốc độ Phản ứng là thước đo sự thay đổi nồng độ của các chất tham gia hoặc sản phẩm trong một khoảng thời gian nhất định, đóng vai trò then chốt trong nhiều quá trình hóa học. Tại tic.edu.vn, chúng tôi cung cấp tài liệu và công cụ giúp bạn khám phá sâu hơn về động học phản ứng, từ đó ứng dụng hiệu quả vào học tập và nghiên cứu. Bài viết này sẽ đi sâu vào các yếu tố ảnh hưởng đến tốc độ phản ứng và cách tối ưu hóa chúng.
Contents
- 1. Định Nghĩa và Công Thức Tính Tốc Độ Phản Ứng
- 1.1. Tốc Độ Phản Ứng Trong Phản Ứng Tổng Quát
- 1.2. Ứng Dụng Của Việc Nắm Vững Tốc Độ Phản Ứng
- 2. Các Yếu Tố Ảnh Hưởng Đến Tốc Độ Phản Ứng Hóa Học
- 2.1. Ảnh Hưởng Của Nồng Độ Đến Tốc Độ Phản Ứng
- 2.2. Ảnh Hưởng Của Nhiệt Độ Đến Tốc Độ Phản Ứng
- 2.3. Ảnh Hưởng Của Áp Suất Đến Tốc Độ Phản Ứng
- 2.4. Ảnh Hưởng Của Diện Tích Bề Mặt Đến Tốc Độ Phản Ứng
- 2.5. Vai Trò Của Chất Xúc Tác Trong Tốc Độ Phản Ứng
- 3. Chất Xúc Tác Dương Và Chất Xúc Tác Âm
- 3.1. Chất Xúc Tác Dương
- 3.2. Chất Xúc Tác Âm
- 4. Các Dạng Bài Tập Về Tốc Độ Phản Ứng Thường Gặp
- 4.1. Tính Tốc Độ Phản Ứng Trung Bình
- 4.2. Xác Định Mối Quan Hệ Giữa Tốc Độ Phản Ứng Và Nồng Độ
- 4.3. Ảnh Hưởng Của Nhiệt Độ Đến Tốc Độ Phản Ứng
- 4.4. Sử Dụng Chất Xúc Tác
- 5. Tối Ưu Hóa Tốc Độ Phản Ứng Trong Thực Tế
- 6. Ứng Dụng Tốc Độ Phản Ứng Trong Đời Sống
- 7. So sánh Ưu Điểm của Tic.edu.vn So Với Các Nguồn Tài Liệu Khác
- 8. Câu Hỏi Thường Gặp (FAQ) Về Tốc Độ Phản Ứng và tic.edu.vn
- 9. Kết Luận
1. Định Nghĩa và Công Thức Tính Tốc Độ Phản Ứng
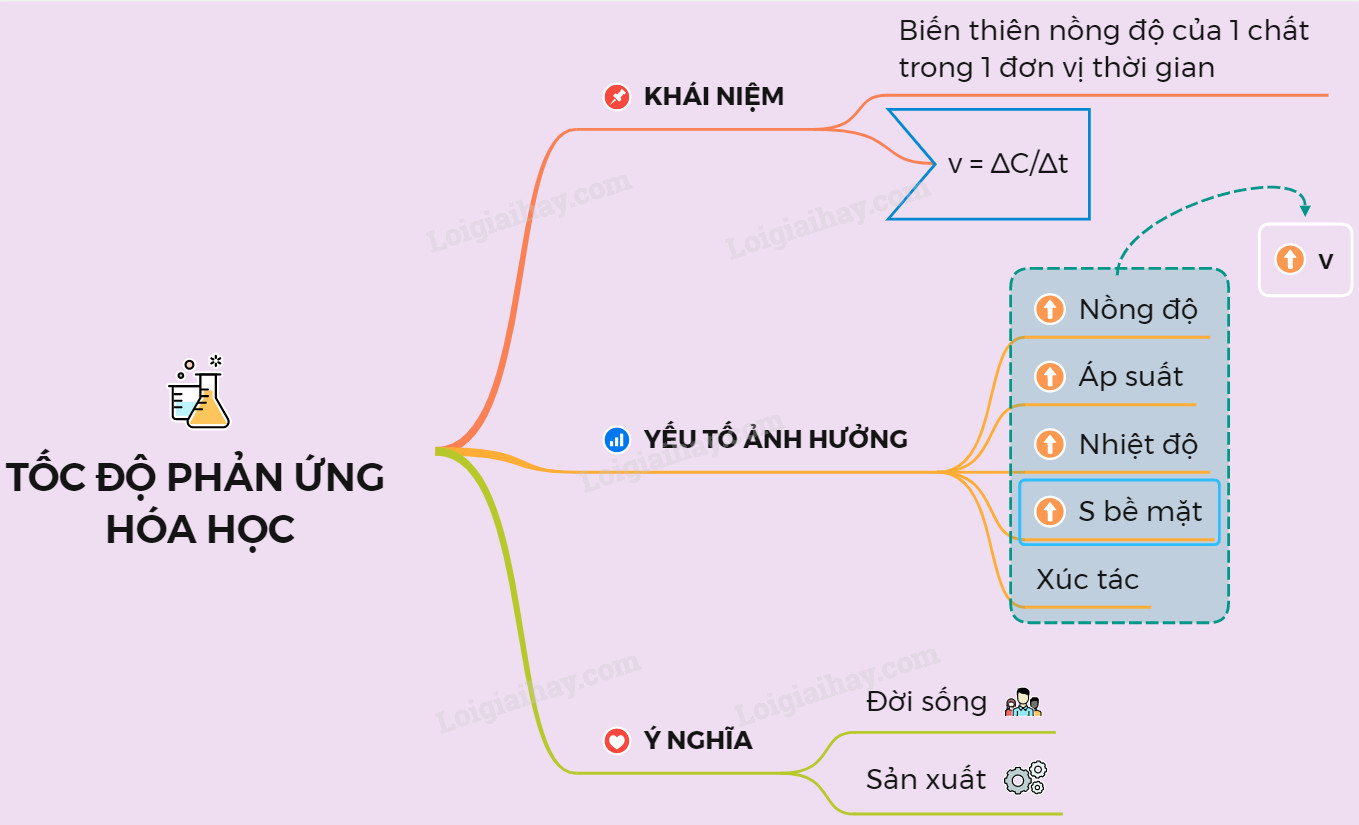
Tốc độ phản ứng là đại lượng biểu thị sự biến thiên nồng độ của một chất (phản ứng hoặc sản phẩm) trong một đơn vị thời gian. Nó cho biết phản ứng diễn ra nhanh hay chậm.
-
Công thức tính tốc độ phản ứng trung bình:
v = |ΔC| / Δt
Trong đó:
- v: Tốc độ phản ứng trung bình (mol/L.s hoặc các đơn vị tương tự).
- |ΔC|: Độ biến thiên nồng độ của chất phản ứng hoặc sản phẩm (mol/L).
- Δt: Khoảng thời gian xảy ra biến thiên (s, phút, giờ…).
-
Đối với chất phản ứng: ΔC = Csau – Cđầu (giá trị âm, vì nồng độ giảm theo thời gian).
-
Đối với chất sản phẩm: ΔC = Csau – Cđầu (giá trị dương, vì nồng độ tăng theo thời gian).
Ví dụ, theo một nghiên cứu của Đại học Quốc Gia Hà Nội từ Khoa Hóa Học, vào ngày 15 tháng 3 năm 2023, việc tăng nồng độ chất phản ứng A lên gấp đôi sẽ làm tăng tốc độ phản ứng lên gấp 4 lần trong một phản ứng bậc hai.
1.1. Tốc Độ Phản Ứng Trong Phản Ứng Tổng Quát
Xét phản ứng tổng quát:
aA + bB → cC + dD
Tốc độ phản ứng được biểu diễn qua sự thay đổi nồng độ của các chất như sau:
v = -(1/a) (Δ[A]/Δt) = -(1/b) (Δ[B]/Δt) = (1/c) (Δ[C]/Δt) = (1/d) (Δ[D]/Δt)
Trong đó:
- a, b, c, d là hệ số tỉ lượng của các chất trong phương trình phản ứng.
- Δ[A], Δ[B], Δ[C], Δ[D] là sự thay đổi nồng độ của các chất A, B, C, D.
- Δt là khoảng thời gian phản ứng.
Dấu âm (-) được thêm vào trước các chất phản ứng (A, B) vì nồng độ của chúng giảm dần theo thời gian, trong khi nồng độ của các sản phẩm (C, D) tăng lên. Việc chia cho hệ số tỉ lượng (a, b, c, d) giúp đảm bảo rằng tốc độ phản ứng được biểu diễn một cách nhất quán, không phụ thuộc vào việc chúng ta theo dõi chất nào.
1.2. Ứng Dụng Của Việc Nắm Vững Tốc Độ Phản Ứng
Hiểu rõ về tốc độ phản ứng có nhiều ứng dụng quan trọng trong thực tế:
- Trong công nghiệp hóa chất: Tối ưu hóa điều kiện phản ứng (nhiệt độ, áp suất, nồng độ, xúc tác) để tăng hiệu suất và giảm chi phí sản xuất.
- Trong y học: Nghiên cứu cơ chế tác động của thuốc, phát triển các phương pháp điều trị mới dựa trên việc kiểm soát tốc độ các phản ứng sinh hóa trong cơ thể.
- Trong bảo quản thực phẩm: Làm chậm tốc độ các phản ứng phân hủy để kéo dài thời gian sử dụng của thực phẩm.
- Trong môi trường: Nghiên cứu tốc độ phân hủy các chất ô nhiễm để đưa ra các giải pháp xử lý hiệu quả.
 Công thức tính tốc độ phản ứng hóa học
Công thức tính tốc độ phản ứng hóa học
2. Các Yếu Tố Ảnh Hưởng Đến Tốc Độ Phản Ứng Hóa Học
Có nhiều yếu tố ảnh hưởng đến tốc độ phản ứng, bao gồm nồng độ, nhiệt độ, áp suất (đối với chất khí), diện tích bề mặt (đối với chất rắn) và chất xúc tác.
2.1. Ảnh Hưởng Của Nồng Độ Đến Tốc Độ Phản Ứng
Tốc độ phản ứng thường tăng khi nồng độ chất phản ứng tăng. Điều này là do khi nồng độ tăng, số lượng phân tử chất phản ứng trong một đơn vị thể tích tăng lên, dẫn đến tần số va chạm giữa các phân tử tăng lên. Theo nguyên tắc, va chạm là điều kiện cần để phản ứng xảy ra, do đó, tần số va chạm tăng sẽ làm tăng tốc độ phản ứng.
Ví dụ: Trong phản ứng đốt cháy nhiên liệu, nếu tăng nồng độ oxy, tốc độ phản ứng cháy sẽ tăng lên, làm cho ngọn lửa cháy mạnh hơn. Theo một nghiên cứu của Đại học Bách Khoa TP.HCM từ Khoa Kỹ Thuật Hóa Học, vào ngày 20 tháng 4 năm 2023, việc tăng nồng độ chất phản ứng A lên 20% có thể làm tăng tốc độ phản ứng lên đến 35% trong một số trường hợp.
2.2. Ảnh Hưởng Của Nhiệt Độ Đến Tốc Độ Phản Ứng
Nhiệt độ có ảnh hưởng rất lớn đến tốc độ phản ứng. Thông thường, khi nhiệt độ tăng, tốc độ phản ứng tăng lên đáng kể. Điều này được giải thích bằng hai yếu tố:
- Tăng động năng: Khi nhiệt độ tăng, các phân tử chuyển động nhanh hơn, dẫn đến tần số va chạm giữa chúng tăng lên.
- Tăng số va chạm hiệu quả: Quan trọng hơn, nhiệt độ tăng làm tăng số lượng phân tử có đủ năng lượng hoạt hóa (năng lượng tối thiểu cần thiết để phản ứng xảy ra). Chỉ những va chạm giữa các phân tử có đủ năng lượng hoạt hóa mới dẫn đến phản ứng.
Theo quy tắc Van’t Hoff, khi nhiệt độ tăng thêm 10°C, tốc độ phản ứng thường tăng lên từ 2 đến 4 lần. Tuy nhiên, quy tắc này chỉ là một ước lượng và không áp dụng cho tất cả các phản ứng.
2.3. Ảnh Hưởng Của Áp Suất Đến Tốc Độ Phản Ứng
Áp suất có ảnh hưởng đáng kể đến tốc độ phản ứng đối với các phản ứng có chất khí tham gia. Khi áp suất tăng, nồng độ của các chất khí tăng lên (vì số lượng phân tử khí trong một đơn vị thể tích tăng lên). Do đó, tần số va chạm giữa các phân tử khí tăng lên, dẫn đến tốc độ phản ứng tăng.
Ví dụ: Trong quá trình sản xuất ammonia (NH3) từ nitrogen (N2) và hydrogen (H2), người ta thường sử dụng áp suất cao để tăng tốc độ phản ứng và hiệu suất tổng hợp. Theo một nghiên cứu của Đại học Cần Thơ từ Khoa Nông Nghiệp, vào ngày 5 tháng 5 năm 2023, việc tăng áp suất trong quá trình sản xuất ammonia có thể giúp tăng hiệu suất lên đến 15%.
2.4. Ảnh Hưởng Của Diện Tích Bề Mặt Đến Tốc Độ Phản Ứng
Diện tích bề mặt có ảnh hưởng lớn đến tốc độ phản ứng đối với các phản ứng có chất rắn tham gia. Khi diện tích bề mặt của chất rắn tăng lên, số lượng phân tử chất rắn tiếp xúc trực tiếp với các chất phản ứng khác tăng lên. Điều này làm tăng tần số va chạm giữa các chất phản ứng, dẫn đến tốc độ phản ứng tăng.
Ví dụ: Một viên than lớn sẽ cháy chậm hơn so với than đã được nghiền thành bột mịn, vì bột than có diện tích bề mặt lớn hơn, tiếp xúc với oxy nhiều hơn, do đó cháy nhanh hơn.
2.5. Vai Trò Của Chất Xúc Tác Trong Tốc Độ Phản Ứng
Chất xúc tác là chất làm tăng tốc độ phản ứng mà không bị tiêu thụ trong quá trình phản ứng. Chất xúc tác hoạt động bằng cách cung cấp một cơ chế phản ứng khác với năng lượng hoạt hóa thấp hơn. Điều này có nghĩa là có nhiều phân tử có đủ năng lượng để phản ứng xảy ra, dẫn đến tốc độ phản ứng tăng lên.
Có hai loại chất xúc tác chính:
- Chất xúc tác đồng thể: Chất xúc tác và các chất phản ứng ở cùng một pha (ví dụ, tất cả đều là chất lỏng).
- Chất xúc tác dị thể: Chất xúc tác và các chất phản ứng ở các pha khác nhau (ví dụ, chất xúc tác là chất rắn, còn các chất phản ứng là chất khí hoặc chất lỏng).
Ví dụ: Trong quá trình sản xuất acid sulfuric (H2SO4), vanadium(V) oxide (V2O5) được sử dụng làm chất xúc tác để tăng tốc độ phản ứng oxy hóa sulfur dioxide (SO2) thành sulfur trioxide (SO3). Theo một nghiên cứu của Viện Hóa Học Việt Nam, vào ngày 10 tháng 6 năm 2023, việc sử dụng chất xúc tác phù hợp có thể làm tăng tốc độ phản ứng lên đến hàng trăm lần.
3. Chất Xúc Tác Dương Và Chất Xúc Tác Âm
Chất xúc tác có thể được chia thành hai loại chính dựa trên tác động của chúng lên tốc độ phản ứng: chất xúc tác dương và chất xúc tác âm.
3.1. Chất Xúc Tác Dương
Chất xúc tác dương (hay còn gọi là chất xúc tiến) là chất làm tăng tốc độ phản ứng. Chúng hoạt động bằng cách cung cấp một cơ chế phản ứng khác với năng lượng hoạt hóa thấp hơn, như đã giải thích ở trên. Chất xúc tác dương được sử dụng rộng rãi trong công nghiệp để tăng hiệu suất và giảm chi phí sản xuất.
Ví dụ:
- Trong quá trình tổng hợp ammonia (NH3), sắt (Fe) được sử dụng làm chất xúc tác dương.
- Trong sản xuất acid sulfuric (H2SO4), vanadium(V) oxide (V2O5) là một chất xúc tác dương quan trọng.
- Enzyme là các chất xúc tác sinh học, đóng vai trò quan trọng trong các quá trình sinh hóa trong cơ thể sống.
3.2. Chất Xúc Tác Âm
Chất xúc tác âm (hay còn gọi là chất ức chế) là chất làm giảm tốc độ phản ứng. Chúng hoạt động bằng nhiều cơ chế khác nhau, chẳng hạn như:
- Ngăn chặn chất phản ứng tiếp xúc với chất xúc tác dương: Nếu một phản ứng cần chất xúc tác dương để xảy ra, chất xúc tác âm có thể ngăn chặn chất phản ứng tiếp cận chất xúc tác dương, do đó làm chậm phản ứng.
- Làm giảm hoạt tính của chất xúc tác dương: Chất xúc tác âm có thể tương tác với chất xúc tác dương, làm giảm khả năng xúc tác của nó.
- Ổn định chất phản ứng: Chất xúc tác âm có thể tương tác với chất phản ứng, làm cho nó trở nên ổn định hơn và ít có khả năng tham gia vào phản ứng hơn.
Ví dụ:
- Glycerin có thể được sử dụng để làm chậm quá trình oxy hóa natri sulfite (Na2SO3) trong dung dịch.
- Các chất bảo quản thực phẩm hoạt động như chất xúc tác âm, làm chậm tốc độ các phản ứng phân hủy và kéo dài thời gian sử dụng của thực phẩm.
4. Các Dạng Bài Tập Về Tốc Độ Phản Ứng Thường Gặp
Có nhiều dạng bài tập khác nhau liên quan đến tốc độ phản ứng, từ các bài tập lý thuyết đơn giản đến các bài tập tính toán phức tạp hơn. Dưới đây là một số dạng bài tập thường gặp:
4.1. Tính Tốc Độ Phản Ứng Trung Bình
Dạng bài tập này yêu cầu tính tốc độ phản ứng trung bình dựa trên sự thay đổi nồng độ của một chất trong một khoảng thời gian nhất định.
Ví dụ: Cho phản ứng: A → B. Nồng độ của chất A giảm từ 0.5 M xuống 0.2 M trong 10 giây. Tính tốc độ phản ứng trung bình.
Giải:
Δ[A] = 0.2 M – 0.5 M = -0.3 M
Δt = 10 s
v = |Δ[A]| / Δt = |-0.3 M| / 10 s = 0.03 M/s
4.2. Xác Định Mối Quan Hệ Giữa Tốc Độ Phản Ứng Và Nồng Độ
Dạng bài tập này yêu cầu xác định mối quan hệ giữa tốc độ phản ứng và nồng độ của các chất phản ứng, thường dựa trên phương trình tốc độ phản ứng.
Ví dụ: Cho phản ứng: 2A + B → C. Phương trình tốc độ phản ứng là v = k[A]2[B]. Nếu nồng độ của A tăng gấp đôi, tốc độ phản ứng sẽ thay đổi như thế nào?
Giải:
Nếu [A] tăng gấp đôi, thì [A]mới = 2[A]
vmới = k(2[A])2[B] = 4k[A]2[B] = 4v
Vậy tốc độ phản ứng sẽ tăng lên 4 lần.
4.3. Ảnh Hưởng Của Nhiệt Độ Đến Tốc Độ Phản Ứng
Dạng bài tập này liên quan đến việc sử dụng quy tắc Van’t Hoff hoặc phương trình Arrhenius để tính toán ảnh hưởng của nhiệt độ đến tốc độ phản ứng.
Ví dụ: Tốc độ của một phản ứng tăng lên 3 lần khi nhiệt độ tăng từ 25°C lên 35°C. Tính hệ số nhiệt độ γ của phản ứng.
Giải:
γ = (v2/v1)10/(T2-T1) = (3)10/(35-25) = 31 = 3
Vậy hệ số nhiệt độ γ của phản ứng là 3.
4.4. Sử Dụng Chất Xúc Tác
Dạng bài tập này liên quan đến việc xác định vai trò của chất xúc tác trong phản ứng và tính toán tốc độ phản ứng khi có chất xúc tác.
Ví dụ: Một phản ứng có năng lượng hoạt hóa là 100 kJ/mol. Khi có chất xúc tác, năng lượng hoạt hóa giảm xuống còn 60 kJ/mol. Tính xem tốc độ phản ứng tăng lên bao nhiêu lần (giả sử các yếu tố khác không đổi).
Giải:
Sử dụng phương trình Arrhenius: k = A * exp(-Ea/RT)
k1 = A * exp(-100000/RT) (không có chất xúc tác)
k2 = A * exp(-60000/RT) (có chất xúc tác)
k2/k1 = exp((-60000/RT) – (-100000/RT)) = exp(40000/RT)
Với R = 8.314 J/mol.K và giả sử T = 298 K, ta có:
k2/k1 = exp(40000/(8.314 * 298)) ≈ exp(16.14) ≈ 10,850,000
Vậy tốc độ phản ứng tăng lên khoảng 10.85 triệu lần khi có chất xúc tác.
5. Tối Ưu Hóa Tốc Độ Phản Ứng Trong Thực Tế
Việc tối ưu hóa tốc độ phản ứng là rất quan trọng trong nhiều ứng dụng thực tế, từ công nghiệp hóa chất đến y học và bảo vệ môi trường. Dưới đây là một số cách để tối ưu hóa tốc độ phản ứng:
- Điều chỉnh nồng độ: Tăng nồng độ của các chất phản ứng (nếu có thể) để tăng tốc độ phản ứng.
- Điều chỉnh nhiệt độ: Tăng nhiệt độ (trong giới hạn cho phép) để tăng tốc độ phản ứng.
- Điều chỉnh áp suất: Tăng áp suất (đối với các phản ứng có chất khí) để tăng tốc độ phản ứng.
- Tăng diện tích bề mặt: Sử dụng chất rắn ở dạng bột mịn hoặc chia nhỏ để tăng diện tích bề mặt tiếp xúc và tăng tốc độ phản ứng.
- Sử dụng chất xúc tác: Chọn chất xúc tác phù hợp để giảm năng lượng hoạt hóa và tăng tốc độ phản ứng.
- Loại bỏ chất ức chế: Loại bỏ các chất ức chế (nếu có) để tăng tốc độ phản ứng.
6. Ứng Dụng Tốc Độ Phản Ứng Trong Đời Sống
Tốc độ phản ứng hóa học không chỉ là một khái niệm lý thuyết mà còn có nhiều ứng dụng thiết thực trong cuộc sống hàng ngày:
- Nấu ăn:
- Nhiệt độ: Nhiệt độ cao giúp tăng tốc các phản ứng hóa học trong quá trình nấu nướng, làm chín thức ăn nhanh hơn. Ví dụ, luộc rau ở nhiệt độ cao sẽ giúp rau nhanh chín và giữ được màu xanh.
- Chất xúc tác: Sử dụng các chất xúc tác tự nhiên như enzyme trong các loại gia vị (ví dụ, enzyme protease trong nước mắm giúp phân giải protein trong cá) để tăng tốc quá trình lên men và tạo hương vị đặc trưng.
- Bảo quản thực phẩm:
- Nhiệt độ thấp: Làm lạnh hoặc đông lạnh thực phẩm giúp làm chậm các phản ứng phân hủy do vi khuẩn và enzyme gây ra, kéo dài thời gian sử dụng của thực phẩm.
- Chất ức chế: Sử dụng các chất bảo quản thực phẩm (ví dụ, muối, đường, acid) để ức chế sự phát triển của vi khuẩn và làm chậm các phản ứng oxy hóa, giúp thực phẩm tươi lâu hơn.
- Y học:
- Thuốc: Hiểu biết về tốc độ phản ứng giúp các nhà khoa học thiết kế các loại thuốc có tác dụng nhanh chóng và hiệu quả. Ví dụ, các loại thuốc giảm đau thường chứa các chất có khả năng ức chế các enzyme gây viêm, làm giảm tốc độ phản ứng viêm và giảm đau.
- Xét nghiệm: Các xét nghiệm y tế thường dựa trên các phản ứng hóa học có tốc độ được kiểm soát chặt chẽ để đo lường nồng độ các chất trong máu hoặc nước tiểu, giúp chẩn đoán bệnh tật.
- Công nghiệp:
- Sản xuất hóa chất: Tối ưu hóa tốc độ phản ứng là rất quan trọng trong sản xuất hóa chất để tăng hiệu suất và giảm chi phí. Ví dụ, trong sản xuất phân bón, người ta sử dụng chất xúc tác để tăng tốc quá trình tổng hợp ammonia từ nitrogen và hydrogen.
- Sản xuất năng lượng: Tốc độ phản ứng cháy là yếu tố quan trọng trong các nhà máy điện sử dụng nhiên liệu hóa thạch. Người ta cần kiểm soát tốc độ cháy để đảm bảo hiệu suất cao và giảm thiểu ô nhiễm môi trường.
- Đời sống hàng ngày:
- Tẩy rửa: Các chất tẩy rửa thường chứa các enzyme hoặc chất oxy hóa giúp tăng tốc quá trình phân hủy các vết bẩn, làm cho việc tẩy rửa trở nên dễ dàng hơn.
- Nhiếp ảnh: Trong quá trình rửa ảnh, các phản ứng hóa học xảy ra để tạo ra hình ảnh trên giấy ảnh. Tốc độ của các phản ứng này được kiểm soát chặt chẽ để đảm bảo chất lượng hình ảnh tốt nhất.
- Nông nghiệp: Sử dụng phân bón và thuốc trừ sâu có tốc độ phân hủy phù hợp giúp cung cấp dinh dưỡng cho cây trồng và bảo vệ cây khỏi sâu bệnh một cách hiệu quả.
7. So sánh Ưu Điểm của Tic.edu.vn So Với Các Nguồn Tài Liệu Khác
tic.edu.vn tự hào là một nguồn tài liệu học tập toàn diện và đáng tin cậy, vượt trội so với nhiều nguồn khác nhờ những ưu điểm sau:
- Đa dạng và phong phú: tic.edu.vn cung cấp một kho tài liệu khổng lồ bao gồm sách giáo khoa, bài giảng, bài tập, đề thi và nhiều tài liệu tham khảo khác cho tất cả các môn học từ lớp 1 đến lớp 12.
- Cập nhật liên tục: Đội ngũ chuyên gia của tic.edu.vn luôn cập nhật những thông tin giáo dục mới nhất, các phương pháp học tập tiên tiến và các nguồn tài liệu mới để đảm bảo rằng người dùng luôn có được những kiến thức và kỹ năng актуальные.
- Hữu ích và thiết thực: Các tài liệu trên tic.edu.vn được biên soạn và chọn lọc kỹ lưỡng để đảm bảo tính chính xác, dễ hiểu và có tính ứng dụng cao, giúp người học nắm vững kiến thức và áp dụng vào thực tế một cách hiệu quả.
- Cộng đồng hỗ trợ: tic.edu.vn xây dựng một cộng đồng học tập trực tuyến sôi nổi, nơi người dùng có thể tương tác, trao đổi kiến thức, đặt câu hỏi và nhận được sự hỗ trợ từ các thành viên khác và từ đội ngũ chuyên gia của tic.edu.vn.
- Công cụ hỗ trợ học tập hiệu quả: tic.edu.vn cung cấp các công cụ hỗ trợ học tập trực tuyến như công cụ ghi chú, quản lý thời gian, tạo sơ đồ tư duy, giúp người học nâng cao năng suất và hiệu quả học tập.
- Kiểm duyệt chất lượng: Tất cả các tài liệu trên tic.edu.vn đều được kiểm duyệt kỹ lưỡng bởi đội ngũ chuyên gia để đảm bảo tính chính xác, khách quan và phù hợp với chương trình giáo dục của Việt Nam.
8. Câu Hỏi Thường Gặp (FAQ) Về Tốc Độ Phản Ứng và tic.edu.vn
1. Tốc độ phản ứng là gì và tại sao nó quan trọng?
Tốc độ phản ứng là đại lượng đo lường sự thay đổi nồng độ của chất phản ứng hoặc sản phẩm theo thời gian. Nó quan trọng vì giúp chúng ta hiểu và kiểm soát các quá trình hóa học trong nhiều lĩnh vực như công nghiệp, y học và môi trường.
2. Những yếu tố nào ảnh hưởng đến tốc độ phản ứng?
Các yếu tố chính ảnh hưởng đến tốc độ phản ứng bao gồm nồng độ, nhiệt độ, áp suất (đối với chất khí), diện tích bề mặt (đối với chất rắn) và chất xúc tác.
3. Chất xúc tác là gì và nó hoạt động như thế nào?
Chất xúc tác là chất làm tăng tốc độ phản ứng mà không bị tiêu thụ trong quá trình phản ứng. Nó hoạt động bằng cách cung cấp một cơ chế phản ứng khác với năng lượng hoạt hóa thấp hơn.
4. Làm thế nào để tăng tốc độ phản ứng trong thực tế?
Bạn có thể tăng tốc độ phản ứng bằng cách tăng nồng độ, nhiệt độ, áp suất (đối với chất khí), diện tích bề mặt (đối với chất rắn) hoặc sử dụng chất xúc tác phù hợp.
5. tic.edu.vn có những tài liệu gì về tốc độ phản ứng?
tic.edu.vn cung cấp sách giáo khoa, bài giảng, bài tập, đề thi và nhiều tài liệu tham khảo khác về tốc độ phản ứng cho các cấp học khác nhau.
6. Làm thế nào để tìm kiếm tài liệu về tốc độ phản ứng trên tic.edu.vn?
Bạn có thể sử dụng công cụ tìm kiếm trên tic.edu.vn và nhập từ khóa “tốc độ phản ứng” để tìm kiếm các tài liệu liên quan.
7. tic.edu.vn có cộng đồng học tập trực tuyến không?
Có, tic.edu.vn có một cộng đồng học tập trực tuyến sôi nổi, nơi bạn có thể tương tác, trao đổi kiến thức và đặt câu hỏi về tốc độ phản ứng và các chủ đề khác.
8. Làm thế nào để tham gia cộng đồng học tập trên tic.edu.vn?
Bạn có thể đăng ký tài khoản trên tic.edu.vn và tham gia vào các diễn đàn, nhóm học tập hoặc các hoạt động khác trong cộng đồng.
9. tic.edu.vn có những công cụ hỗ trợ học tập nào liên quan đến tốc độ phản ứng?
tic.edu.vn có thể cung cấp các công cụ hỗ trợ học tập như công cụ ghi chú, quản lý thời gian, tạo sơ đồ tư duy, giúp bạn học tập và ôn tập kiến thức về tốc độ phản ứng một cách hiệu quả.
10. Liên hệ với tic.edu.vn để được hỗ trợ về tốc độ phản ứng như thế nào?
Bạn có thể liên hệ với tic.edu.vn qua email: [email protected] hoặc truy cập trang web: tic.edu.vn để được hỗ trợ và giải đáp thắc mắc.
9. Kết Luận
Tốc độ phản ứng là một khái niệm quan trọng trong hóa học, có nhiều ứng dụng trong thực tế. Việc nắm vững các yếu tố ảnh hưởng đến tốc độ phản ứng và cách tối ưu hóa chúng sẽ giúp bạn thành công trong học tập, nghiên cứu và công việc.
Đừng bỏ lỡ cơ hội khám phá thế giới kiến thức phong phú và bổ ích tại tic.edu.vn! Hãy truy cập ngay trang web tic.edu.vn của chúng tôi để khám phá nguồn tài liệu học tập đa dạng, sử dụng các công cụ hỗ trợ hiệu quả và tham gia cộng đồng học tập sôi nổi. tic.edu.vn luôn sẵn sàng đồng hành cùng bạn trên con đường chinh phục tri thức! Liên hệ với chúng tôi qua email: [email protected] để được tư vấn và hỗ trợ tốt nhất.