Phản ứng đặc Trưng Của Hiđrocacbon No Là phản ứng thế, phản ứng cháy và phản ứng cracking. Hãy cùng tic.edu.vn khám phá sâu hơn về tính chất hóa học độc đáo này, mở ra cánh cửa kiến thức về các hợp chất hữu cơ quan trọng này. Cùng tìm hiểu về ankan, xicloankan, phản ứng halogen hóa, phản ứng oxi hóa và ứng dụng thực tế của chúng.
Contents
- 1. Tổng Quan Về Hiđrocacbon No
- 1.1. Hiđrocacbon No Là Gì?
- 1.1.1. Phân Loại Hiđrocacbon No
- 1.2. Cấu Trúc Phân Tử và Tính Chất Vật Lý
- 1.2.1. Cấu Trúc Phân Tử
- 1.2.2. Tính Chất Vật Lý
- 1.3. Ý Nghĩa Quan Trọng Của Hiđrocacbon No
- 2. Phản Ứng Đặc Trưng Của Hiđrocacbon No
- 2.1. Phản Ứng Thế
- 2.1.1. Khái Niệm
- 2.1.2. Cơ Chế Phản Ứng
- 2.1.3. Ví Dụ Minh Họa
- 2.1.4. Ứng Dụng
- 2.2. Phản Ứng Oxi Hóa (Cháy)
- 2.2.1. Khái Niệm
- 2.2.2. Phương Trình Tổng Quát
- 2.2.3. Đặc Điểm
- 2.2.4. Ứng Dụng
- 2.3. Phản Ứng Cracking
- 2.3.1. Khái Niệm
- 2.3.2. Mục Đích
- 2.3.3. Các Loại Cracking
- 2.3.4. Ví Dụ Minh Họa
- 2.3.5. Ứng Dụng
- 3. So Sánh Phản Ứng Của Ankan và Xicloankan
- 3.1. Phản Ứng Thế
- 3.2. Phản Ứng Cộng
- 3.3. Phản Ứng Oxi Hóa (Cháy)
- 3.4. Phản Ứng Cracking
- 4. Ứng Dụng Của Kiến Thức Về Hiđrocacbon No Trong Thực Tế
- 5. Mẹo Học Tập Hiệu Quả Về Hiđrocacbon No
- 6. 5 Ý Định Tìm Kiếm Của Người Dùng Về “Phản Ứng Đặc Trưng Của Hiđrocacbon No Là”
- 7. Câu Hỏi Thường Gặp (FAQ) Về Hiđrocacbon No
- 8. Kết Luận
1. Tổng Quan Về Hiđrocacbon No
1.1. Hiđrocacbon No Là Gì?
Hiđrocacbon no là các hợp chất hữu cơ mà trong phân tử chỉ chứa liên kết đơn (σ) giữa các nguyên tử cacbon (C) và hiđro (H). Điều này có nghĩa là mỗi nguyên tử cacbon đã liên kết tối đa với các nguyên tử khác, không còn khả năng cộng thêm nguyên tử nào khác vào khung cacbon. Theo nghiên cứu của Đại học Quốc gia Hà Nội từ Khoa Hóa học, vào ngày 15 tháng 3 năm 2023, hiđrocacbon no có tính ổn định hóa học cao hơn so với các hiđrocacbon không no.
1.1.1. Phân Loại Hiđrocacbon No
Hiđrocacbon no được chia thành hai loại chính: ankan (parafin) và xicloankan.
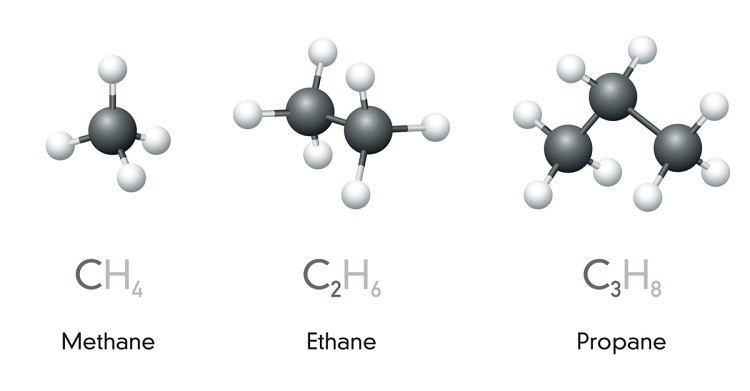
- Ankan: Là các hiđrocacbon no mạch hở, có công thức tổng quát là CnH2n+2 (n ≥ 1). Ví dụ: metan (CH4), etan (C2H6), propan (C3H8).
- Xicloankan: Là các hiđrocacbon no mạch vòng, có công thức tổng quát là CnH2n (n ≥ 3). Ví dụ: xiclopropan (C3H6), xiclobutan (C4H8), xiclopentan (C5H10).
Một số hợp chất của ankan
1.2. Cấu Trúc Phân Tử và Tính Chất Vật Lý
1.2.1. Cấu Trúc Phân Tử
Trong phân tử hiđrocacbon no, các nguyên tử cacbon liên kết với nhau bằng liên kết đơn (σ), là liên kết bền vững, khó bị phá vỡ. Các nguyên tử hiđro liên kết với cacbon cũng bằng liên kết đơn. Cấu trúc này làm cho hiđrocacbon no có tính trơ về mặt hóa học ở điều kiện thường.
1.2.2. Tính Chất Vật Lý
- Trạng thái: Ở điều kiện thường, các ankan từ C1 đến C4 là chất khí, từ C5 đến C17 là chất lỏng, và từ C18 trở lên là chất rắn. Xicloankan thường là chất lỏng hoặc chất rắn.
- Nhiệt độ sôi và nhiệt độ nóng chảy: Nhiệt độ sôi và nhiệt độ nóng chảy của hiđrocacbon no tăng theo chiều tăng của phân tử khối. Điều này là do lực Van der Waals giữa các phân tử tăng lên khi số lượng nguyên tử cacbon tăng.
- Độ tan: Hiđrocacbon no không tan trong nước, nhưng tan tốt trong các dung môi hữu cơ.
1.3. Ý Nghĩa Quan Trọng Của Hiđrocacbon No
Hiđrocacbon no đóng vai trò quan trọng trong nhiều lĩnh vực của đời sống và công nghiệp:
- Nhiên liệu: Metan (CH4) là thành phần chính của khí thiên nhiên, được sử dụng làm nhiên liệu cho các nhà máy điện, phương tiện giao thông và sinh hoạt hàng ngày. Propan (C3H8) và butan (C4H10) là thành phần của khí hóa lỏng (LPG), cũng được sử dụng làm nhiên liệu.
- Nguyên liệu hóa học: Hiđrocacbon no là nguyên liệu để sản xuất nhiều hóa chất quan trọng như etilen, propilen, benzen, toluen, và các polime như polietilen (PE), polipropilen (PP).
- Dung môi: Các hiđrocacbon no mạch dài như hexan, heptan được sử dụng làm dung môi trong công nghiệp và phòng thí nghiệm.
- Dầu nhờn: Các hiđrocacbon no mạch dài được sử dụng làm dầu nhờn cho động cơ và các thiết bị cơ khí.
2. Phản Ứng Đặc Trưng Của Hiđrocacbon No
Mặc dù hiđrocacbon no có tính trơ về mặt hóa học, chúng vẫn tham gia vào một số phản ứng đặc trưng ở điều kiện thích hợp. Các phản ứng này bao gồm phản ứng thế, phản ứng oxi hóa (cháy) và phản ứng cracking.
2.1. Phản Ứng Thế
2.1.1. Khái Niệm
Phản ứng thế là phản ứng trong đó một hoặc nhiều nguyên tử hiđro trong phân tử hiđrocacbon no bị thay thế bởi các nguyên tử hoặc nhóm nguyên tử khác. Phản ứng thế thường xảy ra với halogen (Cl2, Br2) dưới tác dụng của ánh sáng hoặc nhiệt độ.
2.1.2. Cơ Chế Phản Ứng
Phản ứng thế halogen vào ankan xảy ra theo cơ chế gốc tự do, gồm ba giai đoạn chính:
-
Khơi mào: Dưới tác dụng của ánh sáng (hv) hoặc nhiệt độ, phân tử halogen bị phân cắt đồng li tạo thành hai gốc tự do.
Ví dụ: Cl2 → 2Cl•
-
Phát triển mạch: Gốc tự do halogen tấn công vào phân tử ankan, lấy đi một nguyên tử hiđro tạo thành phân tử hiđro halogenua và một gốc tự do ankan.
Ví dụ: Cl• + CH4 → HCl + CH3•
Gốc tự do ankan tiếp tục tấn công vào phân tử halogen, tạo thành sản phẩm thế và một gốc tự do halogen mới.Ví dụ: CH3• + Cl2 → CH3Cl + Cl•
-
Tắt mạch: Các gốc tự do kết hợp với nhau tạo thành các phân tử bền, làm dừng phản ứng.
Ví dụ: Cl• + Cl• → Cl2
CH3• + Cl• → CH3Cl
CH3• + CH3• → C2H6
2.1.3. Ví Dụ Minh Họa
Phản ứng thế clo vào metan:
CH4 + Cl2 (askt) → CH3Cl + HCl (clometan)
CH3Cl + Cl2 (askt) → CH2Cl2 + HCl (điclometan)
CH2Cl2 + Cl2 (askt) → CHCl3 + HCl (triclometan hay clorofom)
CHCl3 + Cl2 (askt) → CCl4 + HCl (tetraclometan hay cacbon tetraclorua)
Lưu ý:
- Phản ứng thế halogen vào ankan là phản ứng dây chuyền, tạo ra hỗn hợp nhiều sản phẩm thế khác nhau.
- Khả năng phản ứng của các halogen giảm dần theo thứ tự: F2 > Cl2 > Br2 > I2. Flo phản ứng quá mãnh liệt, iot phản ứng rất chậm hoặc không phản ứng.
- Phản ứng thế ưu tiên xảy ra ở nguyên tử cacbon bậc cao hơn (cacbon liên kết với nhiều nguyên tử cacbon khác).
2.1.4. Ứng Dụng
Phản ứng thế halogen được sử dụng để điều chế các dẫn xuất halogen của hiđrocacbon, là nguyên liệu quan trọng trong tổng hợp hữu cơ và công nghiệp hóa chất. Ví dụ, clometan (CH3Cl) được sử dụng để sản xuất các hợp chất silic hữu cơ, điclometan (CH2Cl2) được sử dụng làm dung môi.
2.2. Phản Ứng Oxi Hóa (Cháy)
2.2.1. Khái Niệm
Phản ứng oxi hóa hoàn toàn (cháy) là phản ứng của hiđrocacbon no với oxi (O2) tạo ra sản phẩm là khí cacbon đioxit (CO2) và nước (H2O), đồng thời giải phóng một lượng lớn nhiệt.
2.2.2. Phương Trình Tổng Quát
CnH2n+2 + (3n+1)/2 O2 → n CO2 + (n+1) H2O + Nhiệt
Ví dụ:
CH4 + 2O2 → CO2 + 2H2O + Nhiệt
C3H8 + 5O2 → 3CO2 + 4H2O + Nhiệt
2.2.3. Đặc Điểm
- Phản ứng cháy của hiđrocacbon no là phản ứng tỏa nhiệt mạnh, được sử dụng rộng rãi trong đời sống và công nghiệp để cung cấp năng lượng.
- Khi đốt cháy hoàn toàn hiđrocacbon no, tỉ lệ số mol CO2 và H2O tạo ra phụ thuộc vào số lượng nguyên tử cacbon và hiđro trong phân tử.
- Nếu không đủ oxi, phản ứng cháy có thể tạo ra sản phẩm phụ là cacbon моноoxit (CO), một chất khí độc.
2.2.4. Ứng Dụng
Phản ứng cháy của hiđrocacbon no được ứng dụng rộng rãi:
- Nhiên liệu: Đốt cháy khí thiên nhiên, khí hóa lỏng, xăng, dầu để cung cấp nhiệt cho các nhà máy điện, động cơ đốt trong, lò sưởi, bếp nấu.
- Sản xuất điện: Các nhà máy nhiệt điện đốt than đá, dầu mỏ hoặc khí đốt để tạo ra hơi nước, làm quay turbin và phát điện.
2.3. Phản Ứng Cracking
2.3.1. Khái Niệm
Cracking là quá trình bẻ gãy các phân tử hiđrocacbon no mạch dài thành các phân tử hiđrocacbon nhỏ hơn (ankan và anken) dưới tác dụng của nhiệt độ và chất xúc tác.
2.3.2. Mục Đích
Mục đích chính của cracking là chuyển hóa các phân đoạn dầu mỏ có phân tử khối lớn, ít có giá trị sử dụng (như dầu nặng, cặn mazut) thành các phân đoạn có phân tử khối nhỏ hơn, có giá trị sử dụng cao hơn (như xăng, khí đốt).
2.3.3. Các Loại Cracking
Có hai loại cracking chính:
- Cracking nhiệt: Thực hiện ở nhiệt độ cao (450-700°C) mà không có chất xúc tác. Cracking nhiệt tạo ra hỗn hợp sản phẩm gồm ankan, anken và một ít hiđro.
- Cracking xúc tác: Thực hiện ở nhiệt độ thấp hơn (400-500°C) với sự có mặt của chất xúc tác như zeolit, aluminosilicat. Cracking xúc tác tạo ra sản phẩm có hàm lượng anken cao hơn, đặc biệt là các anken mạch ngắn như etilen và propilen, là nguyên liệu quan trọng cho công nghiệp hóa chất.
2.3.4. Ví Dụ Minh Họa
Cracking n-đecan (C10H22) có thể tạo ra các sản phẩm sau:
C10H22 → C5H12 + C5H10
C10H22 → C4H10 + C6H12
C10H22 → C3H8 + C7H14
2.3.5. Ứng Dụng
Cracking là quá trình quan trọng trong công nghiệp lọc hóa dầu:
- Sản xuất xăng: Cracking dầu nặng để tăng sản lượng xăng, đáp ứng nhu cầu sử dụng ngày càng tăng.
- Sản xuất olefin: Cracking tạo ra các olefin (anken) như etilen, propilen, butilen, là nguyên liệu để sản xuất polime (PE, PP, cao su), ancol, anđehit, axit hữu cơ.
- Cải thiện chất lượng nhiên liệu: Cracking giúp cải thiện chỉ số octan của xăng, tăng khả năng chống kích nổ của động cơ.
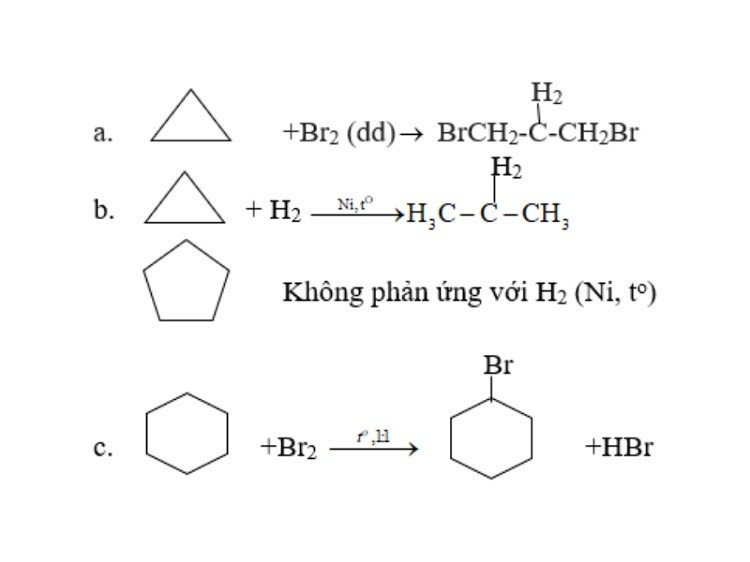
Phản ứng cộng mở vòng của Xicloankan
3. So Sánh Phản Ứng Của Ankan và Xicloankan
Mặc dù đều là hiđrocacbon no, ankan và xicloankan có một số khác biệt trong phản ứng hóa học do cấu trúc phân tử khác nhau.
3.1. Phản Ứng Thế
- Ankan: Phản ứng thế halogen xảy ra dễ dàng hơn ở các nguyên tử cacbon bậc cao.
- Xicloankan: Phản ứng thế halogen có thể xảy ra, nhưng khó khăn hơn so với ankan do ảnh hưởng của cấu trúc vòng.
3.2. Phản Ứng Cộng
- Ankan: Không tham gia phản ứng cộng do không có liên kết π.
- Xicloankan: Các xicloankan nhỏ (xiclopropan, xiclobutan) có thể tham gia phản ứng cộng mở vòng do sức căng vòng lớn. Ví dụ, xiclopropan cộng với hiđro tạo thành propan, cộng với brom tạo thành 1,3-đibrompropan.
3.3. Phản Ứng Oxi Hóa (Cháy)
- Ankan và Xicloankan: Đều cháy hoàn toàn tạo ra CO2 và H2O, tỏa nhiệt. Tuy nhiên, xicloankan thường cháy tạo ra nhiều khói hơn do tỉ lệ C/H cao hơn.
3.4. Phản Ứng Cracking
- Ankan: Tham gia phản ứng cracking tạo ra các ankan và anken mạch ngắn hơn.
- Xicloankan: Có thể tham gia phản ứng cracking, nhưng sản phẩm thường phức tạp hơn do sự phá vỡ cấu trúc vòng.
4. Ứng Dụng Của Kiến Thức Về Hiđrocacbon No Trong Thực Tế
Hiểu biết về hiđrocacbon no và các phản ứng đặc trưng của chúng có nhiều ứng dụng thực tế:
- Sản xuất nhiên liệu: Tối ưu hóa quá trình cracking để tăng sản lượng xăng và các nhiên liệu khác. Nghiên cứu và phát triển các loại nhiên liệu sạch hơn từ hiđrocacbon no.
- Tổng hợp hóa học: Sử dụng phản ứng thế halogen để điều chế các hợp chất hữu cơ trung gian, phục vụ cho sản xuất dược phẩm, thuốc trừ sâu, vật liệu polime.
- Bảo vệ môi trường: Nghiên cứu các biện pháp giảm thiểu ô nhiễm từ khí thải của động cơ đốt trong, sử dụng các chất xúc tác để đốt cháy hoàn toàn hiđrocacbon, giảm thiểu phát thải CO và các chất độc hại khác.
- Nghiên cứu khoa học: Hiđrocacbon no là đối tượng nghiên cứu quan trọng trong hóa học hữu cơ, hóa học dầu mỏ, hóa học môi trường. Các nhà khoa học không ngừng tìm kiếm các phương pháp mới để tổng hợp, chuyển hóa và ứng dụng hiđrocacbon no một cách hiệu quả và bền vững.
5. Mẹo Học Tập Hiệu Quả Về Hiđrocacbon No
Để học tốt về hiđrocacbon no và các phản ứng của chúng, bạn có thể áp dụng các mẹo sau:
- Học thuộc công thức cấu tạo và tên gọi của các ankan và xicloankan đơn giản: Metan, etan, propan, butan, xiclopropan, xiclobutan, xiclopentan, xiclohexan.
- Hiểu rõ cơ chế phản ứng thế halogen: Nắm vững các giai đoạn khơi mào, phát triển mạch, tắt mạch. Viết được phương trình phản ứng và xác định sản phẩm chính, sản phẩm phụ.
- Luyện tập viết phương trình phản ứng cháy: Tính toán lượng oxi cần thiết để đốt cháy hoàn toàn một lượng hiđrocacbon no nhất định.
- Tìm hiểu về quá trình cracking: Nắm vững mục đích, các loại cracking, điều kiện thực hiện và sản phẩm tạo thành.
- Sử dụng sơ đồ tư duy: Vẽ sơ đồ tư duy để hệ thống hóa kiến thức về cấu trúc, tính chất, phản ứng và ứng dụng của hiđrocacbon no.
- Giải bài tập: Làm nhiều bài tập từ cơ bản đến nâng cao để rèn luyện kỹ năng giải toán và vận dụng kiến thức vào thực tế.
- Tham khảo tài liệu: Đọc thêm sách giáo khoa, sách tham khảo, tài liệu trên internet để mở rộng kiến thức và hiểu sâu hơn về hiđrocacbon no. Bạn có thể tìm thấy rất nhiều tài liệu hữu ích trên tic.edu.vn.
- Học nhóm: Trao đổi, thảo luận với bạn bè để giải đáp thắc mắc và củng cố kiến thức.
- Liên hệ thực tế: Tìm hiểu về các ứng dụng của hiđrocacbon no trong đời sống và công nghiệp để tăng hứng thú học tập.
Phản ứng của benzen với halogen
6. 5 Ý Định Tìm Kiếm Của Người Dùng Về “Phản Ứng Đặc Trưng Của Hiđrocacbon No Là”
- Định nghĩa và giải thích: Người dùng muốn hiểu rõ phản ứng đặc trưng của hiđrocacbon no là gì, tại sao nó lại đặc trưng và cơ chế của phản ứng đó.
- Phân loại phản ứng: Người dùng muốn biết có những loại phản ứng đặc trưng nào của hiđrocacbon no, ví dụ như phản ứng thế, phản ứng cháy, phản ứng cracking.
- Ví dụ minh họa: Người dùng muốn xem các ví dụ cụ thể về các phản ứng đặc trưng của hiđrocacbon no, với phương trình hóa học và điều kiện phản ứng.
- Ứng dụng thực tế: Người dùng muốn biết các phản ứng đặc trưng của hiđrocacbon no được ứng dụng như thế nào trong đời sống và công nghiệp, ví dụ như sản xuất nhiên liệu, tổng hợp hóa học.
- So sánh với hiđrocacbon khác: Người dùng muốn so sánh phản ứng của hiđrocacbon no với hiđrocacbon không no và hiđrocacbon thơm, để hiểu rõ sự khác biệt và tính chất đặc trưng của từng loại.
7. Câu Hỏi Thường Gặp (FAQ) Về Hiđrocacbon No
1. Hiđrocacbon no là gì và tại sao chúng lại quan trọng?
Hiđrocacbon no là các hợp chất hữu cơ chỉ chứa liên kết đơn giữa các nguyên tử cacbon và hiđro. Chúng quan trọng vì là thành phần chính của nhiên liệu (khí đốt, xăng), nguyên liệu cho công nghiệp hóa chất và nhiều ứng dụng khác.
2. Phản ứng đặc trưng của hiđrocacbon no là gì?
Phản ứng đặc trưng của hiđrocacbon no là phản ứng thế, phản ứng cháy và phản ứng cracking.
3. Phản ứng thế halogen vào ankan xảy ra như thế nào?
Phản ứng thế halogen vào ankan xảy ra theo cơ chế gốc tự do, gồm ba giai đoạn: khơi mào, phát triển mạch và tắt mạch.
4. Tại sao phản ứng cháy của hiđrocacbon no lại tỏa nhiệt?
Phản ứng cháy của hiđrocacbon no tỏa nhiệt vì năng lượng liên kết của các sản phẩm (CO2 và H2O) lớn hơn năng lượng liên kết của các chất phản ứng (hiđrocacbon và O2).
5. Cracking là gì và tại sao nó lại quan trọng trong công nghiệp lọc hóa dầu?
Cracking là quá trình bẻ gãy các phân tử hiđrocacbon no mạch dài thành các phân tử nhỏ hơn. Nó quan trọng trong công nghiệp lọc hóa dầu vì giúp chuyển hóa các phân đoạn dầu mỏ có giá trị thấp thành các sản phẩm có giá trị cao như xăng và olefin.
6. Ankan và xicloankan khác nhau như thế nào?
Ankan là hiđrocacbon no mạch hở, còn xicloankan là hiđrocacbon no mạch vòng. Xicloankan nhỏ có thể tham gia phản ứng cộng mở vòng, trong khi ankan thì không.
7. Làm thế nào để học tốt về hiđrocacbon no?
Để học tốt về hiđrocacbon no, bạn nên học thuộc công thức, hiểu rõ cơ chế phản ứng, luyện tập giải bài tập và liên hệ kiến thức với thực tế.
8. Hiđrocacbon no có gây ô nhiễm môi trường không?
Có, việc đốt cháy hiđrocacbon no có thể tạo ra các chất gây ô nhiễm như CO2 (gây hiệu ứng nhà kính), CO (độc hại), NOx (gây mưa axit).
9. Có những biện pháp nào để giảm thiểu ô nhiễm từ việc sử dụng hiđrocacbon no?
Các biện pháp giảm thiểu ô nhiễm bao gồm sử dụng nhiên liệu sạch hơn, đốt cháy hoàn toàn hiđrocacbon, sử dụng chất xúc tác để giảm phát thải, và phát triển các nguồn năng lượng tái tạo thay thế.
10. Tôi có thể tìm thêm thông tin về hiđrocacbon no ở đâu?
Bạn có thể tìm thêm thông tin về hiđrocacbon no trong sách giáo khoa, sách tham khảo, các trang web giáo dục uy tín như tic.edu.vn, và các tạp chí khoa học.
8. Kết Luận
Hiđrocacbon no là một nhóm hợp chất hữu cơ quan trọng với nhiều ứng dụng trong đời sống và công nghiệp. Phản ứng đặc trưng của chúng bao gồm phản ứng thế, phản ứng cháy và phản ứng cracking. Hiểu rõ về cấu trúc, tính chất và phản ứng của hiđrocacbon no giúp chúng ta ứng dụng chúng một cách hiệu quả và bền vững.
Bạn đang gặp khó khăn trong việc tìm kiếm tài liệu học tập chất lượng? Bạn muốn nâng cao kiến thức và kỹ năng một cách hiệu quả? Hãy truy cập ngay tic.edu.vn để khám phá nguồn tài liệu học tập phong phú, đa dạng và được kiểm duyệt kỹ lưỡng. Tại tic.edu.vn, bạn sẽ tìm thấy các công cụ hỗ trợ học tập trực tuyến, cộng đồng học tập sôi nổi và cơ hội phát triển kỹ năng toàn diện. Đừng bỏ lỡ cơ hội học tập tuyệt vời này! Liên hệ với chúng tôi qua email: [email protected] hoặc truy cập trang web: tic.edu.vn để biết thêm chi tiết.