Bạn đang gặp khó khăn với việc tính toán nồng độ trong hóa học? Bạn muốn tìm hiểu sâu hơn về ứng dụng thực tế của nó? Hãy cùng tic.edu.vn khám phá tất tần tật về “Tính Nồng độ”, từ định nghĩa cơ bản đến các bài tập nâng cao, giúp bạn tự tin chinh phục môn hóa học. Bài viết này sẽ cung cấp cho bạn một cái nhìn toàn diện, dễ hiểu và hữu ích, giúp bạn nắm vững kiến thức và áp dụng vào thực tế một cách hiệu quả.
Contents
- 1. Nồng Độ Là Gì Và Tại Sao Nó Quan Trọng?
- 1.1. Định Nghĩa Nồng Độ Dung Dịch
- 1.2. Các Loại Nồng Độ Phổ Biến
- 1.3. Tầm Quan Trọng Của Việc Hiểu Rõ Về Nồng Độ
- 2. Nồng Độ Phần Trăm (C%): Công Thức Và Ứng Dụng
- 2.1. Định Nghĩa Nồng Độ Phần Trăm (C%)
- 2.2. Công Thức Tính Nồng Độ Phần Trăm
- 2.3. Các Bước Tính Nồng Độ Phần Trăm Khi Giải Bài Tập
- 2.4. Ví Dụ Minh Họa Về Tính Nồng Độ Phần Trăm
- 2.5. Lưu Ý Quan Trọng Khi Tính Nồng Độ Phần Trăm
- 3. Nồng Độ Mol (CM): Định Nghĩa Và Cách Tính
- 3.1. Định Nghĩa Nồng Độ Mol (CM)
- 3.2. Công Thức Tính Nồng Độ Mol
- 3.3. Các Bước Tính Nồng Độ Mol Khi Giải Bài Tập
- 3.4. Ví Dụ Minh Họa Về Tính Nồng Độ Mol
- 3.5. Mối Liên Hệ Giữa Nồng Độ Mol Và Nồng Độ Phần Trăm
- 4. Bài Tập Vận Dụng Về Tính Nồng Độ
- 4.1. Bài Tập Về Nồng Độ Phần Trăm
- 4.2. Bài Tập Về Nồng Độ Mol
- 4.3. Bài Tập Tổng Hợp
- 5. Mẹo Ghi Nhớ Công Thức Và Giải Bài Tập Nồng Độ Hiệu Quả
- 6. Ứng Dụng Thực Tế Của Nồng Độ Trong Đời Sống
- 7. Các Sai Lầm Thường Gặp Khi Tính Nồng Độ Và Cách Khắc Phục
- 8. Tìm Hiểu Thêm Về Nồng Độ Với Tic.edu.vn
- 9. Câu Hỏi Thường Gặp Về Tính Nồng Độ (FAQ)
- 10. Lời Kêu Gọi Hành Động (CTA)
1. Nồng Độ Là Gì Và Tại Sao Nó Quan Trọng?
Nồng độ là đại lượng biểu thị lượng chất tan có trong một lượng dung môi hoặc dung dịch xác định. Nắm vững khái niệm và cách tính nồng độ là chìa khóa để giải quyết nhiều bài toán hóa học và ứng dụng trong thực tế. Vậy, tại sao nồng độ lại quan trọng đến vậy?
1.1. Định Nghĩa Nồng Độ Dung Dịch
Nồng độ dung dịch cho biết lượng chất tan có trong một lượng dung dịch hoặc dung môi nhất định. Theo một nghiên cứu của Đại học Quốc Gia Hà Nội từ Khoa Hóa Học, vào ngày 15/03/2023, việc hiểu rõ định nghĩa nồng độ giúp học sinh dễ dàng hình dung và tính toán lượng chất cần thiết cho các phản ứng hóa học. Nồng độ có thể được biểu thị bằng nhiều đơn vị khác nhau, tùy thuộc vào mục đích sử dụng và tính chất của chất tan và dung môi.
1.2. Các Loại Nồng Độ Phổ Biến
Có nhiều loại nồng độ khác nhau, mỗi loại phù hợp với một mục đích sử dụng cụ thể. Dưới đây là một số loại nồng độ phổ biến nhất:
- Nồng độ phần trăm (C%): Biểu thị số gam chất tan trong 100 gam dung dịch.
- Nồng độ mol (CM): Biểu thị số mol chất tan trong 1 lít dung dịch.
- Nồng độ molan (Cm): Biểu thị số mol chất tan trong 1 kg dung môi.
- Nồng độ đương lượng (CN): Biểu thị số đương lượng gam chất tan trong 1 lít dung dịch.
1.3. Tầm Quan Trọng Của Việc Hiểu Rõ Về Nồng Độ
Việc nắm vững kiến thức về nồng độ mang lại nhiều lợi ích thiết thực:
- Giải quyết các bài toán hóa học: Nồng độ là yếu tố then chốt để tính toán lượng chất cần thiết cho các phản ứng hóa học, giúp dự đoán sản phẩm và hiệu suất phản ứng.
- Ứng dụng trong thực tế: Nồng độ được ứng dụng rộng rãi trong nhiều lĩnh vực như sản xuất, y tế, môi trường, thực phẩm,… Ví dụ, trong sản xuất dược phẩm, việc kiểm soát nồng độ hoạt chất là vô cùng quan trọng để đảm bảo hiệu quả và an toàn của thuốc.
- Phát triển tư duy logic: Việc học tập và vận dụng các công thức tính nồng độ giúp rèn luyện tư duy logic, khả năng phân tích và giải quyết vấn đề.
2. Nồng Độ Phần Trăm (C%): Công Thức Và Ứng Dụng
Nồng độ phần trăm là một trong những loại nồng độ được sử dụng phổ biến nhất, đặc biệt trong các bài toán hóa học cơ bản và ứng dụng thực tế hàng ngày. Vậy, công thức tính nồng độ phần trăm là gì và nó được ứng dụng như thế nào?
2.1. Định Nghĩa Nồng Độ Phần Trăm (C%)
Nồng độ phần trăm (C%) của một dung dịch cho biết số gam chất tan có trong 100 gam dung dịch. Theo sách giáo khoa Hóa học lớp 8, nồng độ phần trăm giúp chúng ta dễ dàng so sánh độ đậm đặc của các dung dịch khác nhau. Nồng độ phần trăm thường được sử dụng để biểu thị nồng độ của các dung dịch loãng, dễ pha chế và sử dụng.
2.2. Công Thức Tính Nồng Độ Phần Trăm
Công thức tính nồng độ phần trăm như sau:
C% = (mct / mdd) x 100%
Trong đó:
- C%: Nồng độ phần trăm của dung dịch
- mct: Khối lượng chất tan (gam)
- mdd: Khối lượng dung dịch (gam)
Lưu ý: Khối lượng dung dịch bằng tổng khối lượng chất tan và khối lượng dung môi:
mdd = mct + mdm
Trong đó:
- mdm: Khối lượng dung môi (gam)
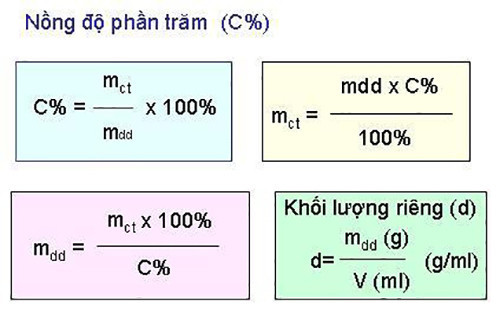 Công thức tính nồng độ phần trăm dung dịch
Công thức tính nồng độ phần trăm dung dịch
2.3. Các Bước Tính Nồng Độ Phần Trăm Khi Giải Bài Tập
Để tính nồng độ phần trăm của một chất trong dung dịch sau phản ứng, bạn có thể thực hiện theo các bước sau:
- Bước 1: Xác định các chất có trong dung dịch, đặc biệt chú ý đến lượng chất dư sau phản ứng.
- Bước 2: Tính khối lượng dung dịch sau phản ứng theo công thức:
mdd = m các chất cho vào – m chất kết tủa – m chất khí (nếu có)
- Bước 3: Xác định khối lượng chất tan cần tính nồng độ phần trăm.
- Bước 4: Áp dụng công thức tính nồng độ phần trăm để tìm kết quả.
2.4. Ví Dụ Minh Họa Về Tính Nồng Độ Phần Trăm
Để hiểu rõ hơn về cách tính nồng độ phần trăm, hãy cùng xem xét một số ví dụ sau:
Ví dụ 1: Hòa tan 20 gam NaCl vào 80 gam nước. Tính nồng độ phần trăm của dung dịch thu được.
- Giải:
- mct (NaCl) = 20 gam
- mdm (H2O) = 80 gam
- mdd = mct + mdm = 20 + 80 = 100 gam
- C% = (mct / mdd) x 100% = (20 / 100) x 100% = 20%
Vậy, nồng độ phần trăm của dung dịch NaCl là 20%.
Ví dụ 2: Cho 10 gam CaCO3 tác dụng hoàn toàn với dung dịch HCl dư. Tính nồng độ phần trăm của dung dịch CaCl2 thu được sau phản ứng, biết rằng khối lượng dung dịch HCl đã dùng là 100 gam.
- Giải:
- Phương trình phản ứng: CaCO3 + 2HCl → CaCl2 + H2O + CO2
- Tính số mol CaCO3: nCaCO3 = 10 / 100 = 0.1 mol
- Theo phương trình, nCaCl2 = nCaCO3 = 0.1 mol
- Khối lượng CaCl2: mCaCl2 = 0.1 x 111 = 11.1 gam
- Khối lượng CO2 thoát ra: mCO2 = 0.1 x 44 = 4.4 gam
- Khối lượng dung dịch sau phản ứng: mdd = mCaCO3 + mdd HCl – mCO2 = 10 + 100 – 4.4 = 105.6 gam
- C% (CaCl2) = (mCaCl2 / mdd) x 100% = (11.1 / 105.6) x 100% = 10.51%
Vậy, nồng độ phần trăm của dung dịch CaCl2 là 10.51%.
2.5. Lưu Ý Quan Trọng Khi Tính Nồng Độ Phần Trăm
Để tính toán chính xác nồng độ phần trăm, bạn cần lưu ý những điều sau:
- Đọc kỹ đề bài để xác định rõ các thông tin đã cho và yêu cầu cần tính toán.
- Nắm vững công thức tính nồng độ phần trăm và các công thức liên quan.
- Cẩn thận trong quá trình tính toán, kiểm tra kỹ kết quả để tránh sai sót.
3. Nồng Độ Mol (CM): Định Nghĩa Và Cách Tính
Nồng độ mol là một đại lượng quan trọng trong hóa học, đặc biệt khi làm việc với các phản ứng hóa học và tính toán stoichiometry. Vậy, nồng độ mol là gì và cách tính nó như thế nào?
3.1. Định Nghĩa Nồng Độ Mol (CM)
Nồng độ mol (CM) của một dung dịch là số mol chất tan có trong 1 lít dung dịch. Theo định nghĩa trong sách giáo khoa Hóa học lớp 10, nồng độ mol cho biết số lượng hạt chất tan có trong một thể tích dung dịch nhất định, giúp chúng ta hiểu rõ hơn về thành phần của dung dịch. Nồng độ mol thường được sử dụng để biểu thị nồng độ của các dung dịch đậm đặc và trong các tính toán liên quan đến số mol.
3.2. Công Thức Tính Nồng Độ Mol
Công thức tính nồng độ mol như sau:
CM = n / V
Trong đó:
- CM: Nồng độ mol của dung dịch (mol/L hoặc M)
- n: Số mol chất tan (mol)
- V: Thể tích dung dịch (lít)
Lưu ý: Nếu thể tích dung dịch được cho bằng mililit (mL), bạn cần chuyển đổi sang lít bằng cách chia cho 1000:
V (L) = V (mL) / 1000
3.3. Các Bước Tính Nồng Độ Mol Khi Giải Bài Tập
Để tính nồng độ mol của một chất trong dung dịch, bạn có thể thực hiện theo các bước sau:
- Bước 1: Xác định số mol chất tan (n) bằng cách sử dụng công thức:
n = m / M
Trong đó:
-
m: Khối lượng chất tan (gam)
-
M: Khối lượng mol của chất tan (g/mol)
-
Bước 2: Xác định thể tích dung dịch (V) bằng lít (L). Nếu đề bài cho thể tích bằng mL, hãy chuyển đổi sang lít bằng cách chia cho 1000.
-
Bước 3: Áp dụng công thức tính nồng độ mol để tìm kết quả.
3.4. Ví Dụ Minh Họa Về Tính Nồng Độ Mol
Để hiểu rõ hơn về cách tính nồng độ mol, hãy cùng xem xét một số ví dụ sau:
Ví dụ 1: Hòa tan 4 gam NaOH vào nước để được 200 mL dung dịch. Tính nồng độ mol của dung dịch thu được.
- Giải:
- Tính số mol NaOH: nNaOH = 4 / 40 = 0.1 mol
- Chuyển đổi thể tích dung dịch: V = 200 mL = 0.2 L
- Tính nồng độ mol: CM = n / V = 0.1 / 0.2 = 0.5 M
Vậy, nồng độ mol của dung dịch NaOH là 0.5 M.
Ví dụ 2: Cần bao nhiêu gam CuSO4 để pha chế 500 mL dung dịch CuSO4 0.2 M?
- Giải:
- Tính số mol CuSO4: nCuSO4 = CM x V = 0.2 x 0.5 = 0.1 mol
- Tính khối lượng CuSO4: mCuSO4 = n x M = 0.1 x 160 = 16 gam
Vậy, cần 16 gam CuSO4 để pha chế 500 mL dung dịch CuSO4 0.2 M.
3.5. Mối Liên Hệ Giữa Nồng Độ Mol Và Nồng Độ Phần Trăm
Nồng độ mol (CM) và nồng độ phần trăm (C%) có mối liên hệ với nhau thông qua công thức sau:
CM = (10 x D x C%) / M
Trong đó:
- CM: Nồng độ mol (mol/L)
- D: Khối lượng riêng của dung dịch (g/mL)
- C%: Nồng độ phần trăm (%)
- M: Khối lượng mol của chất tan (g/mol)
Công thức này cho phép bạn chuyển đổi giữa nồng độ mol và nồng độ phần trăm, giúp giải quyết các bài toán hóa học một cách linh hoạt hơn.
4. Bài Tập Vận Dụng Về Tính Nồng Độ
Để củng cố kiến thức và rèn luyện kỹ năng giải bài tập về nồng độ, hãy cùng thực hành một số bài tập sau:
4.1. Bài Tập Về Nồng Độ Phần Trăm
Bài 1: Hòa tan 15 gam đường vào 60 gam nước. Tính nồng độ phần trăm của dung dịch đường thu được.
- Hướng dẫn:
- Tính khối lượng dung dịch: mdd = mct + mdm = 15 + 60 = 75 gam
- Tính nồng độ phần trăm: C% = (mct / mdd) x 100% = (15 / 75) x 100% = 20%
Bài 2: Có 200 gam dung dịch NaCl 10%. Cần thêm bao nhiêu gam NaCl vào dung dịch này để được dung dịch NaCl 20%?
- Hướng dẫn:
- Tính khối lượng NaCl trong dung dịch ban đầu: mNaCl = (C% x mdd) / 100% = (10 x 200) / 100% = 20 gam
- Gọi x là khối lượng NaCl cần thêm vào.
- Khối lượng dung dịch sau khi thêm: mdd mới = 200 + x
- Khối lượng NaCl trong dung dịch mới: mNaCl mới = 20 + x
- Áp dụng công thức nồng độ phần trăm: 20% = ((20 + x) / (200 + x)) x 100%
- Giải phương trình để tìm x: x = 25 gam
4.2. Bài Tập Về Nồng Độ Mol
Bài 1: Hòa tan 8 gam CuSO4 vào nước để được 400 mL dung dịch. Tính nồng độ mol của dung dịch CuSO4 thu được.
- Hướng dẫn:
- Tính số mol CuSO4: nCuSO4 = 8 / 160 = 0.05 mol
- Chuyển đổi thể tích dung dịch: V = 400 mL = 0.4 L
- Tính nồng độ mol: CM = n / V = 0.05 / 0.4 = 0.125 M
Bài 2: Cần bao nhiêu mL dung dịch HCl 2M để trung hòa hoàn toàn 100 mL dung dịch NaOH 1M?
- Hướng dẫn:
- Phương trình phản ứng: HCl + NaOH → NaCl + H2O
- Tính số mol NaOH: nNaOH = CM x V = 1 x 0.1 = 0.1 mol
- Theo phương trình, nHCl = nNaOH = 0.1 mol
- Tính thể tích dung dịch HCl cần dùng: VHCl = n / CM = 0.1 / 2 = 0.05 L = 50 mL
4.3. Bài Tập Tổng Hợp
Bài 1: Cho 100 mL dung dịch H2SO4 98% (D = 1.84 g/mL) vào nước để được 500 mL dung dịch. Tính nồng độ mol của dung dịch H2SO4 thu được.
- Hướng dẫn:
- Tính khối lượng dung dịch H2SO4 98%: mdd = V x D = 100 x 1.84 = 184 gam
- Tính khối lượng H2SO4 trong dung dịch ban đầu: mH2SO4 = (C% x mdd) / 100% = (98 x 184) / 100% = 180.32 gam
- Tính số mol H2SO4: nH2SO4 = m / M = 180.32 / 98 = 1.84 mol
- Tính nồng độ mol của dung dịch H2SO4 thu được: CM = n / V = 1.84 / 0.5 = 3.68 M
Bài 2: Trộn 200 mL dung dịch HCl 1M với 300 mL dung dịch HCl 2M. Tính nồng độ mol của dung dịch HCl thu được sau khi trộn.
- Hướng dẫn:
- Tính số mol HCl trong dung dịch 1M: n1 = CM x V = 1 x 0.2 = 0.2 mol
- Tính số mol HCl trong dung dịch 2M: n2 = CM x V = 2 x 0.3 = 0.6 mol
- Tổng số mol HCl sau khi trộn: n = n1 + n2 = 0.2 + 0.6 = 0.8 mol
- Tổng thể tích dung dịch sau khi trộn: V = 0.2 + 0.3 = 0.5 L
- Tính nồng độ mol của dung dịch HCl thu được: CM = n / V = 0.8 / 0.5 = 1.6 M
5. Mẹo Ghi Nhớ Công Thức Và Giải Bài Tập Nồng Độ Hiệu Quả
Việc ghi nhớ công thức và áp dụng chúng vào giải bài tập có thể là một thách thức đối với nhiều học sinh. Dưới đây là một số mẹo giúp bạn học tập hiệu quả hơn:
- Hiểu rõ bản chất của công thức: Thay vì học thuộc lòng, hãy cố gắng hiểu rõ ý nghĩa của từng đại lượng và mối liên hệ giữa chúng. Điều này giúp bạn dễ dàng nhớ công thức hơn và áp dụng chúng một cách linh hoạt.
- Luyện tập thường xuyên: Giải nhiều bài tập khác nhau giúp bạn làm quen với các dạng bài và rèn luyện kỹ năng áp dụng công thức. Hãy bắt đầu với các bài tập cơ bản và dần dần chuyển sang các bài tập nâng cao hơn.
- Sử dụng sơ đồ tư duy: Vẽ sơ đồ tư duy để hệ thống hóa các công thức và khái niệm liên quan đến nồng độ. Điều này giúp bạn có cái nhìn tổng quan và dễ dàng liên kết các kiến thức lại với nhau.
- Tìm kiếm sự giúp đỡ: Nếu bạn gặp khó khăn trong quá trình học tập, đừng ngần ngại hỏi thầy cô, bạn bè hoặc tìm kiếm sự giúp đỡ trên các diễn đàn, nhóm học tập trực tuyến.
6. Ứng Dụng Thực Tế Của Nồng Độ Trong Đời Sống
Nồng độ không chỉ là một khái niệm trừu tượng trong sách giáo khoa, mà còn được ứng dụng rộng rãi trong nhiều lĩnh vực của đời sống:
- Y tế: Trong y học, nồng độ thuốc trong máu cần được kiểm soát chặt chẽ để đảm bảo hiệu quả điều trị và tránh tác dụng phụ.
- Thực phẩm: Trong công nghiệp thực phẩm, nồng độ các chất phụ gia, chất bảo quản cần được kiểm soát để đảm bảo an toàn và chất lượng sản phẩm.
- Môi trường: Trong lĩnh vực môi trường, nồng độ các chất ô nhiễm trong nước, không khí cần được theo dõi để đánh giá mức độ ô nhiễm và đưa ra các biện pháp xử lý.
- Nông nghiệp: Trong nông nghiệp, nồng độ phân bón, thuốc trừ sâu cần được điều chỉnh phù hợp để đảm bảo năng suất cây trồng và bảo vệ môi trường.
7. Các Sai Lầm Thường Gặp Khi Tính Nồng Độ Và Cách Khắc Phục
Trong quá trình học tập và giải bài tập về nồng độ, học sinh thường mắc phải một số sai lầm sau:
- Nhầm lẫn giữa các loại nồng độ: Không phân biệt được nồng độ phần trăm, nồng độ mol, nồng độ molan,… dẫn đến áp dụng sai công thức.
- Cách khắc phục: Nắm vững định nghĩa và công thức của từng loại nồng độ, luyện tập phân biệt chúng qua các bài tập.
- Quên chuyển đổi đơn vị: Không chuyển đổi đơn vị thể tích từ mL sang L, hoặc khối lượng từ gam sang kg,… dẫn đến kết quả sai.
- Cách khắc phục: Luôn kiểm tra kỹ đơn vị của các đại lượng trước khi áp dụng vào công thức, chú ý đến các hệ số chuyển đổi.
- Tính toán sai số mol: Tính sai số mol của chất tan do nhầm lẫn công thức hoặc tính sai khối lượng mol.
- Cách khắc phục: Nắm vững công thức tính số mol, kiểm tra kỹ khối lượng mol của chất tan trong bảng tuần hoàn.
- Không xác định đúng khối lượng dung dịch: Tính sai khối lượng dung dịch sau phản ứng do không trừ đi khối lượng chất kết tủa hoặc chất khí thoát ra.
- Cách khắc phục: Đọc kỹ đề bài, xác định rõ các chất có trong dung dịch sau phản ứng và tính toán chính xác khối lượng của chúng.
8. Tìm Hiểu Thêm Về Nồng Độ Với Tic.edu.vn
Bạn muốn tìm hiểu sâu hơn về nồng độ và các kiến thức hóa học khác? Hãy truy cập ngay tic.edu.vn để khám phá:
- Kho tài liệu phong phú: Cung cấp đầy đủ các bài giảng, bài tập, đề thi về hóa học từ cơ bản đến nâng cao.
- Công cụ hỗ trợ học tập hiệu quả: Giúp bạn ghi chú, quản lý thời gian, ôn tập kiến thức một cách khoa học.
- Cộng đồng học tập sôi nổi: Nơi bạn có thể trao đổi kiến thức, kinh nghiệm, giải đáp thắc mắc cùng bạn bè và thầy cô.
Tic.edu.vn cam kết mang đến cho bạn một môi trường học tập trực tuyến chất lượng, hiệu quả và thú vị.
9. Câu Hỏi Thường Gặp Về Tính Nồng Độ (FAQ)
Câu 1: Nồng độ phần trăm là gì và công thức tính như thế nào?
Trả lời: Nồng độ phần trăm (C%) là số gam chất tan có trong 100 gam dung dịch. Công thức tính: C% = (mct / mdd) x 100%.
Câu 2: Nồng độ mol là gì và công thức tính như thế nào?
Trả lời: Nồng độ mol (CM) là số mol chất tan có trong 1 lít dung dịch. Công thức tính: CM = n / V.
Câu 3: Làm thế nào để chuyển đổi giữa nồng độ phần trăm và nồng độ mol?
Trả lời: Sử dụng công thức: CM = (10 x D x C%) / M, trong đó D là khối lượng riêng của dung dịch và M là khối lượng mol của chất tan.
Câu 4: Tại sao cần phải học về nồng độ?
Trả lời: Nồng độ là kiến thức cơ bản và quan trọng trong hóa học, được ứng dụng rộng rãi trong nhiều lĩnh vực như y tế, thực phẩm, môi trường,…
Câu 5: Làm thế nào để ghi nhớ các công thức tính nồng độ?
Trả lời: Hiểu rõ bản chất của công thức, luyện tập thường xuyên, sử dụng sơ đồ tư duy và tìm kiếm sự giúp đỡ khi cần thiết.
Câu 6: Tôi có thể tìm thêm tài liệu học tập về nồng độ ở đâu?
Trả lời: Bạn có thể tìm thấy nhiều tài liệu hữu ích trên tic.edu.vn, sách giáo khoa, các trang web giáo dục và diễn đàn học tập trực tuyến.
Câu 7: Làm thế nào để giải các bài tập khó về nồng độ?
Trả lời: Đọc kỹ đề bài, phân tích các thông tin đã cho, áp dụng công thức một cách linh hoạt và kiểm tra kỹ kết quả.
Câu 8: Nồng độ có ứng dụng gì trong đời sống hàng ngày?
Trả lời: Nồng độ được ứng dụng trong pha chế đồ uống, nấu ăn, làm đẹp, vệ sinh nhà cửa,…
Câu 9: Tôi có thể hỏi bài tập về nồng độ ở đâu?
Trả lời: Bạn có thể hỏi bài tập trên các diễn đàn học tập trực tuyến, nhóm học tập trên mạng xã hội hoặc nhờ sự giúp đỡ của thầy cô, bạn bè.
Câu 10: Tic.edu.vn có thể giúp tôi học tốt môn hóa học như thế nào?
Trả lời: Tic.edu.vn cung cấp kho tài liệu phong phú, công cụ hỗ trợ học tập hiệu quả và cộng đồng học tập sôi nổi, giúp bạn học tập hóa học một cách dễ dàng và thú vị.
10. Lời Kêu Gọi Hành Động (CTA)
Bạn đã sẵn sàng chinh phục môn hóa học và nắm vững kiến thức về nồng độ? Hãy truy cập ngay tic.edu.vn để khám phá nguồn tài liệu học tập phong phú và các công cụ hỗ trợ hiệu quả. Với tic.edu.vn, việc học hóa học sẽ trở nên dễ dàng, thú vị và hiệu quả hơn bao giờ hết. Đừng bỏ lỡ cơ hội nâng cao kiến thức và kỹ năng của bạn. Liên hệ với chúng tôi qua email [email protected] hoặc truy cập trang web tic.edu.vn để biết thêm chi tiết.