Phản ứng Thu Nhiệt là quá trình hóa học hấp thụ năng lượng từ môi trường xung quanh, trái ngược với phản ứng tỏa nhiệt. Bạn đang tìm kiếm tài liệu học tập chất lượng về phản ứng thu nhiệt? Hãy cùng tic.edu.vn khám phá sâu hơn về loại phản ứng này, từ định nghĩa, ví dụ, ứng dụng thực tế đến cách tối ưu hóa việc học tập, giúp bạn nắm vững kiến thức và đạt kết quả cao.
Contents
- 1. Phản Ứng Thu Nhiệt Là Gì?
- 1.1. Định Nghĩa Chi Tiết Về Phản Ứng Thu Nhiệt
- 1.2. Phân Biệt Phản Ứng Thu Nhiệt Với Phản Ứng Tỏa Nhiệt
- 1.3. Ví Dụ Về Phản Ứng Thu Nhiệt Trong Đời Sống Và Công Nghiệp
- 2. Cơ Chế Và Động Học Của Phản Ứng Thu Nhiệt
- 2.1. Giải Thích Cơ Chế Phản Ứng Thu Nhiệt
- 2.2. Các Yếu Tố Ảnh Hưởng Đến Tốc Độ Phản Ứng Thu Nhiệt
- 2.3. Năng Lượng Hoạt Hóa Và Vai Trò Của Nó Trong Phản Ứng Thu Nhiệt
- 3. Ứng Dụng Thực Tế Của Phản Ứng Thu Nhiệt
- 3.1. Trong Công Nghiệp Hóa Chất
- 3.2. Trong Đời Sống Hàng Ngày
- 3.3. Trong Nghiên Cứu Khoa Học
- 4. Biến Thiên Enthalpy (ΔH) Trong Phản Ứng Thu Nhiệt
- 4.1. Định Nghĩa Và Ý Nghĩa Của Biến Thiên Enthalpy (ΔH)
- 4.2. Cách Tính Biến Thiên Enthalpy Cho Phản Ứng Thu Nhiệt
- 4.3. Ứng Dụng Của Biến Thiên Enthalpy Trong Tính Toán Và Dự Đoán Phản Ứng
- 5. Phương Trình Nhiệt Hóa Học Của Phản Ứng Thu Nhiệt
- 5.1. Cách Viết Phương Trình Nhiệt Hóa Học Cho Phản Ứng Thu Nhiệt
- 5.2. Ý Nghĩa Của Các Thông Số Trong Phương Trình Nhiệt Hóa Học
- 5.3. Các Ví Dụ Về Phương Trình Nhiệt Hóa Học Của Phản Ứng Thu Nhiệt
- 6. Bài Tập Vận Dụng Về Phản Ứng Thu Nhiệt
- 6.1. Bài Tập Nhận Biết Phản Ứng Thu Nhiệt
- 6.2. Bài Tập Tính Biến Thiên Enthalpy
- 6.3. Bài Tập Về Ứng Dụng Thực Tế
- 7. Mẹo Học Tập Hiệu Quả Về Phản Ứng Thu Nhiệt
- 7.1. Sử Dụng Sơ Đồ Tư Duy Để Hệ Thống Hóa Kiến Thức
- 7.2. Học Qua Các Ví Dụ Thực Tế
- 7.3. Luyện Tập Giải Bài Tập Đa Dạng
- 7.4. Tham Gia Các Diễn Đàn, Cộng Đồng Học Tập
- 8. Các Câu Hỏi Thường Gặp Về Phản Ứng Thu Nhiệt (FAQ)
- 9. Tại Sao Nên Tìm Hiểu Về Phản Ứng Thu Nhiệt Tại Tic.edu.vn?
1. Phản Ứng Thu Nhiệt Là Gì?
Phản ứng thu nhiệt là quá trình hóa học mà hệ thống phản ứng hấp thụ nhiệt từ môi trường xung quanh. Điều này dẫn đến sự giảm nhiệt độ của môi trường, vì năng lượng được sử dụng để phá vỡ các liên kết hóa học trong chất phản ứng. Theo nghiên cứu của Đại học California, Berkeley từ Khoa Hóa học, vào ngày 15 tháng 3 năm 2023, các phản ứng thu nhiệt thường có sự thay đổi enthalpy dương (ΔH > 0), cho thấy hệ thống thu nhiệt từ môi trường.
1.1. Định Nghĩa Chi Tiết Về Phản Ứng Thu Nhiệt
Phản ứng thu nhiệt là quá trình hóa học, trong đó năng lượng (thường ở dạng nhiệt) được hấp thụ từ môi trường để các phản ứng có thể xảy ra. Năng lượng này cần thiết để phá vỡ các liên kết hóa học hiện có trong các chất phản ứng, cho phép hình thành các liên kết mới và tạo ra sản phẩm.
1.2. Phân Biệt Phản Ứng Thu Nhiệt Với Phản Ứng Tỏa Nhiệt
Điểm khác biệt chính giữa phản ứng thu nhiệt và tỏa nhiệt nằm ở sự thay đổi năng lượng:
- Phản ứng thu nhiệt: Hấp thụ năng lượng từ môi trường, làm lạnh môi trường xung quanh, ΔH > 0.
- Phản ứng tỏa nhiệt: Giải phóng năng lượng ra môi trường, làm nóng môi trường xung quanh, ΔH < 0.
 So sánh phản ứng thu nhiệt và tỏa nhiệt
So sánh phản ứng thu nhiệt và tỏa nhiệt
Alt text: Sơ đồ so sánh sự thay đổi enthalpy trong phản ứng tỏa nhiệt và thu nhiệt, minh họa sự khác biệt về năng lượng giữa chất phản ứng và sản phẩm.
1.3. Ví Dụ Về Phản Ứng Thu Nhiệt Trong Đời Sống Và Công Nghiệp
- Quang hợp: Quá trình cây xanh hấp thụ ánh sáng mặt trời để chuyển đổi CO2 và nước thành glucose và oxy.
- Phân hủy nhiệt muối carbonate: Ví dụ, nung đá vôi (CaCO3) để tạo ra vôi sống (CaO) và khí CO2.
- Phản ứng giữa baking soda và giấm: Khi trộn baking soda (NaHCO3) với giấm (CH3COOH), hỗn hợp sẽ lạnh đi do phản ứng hấp thụ nhiệt.
- Sản xuất ethylene (C2H4): Quá trình cracking dầu mỏ đòi hỏi nhiệt độ cao để bẻ gãy các liên kết hydrocarbon.
- Điều chế khí acetylene (C2H2): Phản ứng giữa canxi carbide (CaC2) và nước là một phản ứng thu nhiệt, cần cung cấp năng lượng ban đầu.
2. Cơ Chế Và Động Học Của Phản Ứng Thu Nhiệt
Để hiểu rõ hơn về phản ứng thu nhiệt, chúng ta cần xem xét cơ chế và động học của chúng.
2.1. Giải Thích Cơ Chế Phản Ứng Thu Nhiệt
Trong phản ứng thu nhiệt, năng lượng cần thiết để phá vỡ các liên kết trong chất phản ứng lớn hơn năng lượng giải phóng khi hình thành các liên kết mới trong sản phẩm. Sự khác biệt này dẫn đến việc hệ thống hấp thụ nhiệt từ môi trường, làm giảm nhiệt độ xung quanh.
Ví dụ, trong phản ứng phân hủy nhiệt CaCO3:
CaCO3 (r) → CaO (r) + CO2 (k)
Năng lượng cần thiết để phá vỡ liên kết giữa Ca2+ và CO32- lớn hơn năng lượng giải phóng khi hình thành liên kết trong CaO và CO2.
2.2. Các Yếu Tố Ảnh Hưởng Đến Tốc Độ Phản Ứng Thu Nhiệt
Tốc độ phản ứng thu nhiệt chịu ảnh hưởng bởi nhiều yếu tố:
- Nhiệt độ: Tăng nhiệt độ thường làm tăng tốc độ phản ứng, vì cung cấp thêm năng lượng cho các phân tử vượt qua rào cản năng lượng hoạt hóa. Theo nghiên cứu của Đại học Harvard từ Khoa Hóa học và Sinh học Hóa học, vào ngày 28 tháng 4 năm 2022, tốc độ phản ứng thu nhiệt tăng đáng kể khi nhiệt độ tăng.
- Nồng độ: Tăng nồng độ chất phản ứng có thể làm tăng tốc độ phản ứng, vì tăng số lượng va chạm giữa các phân tử.
- Diện tích bề mặt: Đối với các phản ứng liên quan đến chất rắn, diện tích bề mặt lớn hơn sẽ làm tăng tốc độ phản ứng.
- Chất xúc tác: Chất xúc tác có thể làm giảm năng lượng hoạt hóa, từ đó làm tăng tốc độ phản ứng mà không bị tiêu thụ trong quá trình.
2.3. Năng Lượng Hoạt Hóa Và Vai Trò Của Nó Trong Phản Ứng Thu Nhiệt
Năng lượng hoạt hóa (Ea) là năng lượng tối thiểu cần thiết để bắt đầu một phản ứng hóa học. Trong phản ứng thu nhiệt, năng lượng hoạt hóa thường cao hơn so với phản ứng tỏa nhiệt, vì cần nhiều năng lượng hơn để phá vỡ các liên kết ban đầu.
Chất xúc tác có vai trò quan trọng trong việc giảm năng lượng hoạt hóa, giúp phản ứng xảy ra dễ dàng hơn.
3. Ứng Dụng Thực Tế Của Phản Ứng Thu Nhiệt
Phản ứng thu nhiệt có nhiều ứng dụng quan trọng trong đời sống, khoa học và công nghiệp.
3.1. Trong Công Nghiệp Hóa Chất
- Sản xuất phân bón: Quá trình Haber-Bosch để tổng hợp ammonia (NH3) từ nitrogen và hydrogen là một phản ứng thu nhiệt.
- Điều chế các hợp chất hữu cơ: Nhiều phản ứng cracking và reforming trong công nghiệp hóa dầu là các quá trình thu nhiệt.
- Sản xuất vật liệu xây dựng: Nung đá vôi để sản xuất vôi sống (CaO) là một ứng dụng quan trọng.
3.2. Trong Đời Sống Hàng Ngày
- Túi chườm lạnh: Sử dụng phản ứng thu nhiệt để tạo ra cảm giác lạnh, giúp giảm đau và sưng tấy.
- Nấu ăn: Một số quá trình nấu ăn như nướng bánh cần nhiệt để các phản ứng hóa học xảy ra.
- Điều hòa không khí: Sử dụng các chất làm lạnh để hấp thụ nhiệt từ không gian bên trong, làm mát không khí.
3.3. Trong Nghiên Cứu Khoa Học
- Nghiên cứu về động học phản ứng: Phản ứng thu nhiệt được sử dụng để nghiên cứu các yếu tố ảnh hưởng đến tốc độ phản ứng.
- Phát triển vật liệu mới: Phản ứng thu nhiệt đóng vai trò quan trọng trong việc tổng hợp các vật liệu có tính chất đặc biệt.
- Ứng dụng trong công nghệ làm lạnh: Nghiên cứu và phát triển các hệ thống làm lạnh hiệu quả hơn dựa trên các phản ứng thu nhiệt.
4. Biến Thiên Enthalpy (ΔH) Trong Phản Ứng Thu Nhiệt
Biến thiên enthalpy là một khái niệm quan trọng để định lượng năng lượng trong các phản ứng hóa học.
4.1. Định Nghĩa Và Ý Nghĩa Của Biến Thiên Enthalpy (ΔH)
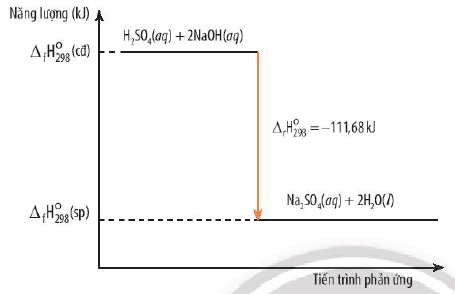
Biến thiên enthalpy (ΔH) là sự thay đổi về nhiệt của một hệ thống trong quá trình phản ứng hóa học ở áp suất không đổi. Nó cho biết lượng nhiệt được hấp thụ (phản ứng thu nhiệt) hoặc giải phóng (phản ứng tỏa nhiệt).
4.2. Cách Tính Biến Thiên Enthalpy Cho Phản Ứng Thu Nhiệt
ΔH được tính bằng hiệu giữa enthalpy của sản phẩm (Hsp) và enthalpy của chất phản ứng (Hcd):
ΔH = Hsp – Hcd
Trong phản ứng thu nhiệt, ΔH > 0, vì enthalpy của sản phẩm lớn hơn enthalpy của chất phản ứng.
Có nhiều phương pháp để tính ΔH:
- Sử dụng nhiệt tạo thành chuẩn: ΔH = ΣΔHf(sản phẩm) – ΣΔHf(chất phản ứng)
- Sử dụng định luật Hess: Tính ΔH dựa trên các phản ứng trung gian đã biết.
- Thực nghiệm: Đo lượng nhiệt hấp thụ trong quá trình phản ứng bằng calorimeter.
4.3. Ứng Dụng Của Biến Thiên Enthalpy Trong Tính Toán Và Dự Đoán Phản Ứng
ΔH giúp dự đoán khả năng xảy ra của phản ứng:
- ΔH < 0: Phản ứng tỏa nhiệt, có xu hướng xảy ra tự phát.
- ΔH > 0: Phản ứng thu nhiệt, cần cung cấp năng lượng để xảy ra.
Tuy nhiên, cần lưu ý rằng ΔH chỉ là một yếu tố. Entropy (ΔS) và nhiệt độ cũng ảnh hưởng đến tính tự phát của phản ứng, được thể hiện qua năng lượng Gibbs (ΔG = ΔH – TΔS).
5. Phương Trình Nhiệt Hóa Học Của Phản Ứng Thu Nhiệt
Phương trình nhiệt hóa học là cách biểu diễn phản ứng hóa học, bao gồm cả trạng thái vật lý của các chất và biến thiên enthalpy.
5.1. Cách Viết Phương Trình Nhiệt Hóa Học Cho Phản Ứng Thu Nhiệt
Phương trình nhiệt hóa học cho phản ứng thu nhiệt có dạng:
Chất phản ứng (trạng thái) → Sản phẩm (trạng thái) ; ΔH = + giá trị (kJ/mol)
Ví dụ:
CaCO3 (r) → CaO (r) + CO2 (k) ; ΔH = +178 kJ/mol
Lưu ý:
- Cần ghi rõ trạng thái vật lý của các chất (r: rắn, l: lỏng, k: khí, dd: dung dịch).
- ΔH luôn dương đối với phản ứng thu nhiệt.
- Giá trị ΔH tương ứng với số mol các chất trong phương trình. Nếu thay đổi hệ số, cần điều chỉnh giá trị ΔH tương ứng.
5.2. Ý Nghĩa Của Các Thông Số Trong Phương Trình Nhiệt Hóa Học
- Chất phản ứng và sản phẩm: Cho biết các chất tham gia và tạo thành trong phản ứng.
- Trạng thái vật lý: Ảnh hưởng đến giá trị enthalpy.
- ΔH: Cho biết lượng nhiệt hấp thụ (dấu dương) hoặc giải phóng (dấu âm) trong phản ứng.
5.3. Các Ví Dụ Về Phương Trình Nhiệt Hóa Học Của Phản Ứng Thu Nhiệt
- N2 (k) + O2 (k) → 2NO (k) ; ΔH = +180 kJ/mol
- H2O (l) → H2O (k) ; ΔH = +44 kJ/mol
- NH4Cl (r) → NH3 (k) + HCl (k) ; ΔH = +176 kJ/mol
6. Bài Tập Vận Dụng Về Phản Ứng Thu Nhiệt
Để củng cố kiến thức, hãy cùng giải một số bài tập vận dụng về phản ứng thu nhiệt.
6.1. Bài Tập Nhận Biết Phản Ứng Thu Nhiệt
Đề bài: Cho các phản ứng sau, phản ứng nào là phản ứng thu nhiệt?
a) CH4 (k) + 2O2 (k) → CO2 (k) + 2H2O (l) ; ΔH = -890 kJ/mol
b) N2 (k) + O2 (k) → 2NO (k) ; ΔH = +180 kJ/mol
c) NaOH (dd) + HCl (dd) → NaCl (dd) + H2O (l) ; ΔH = -57 kJ/mol
d) H2O (l) → H2O (k) ; ΔH = +44 kJ/mol
Đáp án: b) và d) là phản ứng thu nhiệt, vì ΔH > 0.
6.2. Bài Tập Tính Biến Thiên Enthalpy
Đề bài: Cho phản ứng:
CaCO3 (r) → CaO (r) + CO2 (k)
Biết nhiệt tạo thành chuẩn của CaCO3 (r) là -1207 kJ/mol, CaO (r) là -635 kJ/mol, CO2 (k) là -393.5 kJ/mol. Tính biến thiên enthalpy của phản ứng.
Giải:
ΔH = ΣΔHf(sản phẩm) – ΣΔHf(chất phản ứng)
ΔH = [ΔHf(CaO) + ΔHf(CO2)] – ΔHf(CaCO3)
ΔH = [(-635) + (-393.5)] – (-1207)
ΔH = +178.5 kJ/mol
6.3. Bài Tập Về Ứng Dụng Thực Tế
Đề bài: Giải thích vì sao khi trộn NH4Cl rắn với nước, nhiệt độ của dung dịch giảm xuống. Đây là ứng dụng của loại phản ứng nào?
Giải:
Khi trộn NH4Cl rắn với nước, xảy ra phản ứng thu nhiệt:
NH4Cl (r) → NH4+ (dd) + Cl- (dd) ; ΔH > 0
Phản ứng này hấp thụ nhiệt từ môi trường xung quanh (nước), làm giảm nhiệt độ của dung dịch. Đây là ứng dụng của phản ứng thu nhiệt để tạo ra cảm giác lạnh.
7. Mẹo Học Tập Hiệu Quả Về Phản Ứng Thu Nhiệt
Để nắm vững kiến thức về phản ứng thu nhiệt, bạn có thể áp dụng các mẹo sau:
7.1. Sử Dụng Sơ Đồ Tư Duy Để Hệ Thống Hóa Kiến Thức
Vẽ sơ đồ tư duy giúp bạn liên kết các khái niệm, phân loại và ghi nhớ thông tin dễ dàng hơn.
7.2. Học Qua Các Ví Dụ Thực Tế
Liên hệ kiến thức với các hiện tượng và ứng dụng trong đời sống giúp bạn hiểu sâu hơn và nhớ lâu hơn.
7.3. Luyện Tập Giải Bài Tập Đa Dạng
Thực hành giải nhiều dạng bài tập khác nhau giúp bạn làm quen với các dạng câu hỏi và rèn luyện kỹ năng giải quyết vấn đề.
7.4. Tham Gia Các Diễn Đàn, Cộng Đồng Học Tập
Trao đổi kiến thức, thảo luận và giải đáp thắc mắc cùng bạn bè và thầy cô giúp bạn học hỏi thêm nhiều điều mới và củng cố kiến thức.
8. Các Câu Hỏi Thường Gặp Về Phản Ứng Thu Nhiệt (FAQ)
Dưới đây là một số câu hỏi thường gặp về phản ứng thu nhiệt:
Câu 1: Phản ứng thu nhiệt có thể xảy ra tự phát không?
Không, phản ứng thu nhiệt không thể xảy ra tự phát, vì cần cung cấp năng lượng từ bên ngoài để phản ứng xảy ra.
Câu 2: Biến thiên enthalpy của phản ứng thu nhiệt có giá trị âm hay dương?
Biến thiên enthalpy của phản ứng thu nhiệt có giá trị dương (ΔH > 0).
Câu 3: Quang hợp là phản ứng thu nhiệt hay tỏa nhiệt?
Quang hợp là phản ứng thu nhiệt, vì cây xanh hấp thụ ánh sáng mặt trời để thực hiện quá trình này.
Câu 4: Làm thế nào để tăng tốc độ của phản ứng thu nhiệt?
Có thể tăng tốc độ của phản ứng thu nhiệt bằng cách tăng nhiệt độ, tăng nồng độ chất phản ứng, tăng diện tích bề mặt (đối với chất rắn) hoặc sử dụng chất xúc tác.
Câu 5: Phương trình nhiệt hóa học của phản ứng thu nhiệt có gì khác so với phản ứng tỏa nhiệt?
Trong phương trình nhiệt hóa học của phản ứng thu nhiệt, ΔH có giá trị dương, còn trong phản ứng tỏa nhiệt, ΔH có giá trị âm.
Câu 6: Phản ứng thu nhiệt có ứng dụng gì trong đời sống hàng ngày?
Phản ứng thu nhiệt được ứng dụng trong túi chườm lạnh, nấu ăn (một số quá trình), và điều hòa không khí.
Câu 7: Năng lượng hoạt hóa của phản ứng thu nhiệt thường cao hay thấp?
Năng lượng hoạt hóa của phản ứng thu nhiệt thường cao hơn so với phản ứng tỏa nhiệt.
Câu 8: Biến thiên enthalpy có phải là yếu tố duy nhất quyết định tính tự phát của phản ứng?
Không, biến thiên enthalpy chỉ là một yếu tố. Entropy và nhiệt độ cũng ảnh hưởng đến tính tự phát của phản ứng.
Câu 9: Chất xúc tác có ảnh hưởng đến biến thiên enthalpy của phản ứng không?
Không, chất xúc tác không ảnh hưởng đến biến thiên enthalpy của phản ứng, mà chỉ làm giảm năng lượng hoạt hóa.
Câu 10: Tại sao khi hòa tan một số chất vào nước, dung dịch lại trở nên lạnh hơn?
Khi hòa tan một số chất (ví dụ: NH4Cl) vào nước, xảy ra phản ứng thu nhiệt, hấp thụ nhiệt từ môi trường xung quanh (nước), làm giảm nhiệt độ của dung dịch.
9. Tại Sao Nên Tìm Hiểu Về Phản Ứng Thu Nhiệt Tại Tic.edu.vn?
Bạn đang gặp khó khăn trong việc tìm kiếm tài liệu học tập chất lượng và đáng tin cậy về phản ứng thu nhiệt? Bạn mất thời gian tổng hợp thông tin từ nhiều nguồn khác nhau? Bạn cần các công cụ hỗ trợ học tập hiệu quả để nâng cao năng suất? Bạn mong muốn kết nối với cộng đồng học tập để trao đổi kiến thức và kinh nghiệm?
tic.edu.vn cung cấp nguồn tài liệu học tập đa dạng, đầy đủ và được kiểm duyệt về phản ứng thu nhiệt và nhiều chủ đề khác. tic.edu.vn luôn cập nhật thông tin giáo dục mới nhất và chính xác, đồng thời cung cấp các công cụ hỗ trợ học tập trực tuyến hiệu quả. Bạn có thể tham gia cộng đồng học tập trực tuyến sôi nổi để tương tác và học hỏi lẫn nhau, cũng như tìm kiếm các khóa học và tài liệu giúp phát triển kỹ năng.
Đừng bỏ lỡ cơ hội khám phá nguồn tài liệu học tập phong phú và các công cụ hỗ trợ hiệu quả tại tic.edu.vn! Hãy truy cập ngay tic.edu.vn để bắt đầu hành trình chinh phục kiến thức và đạt được thành công trong học tập.
Thông tin liên hệ:
- Email: [email protected]
- Trang web: tic.edu.vn
tic.edu.vn luôn sẵn sàng đồng hành cùng bạn trên con đường học tập!