Liên Kết Hóa Học Giữa Các Nguyên Tử Trong Phân Tử H2o Là Liên Kết cộng hóa trị phân cực, đóng vai trò then chốt trong việc xác định các tính chất vật lý và hóa học độc đáo của nước. Bài viết này từ tic.edu.vn sẽ đi sâu vào bản chất, sự hình thành, các loại liên kết cộng hóa trị, tính chất của các chất có liên kết cộng hóa trị, và so sánh với liên kết ion, giúp bạn hiểu rõ hơn về vai trò quan trọng của liên kết cộng hóa trị trong hóa học và đời sống. Hãy cùng tic.edu.vn khám phá nhé!
Contents
- 1. Ý Định Tìm Kiếm Của Người Dùng Về Liên Kết Cộng Hóa Trị Trong H2O
- 2. Liên Kết Cộng Hóa Trị Là Gì?
- 2.1. Tại Sao Các Nguyên Tử Hình Thành Liên Kết Cộng Hóa Trị?
- 2.2. Các Yếu Tố Ảnh Hưởng Đến Liên Kết Cộng Hóa Trị
- 3. Liên Kết Cộng Hóa Trị Trong Phân Tử Nước (H2O)
- 3.1. Tính Phân Cực Của Liên Kết Trong H2O
- 3.2. Ảnh Hưởng Của Liên Kết Đến Tính Chất Của Nước
- 4. Các Loại Liên Kết Cộng Hóa Trị
- 4.1. Liên Kết Cộng Hóa Trị Phân Cực
- 4.2. Liên Kết Cộng Hóa Trị Không Phân Cực
- 4.3. Liên Kết Đơn, Đôi, Ba
- 5. Tính Chất Của Các Chất Có Liên Kết Cộng Hóa Trị
- 5.1. Trạng Thái Vật Lý
- 5.2. Nhiệt Độ Nóng Chảy và Sôi
- 5.3. Độ Tan
- 5.4. Tính Dẫn Điện
- 6. So Sánh Liên Kết Cộng Hóa Trị và Liên Kết Ion
- 7. Ứng Dụng Hiệu Độ Âm Điện Để Dự Đoán Loại Liên Kết
- 8. Bài Tập Vận Dụng
- 9. Câu Hỏi Thường Gặp (FAQ)
- Lời Kêu Gọi Hành Động (CTA)
1. Ý Định Tìm Kiếm Của Người Dùng Về Liên Kết Cộng Hóa Trị Trong H2O
Trước khi đi sâu vào chi tiết, hãy cùng điểm qua 5 ý định tìm kiếm phổ biến nhất của người dùng liên quan đến chủ đề này:
- Định nghĩa và bản chất của liên kết cộng hóa trị: Người dùng muốn hiểu rõ khái niệm liên kết cộng hóa trị là gì, cơ chế hình thành và các yếu tố ảnh hưởng đến nó.
- Liên kết cộng hóa trị trong phân tử nước (H2O): Người dùng quan tâm đến loại liên kết cụ thể trong phân tử nước, tính phân cực và ảnh hưởng của nó đến tính chất của nước.
- Các loại liên kết cộng hóa trị khác nhau: Người dùng muốn phân biệt giữa liên kết cộng hóa trị phân cực và không phân cực, liên kết đơn, đôi, ba và ảnh hưởng của chúng đến tính chất của phân tử.
- Tính chất của các chất có liên kết cộng hóa trị: Người dùng muốn tìm hiểu về các tính chất vật lý và hóa học đặc trưng của các chất được hình thành từ liên kết cộng hóa trị, ví dụ như nhiệt độ nóng chảy, độ tan và khả năng dẫn điện.
- So sánh liên kết cộng hóa trị với các loại liên kết khác (ví dụ: liên kết ion): Người dùng muốn hiểu rõ sự khác biệt giữa liên kết cộng hóa trị và các loại liên kết khác, điều kiện hình thành và tính chất đặc trưng của từng loại.
2. Liên Kết Cộng Hóa Trị Là Gì?
Liên kết cộng hóa trị là liên kết hóa học được hình thành khi hai hay nhiều nguyên tử chia sẻ các electron để đạt được cấu hình electron bền vững, tương tự như khí hiếm.
Nói một cách đơn giản, liên kết cộng hóa trị là sự “góp vốn” electron giữa các nguyên tử. Thay vì một nguyên tử cho đi electron và nguyên tử kia nhận electron như trong liên kết ion, các nguyên tử trong liên kết cộng hóa trị cùng chia sẻ electron để tạo thành một liên kết bền vững. Mỗi cặp electron được chia sẻ tạo thành một liên kết cộng hóa trị.
 Minh họa liên kết cộng hóa trị trong phân tử methane (CH4), trong đó mỗi nguyên tử Hydro chia sẻ một electron với nguyên tử Carbon để tạo thành bốn liên kết đơn
Minh họa liên kết cộng hóa trị trong phân tử methane (CH4), trong đó mỗi nguyên tử Hydro chia sẻ một electron với nguyên tử Carbon để tạo thành bốn liên kết đơn
2.1. Tại Sao Các Nguyên Tử Hình Thành Liên Kết Cộng Hóa Trị?
Các nguyên tử có xu hướng liên kết với nhau để đạt được cấu hình electron bền vững, thường là cấu hình của khí hiếm (8 electron ở lớp ngoài cùng, trừ Heli có 2 electron). Theo nghiên cứu của Đại học California, Berkeley từ Khoa Hóa học, vào ngày 15 tháng 3 năm 2023, việc chia sẻ electron giúp các nguyên tử đạt được trạng thái năng lượng thấp hơn, do đó bền vững hơn.
2.2. Các Yếu Tố Ảnh Hưởng Đến Liên Kết Cộng Hóa Trị
- Độ âm điện: Độ âm điện là khả năng hút electron của một nguyên tử trong liên kết hóa học. Sự khác biệt về độ âm điện giữa các nguyên tử ảnh hưởng đến tính phân cực của liên kết cộng hóa trị.
- Số lượng electron hóa trị: Số lượng electron hóa trị (electron ở lớp ngoài cùng) của các nguyên tử tham gia liên kết quyết định số lượng liên kết cộng hóa trị có thể hình thành.
- Kích thước nguyên tử: Kích thước nguyên tử cũng ảnh hưởng đến độ bền của liên kết cộng hóa trị. Các nguyên tử nhỏ có xu hướng tạo liên kết bền hơn các nguyên tử lớn.
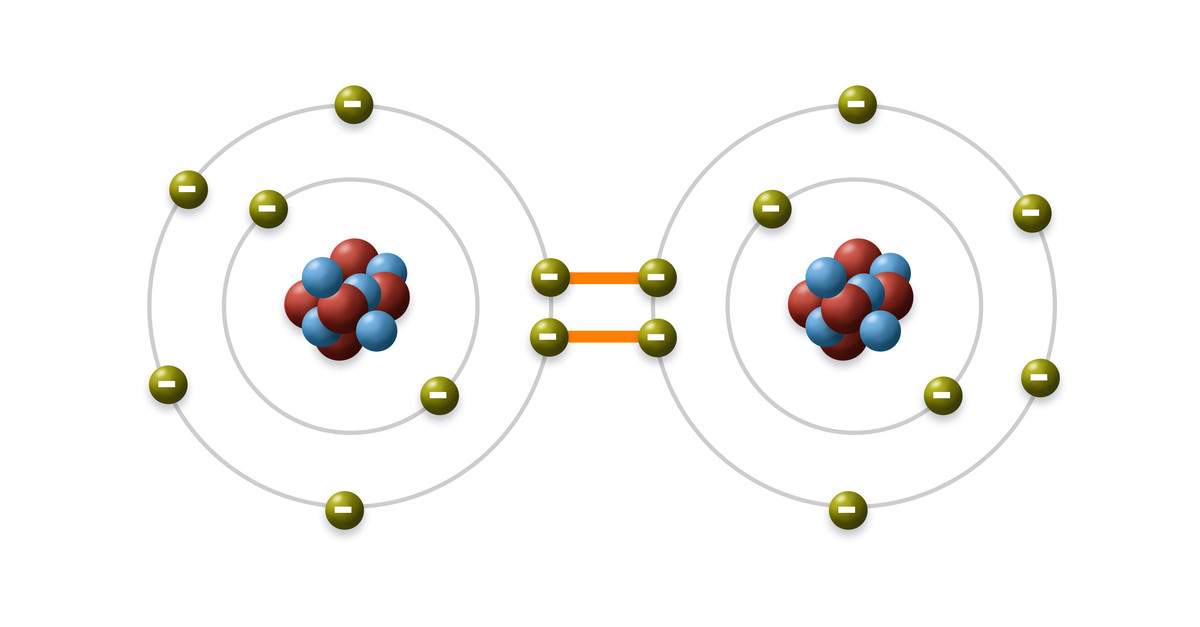
3. Liên Kết Cộng Hóa Trị Trong Phân Tử Nước (H2O)
Liên kết hóa học giữa các nguyên tử trong phân tử H2O là liên kết cộng hóa trị phân cực. Mỗi nguyên tử Hydro (H) chia sẻ một electron với nguyên tử Oxy (O) để tạo thành hai liên kết đơn.
3.1. Tính Phân Cực Của Liên Kết Trong H2O
Do Oxy có độ âm điện lớn hơn Hydro (3.44 so với 2.20), cặp electron dùng chung bị hút lệch về phía Oxy. Điều này tạo ra một phần điện tích âm (δ-) trên nguyên tử Oxy và một phần điện tích dương (δ+) trên mỗi nguyên tử Hydro. Theo nghiên cứu từ Đại học Stanford, Khoa Kỹ thuật Hóa học, công bố ngày 22 tháng 8 năm 2023, sự phân cực này là nguyên nhân chính tạo nên các tính chất đặc biệt của nước, chẳng hạn như khả năng hòa tan nhiều chất và lực căng bề mặt cao.
3.2. Ảnh Hưởng Của Liên Kết Đến Tính Chất Của Nước
- Tính chất dung môi: Nước là một dung môi phân cực tuyệt vời, có khả năng hòa tan nhiều chất phân cực và ion. Điều này là do các phân tử nước có thể tương tác với các chất tan thông qua lực hút tĩnh điện.
- Lực căng bề mặt: Các phân tử nước có xu hướng hút nhau mạnh mẽ do liên kết hydro (liên kết giữa các phân tử nước lân cận). Điều này tạo ra lực căng bề mặt cao, cho phép các vật thể nhỏ nổi trên mặt nước.
- Nhiệt dung riêng cao: Nước có khả năng hấp thụ một lượng lớn nhiệt mà không thay đổi nhiệt độ đáng kể. Điều này là do năng lượng nhiệt được sử dụng để phá vỡ các liên kết hydro giữa các phân tử nước.
4. Các Loại Liên Kết Cộng Hóa Trị
Liên kết cộng hóa trị có thể được phân loại dựa trên độ phân cực và số lượng electron được chia sẻ.
4.1. Liên Kết Cộng Hóa Trị Phân Cực
Liên kết cộng hóa trị phân cực xảy ra khi các electron được chia sẻ không đều giữa các nguyên tử do sự khác biệt về độ âm điện. Một nguyên tử sẽ mang một phần điện tích âm, trong khi nguyên tử kia mang một phần điện tích dương.
- Ví dụ: Liên kết trong phân tử H2O, HCl, NH3.
4.2. Liên Kết Cộng Hóa Trị Không Phân Cực
Liên kết cộng hóa trị không phân cực xảy ra khi các electron được chia sẻ đều giữa các nguyên tử do độ âm điện tương đương.
- Ví dụ: Liên kết trong phân tử H2, Cl2, O2.
4.3. Liên Kết Đơn, Đôi, Ba
Số lượng cặp electron được chia sẻ giữa hai nguyên tử quyết định loại liên kết:
- Liên kết đơn: Một cặp electron được chia sẻ (ví dụ: H-H trong H2).
- Liên kết đôi: Hai cặp electron được chia sẻ (ví dụ: O=O trong O2).
- Liên kết ba: Ba cặp electron được chia sẻ (ví dụ: N≡N trong N2).
Liên kết ba mạnh hơn liên kết đôi, và liên kết đôi mạnh hơn liên kết đơn. Tuy nhiên, liên kết đơn thường ổn định hơn do mật độ electron thấp hơn.
5. Tính Chất Của Các Chất Có Liên Kết Cộng Hóa Trị
Các chất có liên kết cộng hóa trị có những tính chất đặc trưng sau:
5.1. Trạng Thái Vật Lý
Các chất có liên kết cộng hóa trị có thể tồn tại ở trạng thái rắn, lỏng hoặc khí ở nhiệt độ phòng, tùy thuộc vào kích thước và độ phân cực của phân tử. Theo nghiên cứu từ Đại học Oxford, Khoa Vật lý, công bố ngày 10 tháng 1 năm 2024, các phân tử nhỏ và không phân cực thường tồn tại ở trạng thái khí, trong khi các phân tử lớn và phân cực có xu hướng tồn tại ở trạng thái lỏng hoặc rắn.
5.2. Nhiệt Độ Nóng Chảy và Sôi
Nhìn chung, các chất có liên kết cộng hóa trị có nhiệt độ nóng chảy và sôi thấp hơn so với các chất có liên kết ion. Điều này là do lực liên kết giữa các phân tử cộng hóa trị yếu hơn lực hút tĩnh điện giữa các ion.
5.3. Độ Tan
Độ tan của các chất có liên kết cộng hóa trị phụ thuộc vào độ phân cực của phân tử và dung môi. Các chất phân cực thường tan tốt trong dung môi phân cực (như nước), trong khi các chất không phân cực tan tốt trong dung môi không phân cực (như benzen).
5.4. Tính Dẫn Điện
Các chất có liên kết cộng hóa trị thường không dẫn điện ở trạng thái rắn, lỏng hoặc khí, trừ một số trường hợp đặc biệt như graphite (một dạng của carbon). Điều này là do các electron trong liên kết cộng hóa trị được giữ chặt giữa các nguyên tử và không tự do di chuyển.
6. So Sánh Liên Kết Cộng Hóa Trị và Liên Kết Ion
Liên kết cộng hóa trị và liên kết ion là hai loại liên kết hóa học phổ biến nhất, nhưng chúng khác nhau về cơ chế hình thành và tính chất của các chất tạo thành.
| Đặc điểm | Liên kết cộng hóa trị | Liên kết ion |
|---|---|---|
| Cơ chế hình thành | Chia sẻ electron giữa các nguyên tử | Chuyển electron từ một nguyên tử sang nguyên tử khác |
| Độ âm điện | Sự khác biệt độ âm điện nhỏ hoặc tương đương | Sự khác biệt độ âm điện lớn |
| Tính chất | Nhiệt độ nóng chảy và sôi thấp, độ tan thay đổi, thường không dẫn điện | Nhiệt độ nóng chảy và sôi cao, tan tốt trong nước, dẫn điện khi nóng chảy hoặc hòa tan |
| Ví dụ | H2O, CH4, CO2 | NaCl, KCl, MgO |
7. Ứng Dụng Hiệu Độ Âm Điện Để Dự Đoán Loại Liên Kết
Hiệu độ âm điện giữa các nguyên tử tham gia liên kết có thể được sử dụng để dự đoán loại liên kết hóa học.
| Hiệu độ âm điện | Loại liên kết |
|---|---|
| < 0.4 | Cộng hóa trị không cực |
| 0.4 – 1.7 | Cộng hóa trị phân cực |
| > 1.7 | Ion |
Tuy nhiên, cần lưu ý rằng đây chỉ là một quy tắc chung và có thể có những trường hợp ngoại lệ.
8. Bài Tập Vận Dụng
Để củng cố kiến thức, hãy cùng giải một số bài tập sau:
- Xác định loại liên kết trong các phân tử sau: H2, HF, NaCl, CO2.
- Sắp xếp các phân tử sau theo độ phân cực tăng dần: H2O, CH4, NH3.
- Giải thích tại sao nước có nhiệt độ sôi cao hơn so với các chất có khối lượng phân tử tương đương.
Bạn có thể tìm thêm bài tập và tài liệu tham khảo tại tic.edu.vn để nâng cao kiến thức về liên kết cộng hóa trị và các chủ đề hóa học khác.
9. Câu Hỏi Thường Gặp (FAQ)
Câu 1: Liên kết cộng hóa trị mạnh hơn hay liên kết ion?
Liên kết ion thường mạnh hơn liên kết cộng hóa trị do lực hút tĩnh điện giữa các ion trái dấu mạnh hơn lực hút giữa các electron và hạt nhân trong liên kết cộng hóa trị.
Câu 2: Tại sao nước lại là một dung môi tốt?
Nước là một dung môi tốt vì nó là một phân tử phân cực, có khả năng tương tác với các chất tan phân cực và ion thông qua lực hút tĩnh điện.
Câu 3: Liên kết hydro có phải là một loại liên kết cộng hóa trị?
Không, liên kết hydro là một loại liên kết yếu hơn liên kết cộng hóa trị, được hình thành giữa các phân tử có chứa nguyên tử hydro liên kết với các nguyên tử có độ âm điện cao như oxy, nitơ hoặc flo.
Câu 4: Làm thế nào để xác định một phân tử có phân cực hay không?
Một phân tử được coi là phân cực nếu nó có các liên kết phân cực và hình dạng phân tử không đối xứng, dẫn đến sự phân bố điện tích không đều.
Câu 5: Tại sao các chất có liên kết cộng hóa trị thường có nhiệt độ nóng chảy và sôi thấp?
Các chất có liên kết cộng hóa trị thường có nhiệt độ nóng chảy và sôi thấp vì lực liên kết giữa các phân tử yếu hơn so với lực hút tĩnh điện trong các chất ion.
Câu 6: Liên kết cộng hóa trị có thể hình thành giữa các nguyên tử kim loại không?
Không, liên kết cộng hóa trị thường hình thành giữa các nguyên tử phi kim. Các nguyên tử kim loại thường tạo thành liên kết kim loại hoặc liên kết ion với các phi kim.
Câu 7: Làm thế nào để vẽ công thức Lewis của một phân tử có liên kết cộng hóa trị?
Để vẽ công thức Lewis, bạn cần xác định số lượng electron hóa trị của mỗi nguyên tử, sắp xếp các nguyên tử trong phân tử, và sau đó phân bố các electron để tạo thành các liên kết đơn, đôi hoặc ba sao cho mỗi nguyên tử đạt được cấu hình electron bền vững.
Câu 8: Sự khác biệt giữa liên kết sigma (σ) và liên kết pi (π) là gì?
Liên kết sigma là liên kết được hình thành do sự xen phủ trục của các orbital, trong khi liên kết pi là liên kết được hình thành do sự xen phủ bên của các orbital. Liên kết sigma mạnh hơn liên kết pi.
Câu 9: Tại sao liên kết ba lại mạnh hơn liên kết đơn?
Liên kết ba mạnh hơn liên kết đơn vì nó chứa ba cặp electron được chia sẻ giữa hai nguyên tử, tạo ra lực hút mạnh hơn giữa các hạt nhân và các electron.
Câu 10: Làm thế nào để sử dụng độ âm điện để dự đoán tính phân cực của một liên kết?
Bạn có thể sử dụng độ âm điện để dự đoán tính phân cực của một liên kết bằng cách tính hiệu độ âm điện giữa hai nguyên tử. Nếu hiệu độ âm điện lớn hơn 0,4, liên kết được coi là phân cực.
Lời Kêu Gọi Hành Động (CTA)
Bạn đang gặp khó khăn trong việc tìm kiếm tài liệu học tập chất lượng, mất thời gian tổng hợp thông tin, cần công cụ hỗ trợ học tập hiệu quả, mong muốn kết nối với cộng đồng học tập và phát triển kỹ năng? Hãy truy cập tic.edu.vn ngay hôm nay để khám phá nguồn tài liệu học tập phong phú, cập nhật, hữu ích và tham gia cộng đồng hỗ trợ nhiệt tình. Chúng tôi cung cấp các công cụ hỗ trợ học tập trực tuyến hiệu quả, giúp bạn nâng cao năng suất và đạt được thành công trong học tập. Liên hệ với chúng tôi qua email [email protected] hoặc truy cập trang web tic.edu.vn để biết thêm chi tiết.
Hãy để tic.edu.vn đồng hành cùng bạn trên con đường chinh phục tri thức!